最新酸碱盐的反应规律资料
中考化学 酸碱盐反应规律

酸碱盐的反应规律及模拟试题具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气→金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
②碱性氧化物+ 水→可溶性碱可溶性碱对应的碱性氧化物能与水反应生成对应的碱,K2O、Na2O、BaO都能跟水反应。
Ca(OH)2微溶于水,它对应的CaO也能与水反应。
其余的碱性氧化物一般与水不反应或不易反应。
③碱→盐由碱转化成盐的三个途径:碱+ 酸性氧化物→盐+ 水碱+ 酸→盐+ 水碱+ 某些盐→新碱+ 新盐④碱→碱性氧化物+ 水不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易分解。
⑤非金属+ 氧气→非金属氧化物除F2、Cl2、Br2、I2外的非金属,一般都可直接与O2反应生成非金属氧化物。
非金属氧化物大多数是酸性氧化物。
⑥酸性氧化物+ 水→含氧酸除不溶性的SiO2外,常见的酸性氧化物都可与水反应生成对应的含氧酸。
⑦酸→盐由酸转化成盐有四个途径:某些金属+ 某些酸→盐+ 氢气酸+ 碱性氧化物→盐+ 水酸+ 碱→盐+ 水酸+ 某些盐→另一种酸+ 另一种盐⑧酸→酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属→无氧酸盐此处的非金属H2、O2除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
⑩酸性氧化物+ 碱性氧化物→含氧酸盐(非初三知识)强酸(H2SO4、HNO3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物+ 酸→盐+ 水强酸(H2SO4、HNO3、HCl)可与所有碱性氧化物反应,弱酸(H2CO3、H2S等)只能和活泼金属的氧化物反应。
酸性氧化物+ 碱→盐+ 水酸性氧化物在一般条件下都可与强碱溶液反应,但SiO2与NaOH固体(或KOH固体)需在强热条件下才发反应。
酸碱盐的反应规律

.酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气?金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
②碱性氧化物+ 水?可溶性碱可溶性碱对应的碱性氧化物能与水反应生成对应的碱,KO、NaO、BaO都能跟水反应。
22Ca(OH)微溶于水,它对应的CaO也能与水反应。
其余的碱性氧化物一般与水不反应或2不易反应。
③碱?盐由碱转化成盐的三个途径:碱+ 酸性氧化物?盐+ 水碱+ 酸?盐+ 水碱+ 某些盐?另一种碱+ 另一种盐④碱?碱性氧化物+ 水不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易分解。
...⑤非金属+ 氧气?非金属氧化物除F、Cl、Br、I外的非金属,一般都可直接与O反应生成非金属氧化物。
非金属氧22222化物大多数是酸性氧化物。
⑥酸性氧化物+ 水?含氧酸除不溶性的SiO外,常见的酸性氧化物都可与水反应生成对应的含氧酸。
2⑦酸?盐由酸转化成盐有四个途径:某些金属+ 某些酸?盐+ 氢气酸+ 碱性氧化物?盐+ 水酸+ 碱?盐+ 水酸+ 某些盐?另一种酸+ 另一种盐⑧酸?酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属?无氧酸盐此处的非金属H、O除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
22⑩酸性氧化物+ 碱性氧化物?含氧酸盐(非初三知识)强酸(HSO、HNO)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加324热或高温条件下才能发生反应。
碱性氧化物+ 酸?盐+ 水强酸(HSO、HNO、HCl)可与所有碱性氧化物反应,弱酸(HCO、HS等)只能233224和活泼金属的氧化物反应。
酸性氧化物+ 碱?盐+ 水酸性氧化物在一般条件下都可与强碱溶液反应,但SiO与NaOH固体(或KOH固体)2需在强热条件下才发反应。
酸碱盐相遇反应先后顺序

酸碱盐相遇反应先后顺序【最新版】目录1.酸碱盐反应的基本概念2.酸碱盐反应的先后顺序3.影响反应先后顺序的因素4.实际应用中的注意点正文一、酸碱盐反应的基本概念酸碱盐反应,是指酸、碱和盐这三类化合物在溶液中发生的化学反应。
在这类反应中,酸、碱和盐的离子互相结合,生成新的化合物。
酸碱盐反应是化学领域中非常基础且常见的一类反应。
二、酸碱盐反应的先后顺序在酸碱盐反应中,反应的先后顺序受到离子浓度、反应物的物理性质和化学性质等多种因素的影响。
通常情况下,我们可以根据以下几个原则来判断反应的先后顺序:1.强酸制弱酸:当两种酸同时存在时,强酸会优先与碱反应,生成相应的盐和水,从而制备出弱酸。
2.弱酸制强酸:当弱酸与强酸同时存在时,弱酸会优先与碱反应,生成相应的盐和水,从而制备出强酸。
3.盐与盐反应:当两种盐同时存在时,反应的先后顺序取决于它们的溶解度和反应物的物理性质。
通常情况下,溶解度较大的盐会优先反应。
三、影响反应先后顺序的因素除了离子浓度、反应物的物理性质和化学性质外,还有一些其他因素会影响酸碱盐反应的先后顺序,例如:1.反应温度:温度对反应速率有显著影响,通常情况下,温度越高,反应速率越快。
2.反应物的浓度:反应物的浓度越大,反应速率越快。
3.催化剂:催化剂可以降低反应的活化能,从而加速反应速率。
四、实际应用中的注意点在实际应用中,我们需要根据具体的情况来判断酸碱盐反应的先后顺序,并采取相应的措施来控制反应过程。
此外,我们还需要注意以下几点:1.确保安全:在实验过程中,要严格遵守实验室安全规程,确保实验安全。
2.准确测量:在实验过程中,要准确测量各种反应物的浓度、温度等参数,以保证实验数据的准确性。
3.选择合适的催化剂:根据反应的特点,选择合适的催化剂,以提高反应速率。
总之,酸碱盐反应的先后顺序受到多种因素的影响,我们需要根据具体情况来判断,并采取相应的措施来控制反应过程。
金属、氧化物、酸、碱、盐之间的反应规律以及发生条件

金属、氧化物、酸、碱、盐之间的反应规律以及发生条件(八种反应生成盐反应)1. 活泼金属 + 酸 → 盐 + H 2↑ 反应条件:① 在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢生成氢气。
② 反应物中的酸不能为HNO 3或浓H 2SO 4等氧化性酸。
例:Zn + 2HCl = ZnCl 2 + H 2↑ Fe + H 2SO 4(稀) = FeSO 4 + H 2↑Zn+2HNO 3 = Zn(NO 3)2 + H 2↑(×) Fe + H 2SO 4(浓) = FeSO 4 + H 2↑(×)2. 金属 + 盐 → 新盐 + 新金属 反应条件:① 反应物中金属单质不能为K 、Ca 、Na 等特别活泼的金属。
② 盐必须是溶液(即盐必须可溶于水),否则固体与固体常温下难反应。
③ 对金属来说,必须是活泼金属置换出盐中的不活泼金属。
④ 多种金属同时在盐溶液(或在混合溶液)中反应,反应的先后顺序要视金属间的活动性来确定:金属活动性相差越大,置换反应越易发生(优先反应)。
例:Fe + CuSO 4 = FeSO 4 + Cu Cu + 2AgNO 3 = 2Ag + Cu(NO 3)2Zn + AgCl → 不反应 2Na + CuSO 4 = Na 2SO 4 + Cu(×)3. 金属氧化物 + 酸 → 盐 + H 2O 反应条件:① 反应物中至少有一种可溶于水。
② 酸常指H 2SO 4、HCl 、HNO 3等强酸。
例: Na 2O + 2HCl = 2NaCl + H 2O Al 2O 3 + 3H 2SO 4 = Al 2(SO 4)3 + 3H 2OFe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O CuO + H 2SO 4 = CuSO 4 + H 2O4. 非金属氧化物 + 碱 → 盐 + H 2O (注:不是复分解反应)注意:该类反应不属于复分解反应。
最新酸碱盐的反应规律资料
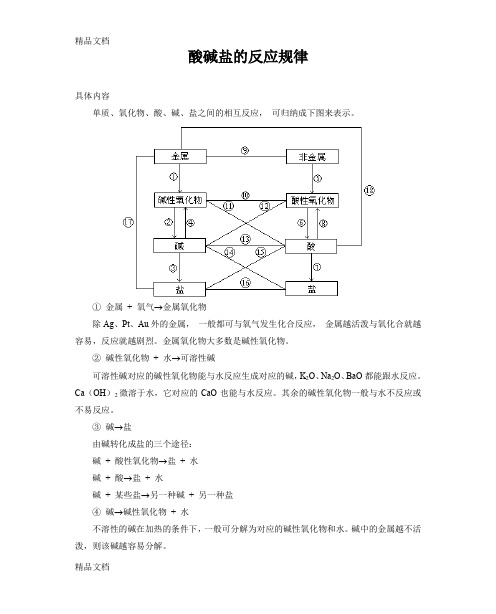
酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气→金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
②碱性氧化物+ 水→可溶性碱可溶性碱对应的碱性氧化物能与水反应生成对应的碱,K2O、Na2O、BaO都能跟水反应。
Ca(OH)2微溶于水,它对应的CaO也能与水反应。
其余的碱性氧化物一般与水不反应或不易反应。
③碱→盐由碱转化成盐的三个途径:碱+ 酸性氧化物→盐+ 水碱+ 酸→盐+ 水碱+ 某些盐→另一种碱+ 另一种盐④碱→碱性氧化物+ 水不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易分解。
⑤非金属+ 氧气→非金属氧化物除F2、Cl2、Br2、I2外的非金属,一般都可直接与O2反应生成非金属氧化物。
非金属氧化物大多数是酸性氧化物。
⑥酸性氧化物+ 水→含氧酸除不溶性的SiO2外,常见的酸性氧化物都可与水反应生成对应的含氧酸。
⑦酸→盐由酸转化成盐有四个途径:某些金属+ 某些酸→盐+ 氢气酸+ 碱性氧化物→盐+ 水酸+ 碱→盐+ 水酸+ 某些盐→另一种酸+ 另一种盐⑧酸→酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属→无氧酸盐此处的非金属H2、O2除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
⑩酸性氧化物+ 碱性氧化物→含氧酸盐(非初三知识)强酸(H2SO4、HNO3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物+ 酸→盐+ 水强酸(H2SO4、HNO3、HCl)可与所有碱性氧化物反应,弱酸(H2CO3、H2S等)只能和活泼金属的氧化物反应。
酸性氧化物+ 碱→盐+ 水酸性氧化物在一般条件下都可与强碱溶液反应,但SiO2与NaOH固体(或KOH固体)需在强热条件下才发反应。
酸 碱 盐反应规律及条件

酸碱盐反应规律及条件一、酸的化学性质1.酸与指示剂反应酸与酚酞色与石蕊溶液变色2.酸+活泼金属=(金属为H前酸为稀H2SO4,稀HCL)Mg+HCl= Mg+H2SO4=Zn+HCl= Zn +H2SO4=Fe+HCl= Fe +H2SO4=3.酸+金属氧化物=CuO+ HCl= Fe2O3+ HCl=Fe2O3+H2SO4= CuO+H2SO4=4.酸+碱=Mg(OH)2+ HCl= Mg(OH)2+ H2SO4=NaOH+ HCl=Al(OH)3+ HCl=5.酸+盐=(生成物符合复分解反应条件)BaCl2+ H2SO4= CaCO3+ HCl=AgNO3+ HCl=二、碱的化学性质1.碱与指示剂反应:碱遇酚酞变色,遇石蕊变色。
2.碱+非金属氧化物=CO2+NaOH= CO2+Ca(OH)2=SO2+ NaOH= SO3+ NaOH= 3.碱+酸=Cu(OH)2+H2SO4= KOH+HCl=Ba(OH)2+H2SO4=4.碱+盐=(反应物均溶于水,生成物有↓)CuSO4+NaOH= Na2CO3 +Ca(OH)2= FeCl3+NaOH=CuSO4+Ca(OH)2=三、盐的化学性质1.盐+金属= (盐可溶,金属比盐中金属活泼)Al+CuSO4= Cu+AgNO3=Fe+CuSO4=2.盐+酸=(盐可溶,生成物符合复分解反应条件)K2CO3+HCl=NaHCO3+HCl=3.盐+碱=CuCl2+NaOH=K2CO3+Ca(OH)2=4.盐+盐= (反应物均溶于水,生成物之一有↓产生) BaCl2+Na2SO4= CaCl2+ Na2CO3= AgNO3+NaCl=。
酸碱盐反应规律及主要方程式

酸碱盐反应规律及主要方程式1. 酸碱盐的基本概念大家好,今天咱们要聊聊那些在化学课堂上经常见到的酸、碱和盐,嘿!这些家伙在化学反应中可是很有趣的角色。
酸和碱就像老朋友,经常打打闹闹,但他们的“吵架”其实有规律可循。
酸一般是那种有点“酸溜溜”的东西,比如说我们用的醋,里面有醋酸;碱呢,往往让人感觉比较“滑溜溜”的,比如我们家里的肥皂水,里面的氢氧化钠就是个典型的碱。
盐嘛,就是酸和碱“和好如初”后的产物,简单来说就是他们反应后的“结婚生子”!1.1 酸碱反应的基本规律说到酸碱反应,这里有个简单的规律:酸加碱,就会产生盐和水。
就像是两个人打架,然后突然发现其实彼此还挺合得来,最后和平相处,结果就生产出盐和水这种“和解的产物”。
这个过程的化学方程式可以写成:酸 + 碱→ 盐 + 水。
例如,拿硫酸(H₂SO₄)和氢氧化钠(NaOH)来举例,它们的反应方程式是:H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O。
是不是很简单?酸和碱“牵手”后,就变成盐和水啦!1.2 酸碱盐反应的实际应用这些反应不仅仅是理论上的,生活中我们也经常见到。
例如,胃酸过多时,我们会吃点抗酸药,这些药物中含有的碱性物质会和胃酸反应,生成盐和水,从而缓解胃酸问题。
再比如,当你把肥皂水滴在污垢上,肥皂中的碱性成分会和污垢反应,最终把污垢清理干净,这不也是酸碱反应的一种应用吗?2. 盐的形成及其方程式盐的形成其实是一种化学反应的“终极成果”。
在很多化学反应中,我们都可以看到盐的身影,它是酸和碱反应的“孩子”。
当酸和碱混合时,生成的盐可以有很多种类,比如氯化钠(NaCl),就是我们平时用的食盐;还有硫酸钠(Na₂SO₄),常用于清洁剂中。
每一种盐的形成都可以通过化学方程式来表达。
例如,盐酸(HCl)和氢氧化钠(NaOH)反应生成的盐是氯化钠,方程式是:HCl + NaOH → NaCl + H₂O。
2.1 酸盐与碱盐的区别盐的种类很多,我们可以把它们分成酸盐和碱盐。
酸碱盐反应规律及主要方程式

酸碱盐反应规律及主要方程式1. 酸碱盐的基本概念酸碱盐,听起来好像是化学课上那些枯燥的知识点,其实它们可有趣了!简单来说,酸是能释放氢离子的物质,碱则是能释放氢氧根离子的。
而盐,嘿,就是酸和碱反应后形成的产物。
你可以把它们想象成化学界的一对情侣,酸和碱相遇,火花四溅,最后结成了“盐”的幸福家庭。
让我们来举个简单的例子:醋就是酸,肥料里的氨水就是碱。
你在厨房做菜时,醋和小苏打的结合也就是酸碱反应的缩影,咕噜咕噜冒泡的声音,可是个好听的化学交响乐!而盐,哦,调味的好帮手,无处不在。
2. 酸碱盐的反应规律2.1 中和反应说到酸碱盐,咱们不能不提中和反应。
简单来说,中和反应就是酸和碱碰在一起,互相“消灭”,最后变成盐和水。
就像一对冤家,斗嘴斗了一场,最后和好如初,大家都变得“清爽”了。
方程式写出来就是:酸 + 碱→ 盐 + 水这可不只是个公式,生活中随处可见。
想想那日常的醋酸和氢氧化钠的反应,嘿,调和之后就得到了盐水,给你做菜时提供了不可或缺的调味品。
2.2 酸碱盐的性质酸碱盐可不是千篇一律的,它们的性质差别可大了。
酸一般会让你感到“酸溜溜”的,而碱则有点滑腻。
盐呢,往往是咸咸的,味道还挺好!酸性物质一般pH值低于7,碱性则高于7,而中性盐的pH值接近7。
换句话说,酸和碱就像是阴阳,互补又对立。
而且,盐的用途可广了,不光是厨房的调味品,工业生产中也少不了它。
它们在生活中的表现可真是五花八门,不像某些人,光会在一旁看热闹。
3. 常见的酸碱盐反应3.1 典型的反应例子说到常见的反应,咱们可以拿硫酸和氢氧化钠的反应来举个例子。
这可是个经典的“夫妻档”!方程式是:H2SO4 + 2NaOH → Na2SO4 + 2H2O 。
看到了没?酸和碱合力变成了盐和水,真是太有爱了。
硫酸就像是一个霸道总裁,而氢氧化钠则是温柔贤惠的贤内助,两者一结合,诞生了盐!3.2 应用与影响而这些反应不仅仅停留在教科书上,在生活中随处可见。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精品文档酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
金属------------ - -------- 非金属①金属+氧气r金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
②碱性氧化物+水一.可溶性碱可溶性碱对应的碱性氧化物能与水反应生成对应的碱,K2O、Na20、BaO都能跟水反应。
Ca(OH)2微溶于水,它对应的CaO也能与水反应。
其余的碱性氧化物一般与水不反应或不易反应。
③碱r盐由碱转化成盐的三个途径:碱+酸性氧化物一;盐+水碱+酸一;盐+水碱+某些盐r另一种碱+另一种盐④碱一•碱性氧化物+水不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易分解。
精品文档⑤非金属+氧气T非金属氧化物除F2、CI2、B「2、I2外的非金属,一般都可直接与。
2反应生成非金属氧化物。
非金属氧化物大多数是酸性氧化物。
⑥酸性氧化物+水一;含氧酸除不溶性的SiO2外,常见的酸性氧化物都可与水反应生成对应的含氧酸。
⑦酸一:盐由酸转化成盐有四个途径:某些金属+某些酸 '盐+氢气酸+碱性氧化物一;盐+水酸+碱一•盐+水酸+某些盐一•另一种酸+另一种盐⑧酸一;酸性氧化物+水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+非金属r无氧酸盐此处的非金属H2、。
2除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
⑩酸性氧化物+碱性氧化物一•含氧酸盐(非初三知识)强酸(H2SO4、HNO3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
3碱性氧化物+酸》盐+水强酸(H2SO4、HNO 3、HCI)可与所有碱性氧化物反应,弱酸(H2CO3、H2S等)只能和活泼金属的氧化物反应。
㊂酸性氧化物+碱r盐+水酸性氧化物在一般条件下都可与强碱溶液反应,但SiO2与NaOH固体(或KOH固体)需在强热条件下才发反应。
2酸+碱 '盐+水参加反应的酸和碱至少有一种是易溶于水的。
「-碱+盐r另一种碱+另一种盐参加反应的碱和盐必须都能溶于水,同时生成物中必须有难溶物或容易挥发的碱(NH3 •出0)。
精品文档I;酸+盐 '另一种酸+另一种盐酸和盐反应的前提条件比较复杂,在现阶段应掌握以下几点:这里所说的酸和盐的反应是在水溶液中发生的复分解反应,必须符合复分解反应发生的条件,酸与盐才能发生反应。
如果反应物中的盐是难溶物,那么生成物必须都是可溶的,否则反应将不能继续进行。
在实验室用石灰石制取C02时,只能选用盐酸而不能用硫酸,就是这个道理。
必须掌握弱酸盐(如Na2CO3、CaC03)跟强酸HCl、H2SO4、HNO3的反应,和生成BaS04、AgCI的反应。
盐+盐 '另两种盐参加反应的两种盐必须都能溶于水,若生成物中有一种是难溶性的盐时,则反应可以进行。
心金属+盐 '另一种金属+另一种盐在金属活动性顺序里,排在前面的金属(K、Ca、Na除外)能把排在后面的金属从它的盐溶液里置换出来。
金属+酸•,盐+氢气在金属活动性顺序里,排在氢前的金属能从酸溶液中把氢置换出来。
这里的酸主要是指盐酸和稀硫酸。
浓硫酸和硝酸因有强氧化性,跟金属反应时不会生成氢气,而是生成盐、水和其它气体。
除杂1、C O (CO:把气体通过灼热的氧化铜,2、C O (CO):通过足量的氢氧化钠溶液3、(水蒸气):通过浓硫酸/通过氢氧化钠固体4、C uO(C):在空气中(在氧气流中)灼烧混合物5、C u(Fe):加入足量的稀硫酸6、C u(CuO):加入足量的稀硫酸7、F eSO(CuSQ):加入足量的铁粉精品文档8、NaCl(Na2CO3): 加入足量的盐酸9、NaCl(Na2SO4): 加入足量的氯化钡溶液10、N aCI(NaOH)加入足量的盐酸11、N aOH( NaCO):加入足量的氢氧化钙溶液12、N aCI (CuSO):加入足量的氢氧化钡溶液13、N aNO3(NaCI): 加入足量的硝酸银溶液14、N aCI(KNO3): 蒸发溶剂15、K NO( NaCI):冷却热饱和溶液。
16、C O2 (水蒸气) :通过浓硫酸1除去2中的Q,可将混合气体通过灼热的铜网(2Cu+O=2CuO。
2除去NaOH溶液中的NaCO,可向溶液中加入适量的Ca (OH 2溶液,(NaCO+Ca (OH2=2NaOH+CaCO然后过滤后取滤液。
3除去Cu中的Fe,可将混合固体加入CuSO溶液中,(Fe+CuS4=Cu+FeSO,然后过滤后取滤渣。
4除去N Q SO溶液中的NaOH可向溶液中加入适量的稀HSQ溶液( 2NaOH+2HSO4=Na2SO4+2H2O)5除去KCI溶液中的&SO,可向溶液中加入适量的BaCb溶液( K2SO4+BaCI2=2KCI+BaSO4 ,然后过滤后取滤液。
6除去NaCI溶液中的BaCl2,可向溶液中加入适量的NaSQ溶液( BaCI2+Na2SO4=2NaCI+BaSO4 ,然后过滤后取滤液。
7除去KNO溶液中的AgNO可向溶液中加入适量的KCI溶液(AgNO+KCI=KN&AgCI),然后过滤后取滤液。
8除去NaNO容液中的CuSO可向溶液中加入适量的Ba (OH 2溶液(CuSG>Ba(OH 2=Cu(OH 2+BaSQ,然后过滤后取滤液。
9除去NaNO容液中的(NH4)2SQ,可向溶液中加入适量的Ba (OH 2溶液((NH4) 2SO4+Ba(OH)2=BaSO4+2NH3+2H2O), 然后过滤后取滤液。
10除去NaSQ溶液中的N Q CO,可向溶液中加入适量的稀HSQ溶液( N a2C O3+H2 S O4= N a2S O4+H2 O+C O2)11除去C粉中的CuQ可加入适量的稀HSQ溶液(CuQ+2SQ=CuSOHO),然后过滤后取滤渣。
12除去CaQ中的CaCQ可加热混合固体(CaC3CaQ+QQ初中化学常用除杂方法例析除杂质的原则:加入的试剂只与杂质反应,不与原物反应;反应后不能引入新的杂质;反应后恢复原物状态;操作方法简便易行。
初中化学常用除杂方法有:1 、沉淀法: 使混合物中的杂质与适当试剂反应,生成沉淀,然后通过过滤而除去。
如:下列混合物可用沉淀法除去杂质 (括号内的物质是杂质)的是( )A .KNQ3〔Ba Cl2〕B.NaCl〔KNQ3〕C.NaNO3 [NaCl] D .Ca(NO3)2 [Mg( NO3)2]答案:C NaCI+ Ag N03= AgCI J + NaN03D Mg( NO3)2+Ca(OH)2= Ca(NO3)2+ Mg(0H)2 J小结:一般说来,如果杂质中有一种离子与原来的物质中的离子相同,那所选试剂只需有一种离子与原来物质中的离子相同,另一种离子与杂质离子生成沉淀。
2 气化法: 将混合物中的杂质与适当试剂反应变成气体而除去。
如:硝酸钠固体中含有少量碳酸钠杂质,可将混合物加水溶解,再加入适量稀硝酸溶液,硝酸与碳酸钠反应生成硝酸钠、水和二氧化碳,再蒸发滤液,或得硝酸钠固体。
练习下列混合物中的杂质(括号内的物质是杂质)适宜用气体法除去的是:A.NaNO3 〔Ba(NO3)2〕B.NaCI [Mg(OH)2]C.KNO3 〔K2CO3〕D.Na2SO4 〔MgSO〕4 答案:C:K2CO3 小结:杂质一般为碳酸盐或碳酸氢盐,试剂一般是酸。
3 置换法: 将混合物中的杂质与适量试剂通过发生置换反应而除去。
如: 硫酸锌固体中含有少量硫酸铜杂质,可将混合物溶解之后,加人适量锌粉,再过滤除去被置换出来的铜,蒸发滤液获得硫酸铜固体。
Cu中混有少量CuO除了用酸除去外,可以用氢气在加热的条件下置换出氧化铜中的铜。
练习:1 加入下列哪些物质可以除去硫酸亚铁溶液中混有的少量杂质硫酸铜()A .ZnB .FeC .CuD .Mg答案B2 将混有少量铁粉和锌粉的硫酸铜晶体溶于适量水,充分静止过滤,结果是A .滤出了混杂在其中的铁粉B.滤出了混杂在其中的锌粉C.滤出了一些铜粉 D .什么也没滤出答案:C.小结:根据杂质的类别,一般考虑金属与酸反应,金属与盐溶液反应,氢气还原金属氧化物,碳还原金属氧化物来选择试剂。
4 吸收法: 两种以上混合气体中的杂质被某种溶剂或溶液吸收,而要提纯的气体不能被吸收时,可用此方法。
精品文档如:一氧化碳中含有二氧化碳时,可将混合气体通过盛有氢氧化钠的溶液。
练习:下列气体中的杂质(括号内的物质是杂质) 用吸收法除去,所选试剂正确的是A O2(H2O)用浓H2S04除水B C02 ( HCI 用NaOH容液除HClC NH3(H2O)用浓H2SO4除水D CO2 (HCI )用Na2CO3溶液除HCI答案:A C小结:气体的吸收剂可考虑:浓硫酸吸收水蒸气、氨气;氢氧化钠溶液吸收二氧化碳、二氧化硫、氯化氢气体等;水吸收氨气、氯化氢气体等,氯化钙溶液吸收氨气。
5 其它法: 将混合物中的杂质用化学方法转化成其它物质。
如:氧化钙中含有碳酸钙,可采用高温燃烧的方法,使碳酸钙高精品文档温分解成氧化钙和二氧化碳,二氧化碳扩散到空气中, 除去杂质。
