2018版高考化学(鲁科版)一轮总复习(课件):第8章 物质在水溶液中的行为 第1节 水溶液 酸碱中和滴定
版高考化学一轮复习第8章物质在水溶液的行为第26讲盐类水解课件鲁科版201806262221

(1)水解平衡右移,盐离子的水解程度可能增大,也可能减
小。( )
(2)稀溶液中,盐的浓度越小,水解程度越大,其溶液酸性(或
碱性)也越强。( )
(3)关于FeCl3溶液,加水稀释时,[[FCel3-+]]的值减小。(
)
(4)通入适量的HCl气体,使FeCl3溶液中,[[FCel3-+]]增大。(
)
答案:(1)√ (2)× (3)√ (4)×
2- 3
水解程度减
小,pH减小。( )
(5)常温下,pH=11的CH3COONa溶液和pH=3的CH3COOH 溶液,水的电离程度相同。( ) 答案:(1)× (2)× (3)× (4)× (5)×
2.(1)现有0.1
mol·L-1的纯碱溶液,用pH试纸测定溶液的
pH,其正确的操作是____________________________。
题组二 盐类水解的实质与规律 3.(2017·辽宁大连联考)相同温度、相同浓度下的八种溶液, 其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质 可能分别为( )
A.NH4Cl (NH4)2SO4 CH3COONa NaHCO3 NaOH B.(NH4)2SO4 NH4Cl CH3COONa NaHCO3 NaOH C.(NH4)2SO4 NH4Cl NaOH CH3COONa NaHCO3 D.CH3COOH NH4Cl (NH4)2SO4 NaHCO3 NaOH
答案:(1)Fe3++3H2O △ Fe(OH)3(胶体)+3H+
(2)HS-+H2O H2S+OH- (3)Al3++3HCO- 3 ===Al(OH)3↓+3CO2↑
[练后归纳] 盐类水解离子方程式的书写要求 1.一般来说,盐类水解的程度不大,应该用可逆号“ ”表示。 盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑” 表示水解产物。 2.多元弱酸盐的水解是分步进行的,水解离子方程式要分步表 示。 3.多元弱碱阳离子的水解简化成一步完成。 4.水解分别是酸性和碱性的离子组由于相互促进水解程度较大, 书写时要用“===”“↑”“↓”等。
高中化学一轮复习第8章物质在水溶液中的行为第1节水溶液酸碱中和滴定课件鲁教版

提示:不一定,如酸溶液中 H+由酸和水电离产生,碱溶液
中 OH-由碱和水电离产生,只要是水溶液必定有 H+和 OH-,
当溶液浓度不大时,总有 KW=[H+][OH-]。
第八页,共77页。
3.甲同学认为,在水中加入 H2SO4,水的电离平衡向左移 动,解释是加入 H2SO4 后[H+]增大,平衡左移。乙同学 认为,加入 H2SO4 后,水的电离平衡向右移动,解释为 加入 H2SO4 后,[H+]浓度增大,H+与 OH-中和,平衡右 移。你认为哪种说法正确?并说明原因。水的电离平衡 移动后,溶液中[H+][OH-]是增大还是减小? 提示:甲正确,温度不变,KW 是常数,加入 H2SO4, [H+]增大,[H+][OH-]>KW,平衡左移。 [H+][OH-]不变,因为 KW 仅与温度有关,温度不变, 则 KW 不变,与外加酸、碱、盐无关。
D.将水加热,KW 增大,pH 不变,呈中性
解析
第十页,共77页。
2.常温下,某溶液中由水电离的[H+]=1×10-13 mol·L-1,该
溶液可能是
( A)
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液
④氢氧化钠水溶液
A.①④
B.①②
C.②③
D.③④
解析:水电离的[H+]=1×10-13 mol·L-1<10-7 mol·L-1,说
第 8 章 物质在水溶液中的行为
第一页,共77页。
第 1 节 水溶液 酸碱中和滴定
考点一
水的电离
考点二 考点三
溶液的酸碱性与pH 酸碱中和滴定
考点四
课堂小结 一题串知
课后检测 演练提能
中和滴定原理在定量实验中的拓展应用
以“一元碱的稀释”为载体串联(chuànlián)溶液 酸碱性知识
高考化学一轮复习-第8章 物质在水溶液中的行为 第27讲 盐类水解课件 鲁科版

(4)将NaHCO3溶液与AlCl3溶液混合 _A__l3_+_+__3_H__C_O_- 3__=_=_=_A_l_(_O_H_)_3_↓__+__3_C_O__2↑_。
(5)实验室制备Fe(OH)3胶体 __F_e_3+_+ __3_H__2_O_=_=_△=_=_=_F__e(_O__H_)_3(_胶__体__)_+__3_H_+。
第27讲 盐类水解
1.理解盐类水解的原理、过程、一般规律。 2.了解影响盐类水解平衡的主要因素。 3.了解盐类水解对水电离的影响。 4.学会盐类水解离子方程式的书写。 5.了解盐类水解的应用。
考点一
考点二
考点三
探究高考 明确考向
练出高分
考点一 盐类水解及规律
1.定义 在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成_弱__电__解__质_ 的反应。
深度思考 1.正误判断,正确的划“√”,错误的划“×” (1)酸式盐溶液不一定呈酸性( √ ) (2)离子能够发生水解的盐溶液一定呈酸性或碱性( × ) (3) 同 浓 度 的 Na2CO3 溶 液 和 CH3COONa 溶 液 相 比 前 者 pH 大 ; 同 浓 度 的 Na2CO3和NaHCO3溶液相比后者pH小( √ ) (4)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离 程度相同( √ ) (5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的 电离程度相同( × )
答案
1 234
题组一 规范书写盐类水解离子方程式 1.按要求书写离子方程式 (1)AlCl3溶液呈酸性 _A_l_3_+_+__3_H_2_O____A__l(_O__H_)_3+__3_H__+_。 (2)Na2CO3溶液呈碱性 _C_O_23_-_+__H__2O_____H_C__O_- 3_+__O__H_-_、__H__C_O__-3 _+__H_2_O_____H_2_C_O_3_+__O__H_-_。 (3)NH4Cl溶于D2O中 _N_H__+ 4 _+__D_2_O____N__H_3_·H__D_O__+__D_+__。
高考化学一轮复习 第8章 物质在水溶液中的行为 专题讲座八“粒子”浓度关系判断课件 鲁科版.ppt

一
二
三
四
探究高考 明确考向
练出高分
一、熟悉两大理论,构建思维基点
1.电离理论
(1)弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑
水
的
电
离
,
如
氨
水
溶
液
中
:
NH3·H2O
、
NH
+ 4
、
OH-
浓
度
的
大
小关
系
是
[NH3·H2O]>[OH-]>[NH+ 4 ]。
(二)单一溶液中离子浓度的关系 例2 0.1 mol·L-1的NH4Cl溶液 ①粒子种类__________________________________________________。 ②离子浓度大小关系__________________________________________。 ③物料守恒__________________________________________________。
(2)多元弱酸的电离是分步进行的,其主要是第一级电离(第一步电离程度 远大于第二步电离)。如在H2S溶液中:H2S、HS-、S2-、H+的浓度大小 关系是[H2S]>[H+]>[HS-]>[S2-]。
2.水解理论 (1)弱电解质离子的水解损失是微量的(双水解除外),但由于水的电离, 故水解后酸性溶液中[H+]或碱性溶液中[OH-]总是大于水解产生的弱电解 质溶液的浓度。如 NH4Cl 溶液中:NH+ 4 、Cl-、NH3·H2O、H+的浓度大小 关系是[Cl-]>[NH+ 4 ]>[H+]>[NH3·H2O]。 (2)多元弱酸酸根离子的水解是分步进行的,其主要是第一步水解,如在 Na2CO3 溶液中:CO23-、HCO-3 、H2CO3 的浓度大小关系应是 [CO23-]>[HCO- 3 ]>[H2CO3]。
2018版高考化学(鲁科版)一轮总复习(课件):第8章 物质在水溶液中的行为 第2节 弱电解质的电离

上一页
返回首页
下一页
高三一轮总复习
考点1| 弱电解质的电离平衡及其影响因素 [基础知识自查] 1.弱电解质的电离平衡 (1)电离平衡的概念 一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率和离子结合成 弱电解质分子的速率 相等 时,电离过程达到平衡状态。
上一页
返回首页
下一页
高三一轮总复习
A.a、b、c三点溶液的pH:c<a<b B.a、b、c三点CH3COOH的电离程度:c<a<b C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小 D.a、b、c三点溶液用1 mol· L-1 NaOH溶液中和,消耗NaOH溶液体积: c<a<b
上一页
返回首页
下一页
高三一轮总复习
C [A项,由导电能力知c(H ):b>a>c,故pH:c>a>b;B项,加水体积越 大,越利于CH3COOH电离,故电离程度:c>b>a;C项,用湿润的pH试纸测量a 处溶液的pH,相当于稀释a点溶液,[H+]增大,pH偏小;D项,a、b、c三点 n(CH3COOH)相同,用NaOH中和时消耗n(NaOH)相同,故消耗V(NaOH):a=b= c。]
下一页
高三一轮总复习
(1)稀醋酸加水稀释时,溶液中不一定所有的离子浓度都减小。因为温度不 变,KW=[H ][OH ]是定值,稀醋酸加水稀释时,溶液中的[H ]减小,故[OH ]增 大。 (2)电离平衡右移,电解质分子的浓度不一定减小,离子的浓度不一定增大, 电离程度也不一定增大。 (3)对于浓的弱电解质溶液加H2O稀释的过程,弱电解质的电离程度逐渐增 大,但离子浓度可能先增大后减小。
高三一轮总复习
高考化学(鲁科版)一轮复习教学案:第八章 物质在水溶液中的行为第一节水溶液
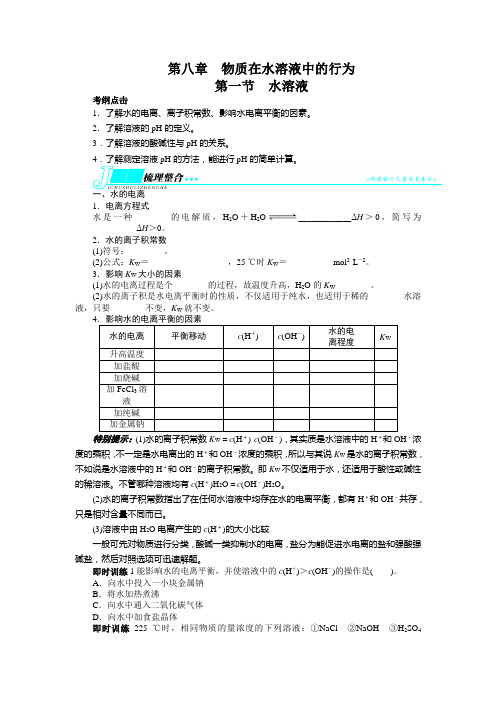
第八章物质在水溶液中的行为第一节水溶液考纲点击1.了解水的电离、离子积常数、影响水电离平衡的因素。
2.了解溶液的pH的定义。
3.了解溶液的酸碱性与pH的关系。
4.了解测定溶液pH的方法,能进行pH的简单计算。
一、水的电离1.电离方程式水是一种________的电解质,H2O+H2O____________ΔH>0,简写为____________ΔH>0。
2.水的离子积常数(1)符号:________。
(2)公式:K W=__________________,25 ℃时K W=__________ mol2·L-2。
3.影响K W大小的因素(1)水的电离过程是个________的过程,故温度升高,H2O的K W________。
(2)水的离子积是水电离平衡时的性质,不仅适用于纯水,也适用于稀的________水溶液,只要________不变,K W就不变。
4水的电离平衡移动c(H+) c(OH-) 水的电离程度K W升高温度加盐酸加烧碱加FeCl3溶液加纯碱加金属钠特别提示:(1)水的离子积常数K W=c(H+)·c(OH-),其实质是水溶液中的H+-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说K W是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。
即K W不仅适用于水,还适用于酸性或碱性的稀溶液。
不管哪种溶液均有c(H+)H2O=c(OH-)H2O。
(2)水的离子积常数指出了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
(3)溶液中由H2O电离产生的c(H+)的大小比较一般可先对物质进行分类,酸碱一类抑制水的电离,盐分为能促进水电离的盐和强酸强碱盐,然后对照选项可迅速解题。
即时训练1能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是()。
A.向水中投入一小块金属钠B.将水加热煮沸C.向水中通入二氧化碳气体D.向水中加食盐晶体即时训练225 ℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是()。
高考化学总复习 必修部分 第八章 物质在水溶液中的行为 第2讲 盐类的水解 酸碱中和滴定课件 鲁教版

是为了防止 Sn2+的水解。
4.怎样除去 MgCl2 酸性溶液中的 Fe3+,其原理是什么? 答案:MgCl2 溶液中混有少量的 Fe3+杂质时,可加入 Mg、MgO、 Mg(OH)2 或 MgCO3 而除去 Fe3+,其原理是 Fe3+的水解程度比 Mg2+的水解程度大,加入这些物质,导致 Fe3++
第八章 物质在水溶液中的行为
第2讲 盐类的水解 酸碱中和滴定
第八章 物质在水溶液中的行为
1.了解盐类水解的原理、影响盐类水解程度的 主要因素,盐类水解的应用。 2.掌握酸碱中和滴定的原理、 仪器、操作及数据分析和处理。 3.以上各部分知识的综合应 用。
考点一 盐类水解的原理、规律及影响因素
[知识梳理] 1.定义 在溶液中盐电离出来的离子跟水电离产生的 H+或 OH-结合生 成_弱__电__解__质_______的反应。
(4)将 NaHCO3 溶液与 AlCl3 溶液混合 _A_l_3+_+__3_H__C_O__- 3_=_=_=_A__l(_O__H_)_3↓__+ ___3_C_O__2↑_______。
(5)实验室制备 F△e(OH)3 胶体 _F_e_3_+_+__3_H__2O__=_=_=_=_=_F__e(_O__H_)_3_(胶__体__)_+__3_H__+__。 (6)NaHS 溶液呈碱性的原因 __H_S_-_+__H__2_O_______H__2_S_+__O_H_。-
4.(高考经典题)25 ℃时,浓度均为 0.2 mol·L-1 的 NaHCO3 与 Na2CO3 溶液中,下列判断不正确的是( C ) A.均存在电离平衡和水解平衡 B.存在的粒子种类相同 C.[OH-]前者大于后者 D.分别加入 NaOH 固体,恢复到原温度,c(CO23-)均增大
物质在水溶液中的行为第2节(共78张)-鲁科版高考化学一轮复习课件

H++CH3COO-ΔH>0 ______ ______ ______
[H+] 导电能力 Ka ______ ______ ______
实例(稀 溶液)
CH3COOH
加
______ ______ NaOH(s)
加入镁粉 ______ ______
升高温度 ______ ______
H++CH3COO-ΔH>0
[解析] 由图像分析浓度为 0.10 mol·L-1 的 MOH 溶液,在稀 释前 pH 为 13,说明 MOH 完全电离,则 MOH 为强碱,而 ROH 的 pH<13,说明 ROH 没有完全电离,ROH 为弱碱。
A.MOH 的碱性强于 ROH 的碱性,A 正确。
B.曲线的横坐标 lgVV0越大,表示加水稀释体积越大,由曲 线可以看出 b 点的稀释程度大于 a 点,弱碱 ROH 存在电离
说明 CH3COOH 具有酸性;上述三项均不能证明 CH3COOH 为
弱酸;B 项,CH3COONa 溶液 pH>7,说明 CH3COO-水解生
成弱酸 CH3COOH。
2.(2018·福州模拟)下列事实不能证明 HNO2 是弱电解质的是
()
①滴入酚酞,NaNO2 溶液显红色 ②用 HNO2 溶液做导电实验,灯泡很暗 ③等 pH、等体积的盐酸和 HNO2 溶液中和碱时,HNO2 中和 碱的能力强
(1)电解质、非电解质均是化合物,盐酸(混合物)、铜(单质)虽 能导电,但它们既不是电解质也不是非电解质。 (2)电解质的强弱只与电解质在水溶液中的电离程度有关,与电 解质溶解性的大小无必然联系。
(3)醋酸加水稀释时,溶液中的各离子浓度并不是都减小,如 [OH-]是增大的。 (4)电离平衡右移,电解质分子的浓度不一定减小,如稀醋酸中 加入冰醋酸。 (5)电离平衡右移,电离程度不一定增大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上一页
返回首页
下一页
高三一轮总复习
考点1| 水的电离
[基础知识自查] 1.水的电离 (1)电离方程式: H2O
+
H++OH-或2H2O
-
H3O++OH-
。
-7 -1 1 × 10 mol· L (2)25 ℃时,纯水中[H ]=[OH ]= ,任何水溶液中由水电离
+ - 出来的[H ] = [OH ]。
温度不变,测得溶液的[H+]=1×10-2 mol· L-1。下列对该溶液的叙述不正确的是 ( ) A.该温度高于25 ℃ B.由水电离出来的H 的浓度为1×10 C.加入NaHSO4晶体抑制水的电离 D.取该溶液加水稀释100倍,溶液中的[OH-]减小
上一页 返回首页 下一页
+ -10
mol· L
+ + + + -
上一页返回首页ຫໍສະໝຸດ 下一页高三一轮总复习
2.25 ℃时,相同物质的量浓度的下列溶液:①NaCl ②NaOH 的一组是 ( ③H2SO4 ) B.②>③>①>④ D.③>②>①>④ ④(NH4)2SO4,其中水的电离程度按由大到小顺序排列
A.④>③>②>① C.④>①>②>③
C [②、③为碱、酸抑制水电离;④中NH + 4 水解促进水电离,①NaCl不影响 水电离。]
1.25 ℃时,水的电离达到平衡:H2O 的是( )
A.向水中加入稀氨水,平衡逆向移动,[OH-]降低 B.向水中加入少量固体硫酸氢钠,[H ]增大,KW不变 C.向水中加入少量固体醋酸钠,平衡逆向移动,[H+]降低 D.将水加热,Kw增大,pH不变
+
上一页
返回首页
下一页
高三一轮总复习
B [向水中加入稀氨水,增大了[OH-],平衡逆向移动;加入固体NaHSO4, NaHSO4溶于水后电离生成H ,[H ]增大,KW不变;加入醋酸钠,CH3COO 结合 水电离出的H ,使平衡正向移动,[H ]降低;将水加热,Kw增大,pH减小。]
-1
高三一轮总复习
增大,因一定温度下水的浓度商是常数,故溶液中[OH-]减小,因此加入FeCl3溶 液可能引起由b向a的变化。D.c点溶液呈碱性,稀释时[OH-]减小,同时[H+]应增 大,故稀释溶液时不可能引起由c向d的变化。]
上一页
返回首页
下一页
高三一轮总复习
正确理解水的电离平衡曲线 (1)曲线上的任意点的KW都相同,即[H+][OH-]相同,温度相同; (2)曲线外的任意点与曲线上任意点的KW不同,温度不同; (3)实现曲线上点之间的转化需保持温度不变,改变酸碱性;实现曲线上点与 曲线外点之间的转化一定改变温度。
高三一轮总复习
考 点 一
课 堂 小 结
考 点 二
第1节
水溶液
酸碱中和滴定
课 时 分 层 训 练
考 点 三
上一页
返回首页
下一页
高三一轮总复习
考纲定位 考情播报 2016· 全国甲卷T12/全国丙卷T13(C) 1.了解水的电离,离子积常数。 2.了解溶液pH的定义及测定方法。能 进行pH的简单计算。 3.掌握酸碱中和滴定及其应用。 2015· 全国卷ⅡT28(3) 2014· 全国卷ⅠT12(B、C)/全国卷ⅡT11、 T28(2) 2013· 全国卷ⅡT13 2012· 全国卷T11
上一页
返回首页
下一页
高三一轮总复习
角度2 溶液中H2O电离出的[H+]H2O或[OH-]H2O的计算
+ +
4.(2017· 韶关模拟)已知NaHSO4在水中的电离方程式为NaHSO4===Na +H
- + -6 -1 +SO2 。某温度下,向 [H ] = 1 × 10 mol· L 的蒸馏水中加入NaHSO4晶体,保持 4
上一页
返回首页
下一页
高三一轮总复习
2.水的浓度商常数
+ - -14 - [H ][OH ] 10 (1)表达式:KW= 。25 ℃时,KW= mol2· L 2,100 ℃时,
KW=10
-12
mol2· L 2。
-
(2)影响因素:只与 温度
有关,升高温度,KW 增大 。
(3)适用范围:适用于纯水、酸、碱、盐的稀溶液。 (4)意义:KW揭示了在任何水溶液中均存在H+和OH-,只要 温度 不变。 不变,KW
+ -
2.25 ℃,pH=3的溶液中,H2O电离出的H+浓度为多少?
[提示] 若为水解呈酸性的盐溶液,促进水的电离,由水电离出的[H+]水= 1×10
-3
mol/L或若为酸,抑制水的电离,由水电离出的[H ]水=1×10
上一页 返回首页 下一页
+
-11
mol/L。
高三一轮总复习
[考点多维探究] 角度1 影响水电离平衡的因素分析 H++OH- ΔH>0,下列叙述正确
上一页
返回首页
下一页
高三一轮总复习
3.(2015· 广东高考)一定温度下,水溶液中H+和OH-的浓度变化曲线如图。 下列说法正确的是( )
上一页
返回首页
下一页
高三一轮总复习
A.升高温度,可能引起由c向b的变化 B.该温度下,水的浓度商常数为1.0×10-13 mol2· L-2 C.该温度下,加入FeCl3可能引起由b向a的变化 D.该温度下,稀释溶液可能引起由c向d的变化
上一页
返回首页
下一页
高三一轮总复习
C [A.由图可知a、b、c三点对应的平衡常数不变,故a、b、c为等温线,升 温,不能由c向b变化。B.由b点对应[H+]与[OH-]可知,KW=[H+][OH-]=1.0×10-
7
×1.0×10-7 mol2· L-2=1.0×10-14 mol2· L-2。C.FeCl3溶液水解显酸性,溶液中[H+]
下一页
高三一轮总复习
[应用体验] 1.向水中分别加入(1)NaOH、(2)NH4Cl,请分析水的电离平衡移动方向, [H ]、[OH ]变化,水的电离程度变化,KW变化。
+ -
[提示] (1)向左移,[H+]减小,[OH-]增大,水的电离程度变小,KW不变。 (2)向右移,[H ]增大,[OH ]减小,水的电离程度变大,KW不变。
上一页
返回首页
下一页
高三一轮总复习
3.外界因素对水的电离平衡的影响 (1)温度:温度升高, 促进 水的电离,KW 增大 温度降低, 抑制 水的电离,KW 减小 。 (2)酸、碱: 抑制 水的电离。 (3)能水解的盐: 促进 水的电离。 (4)能与水反应的活泼金属: 促进 水的电离。 ;
上一页
返回首页
