2017年高考化学一轮复习知识点大全:考点十五 非极性分子和极性分子
非极性分子和极性分子

第五节非极性分子和极性分子【知识结构】1.键的极性:按照原子间共用电子对是否偏移,共价键分为非极性键和极性键。
⑴非极性键:由同种原子形成的共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,这样的共价键叫非极性共价键,简称非极性键。
⑵极性键:由不同种原子形成的共价键,两个原子吸引电子的能力不同,共用电子对偏向吸引电子能力强的一方,这样的共价键叫极性共价键,简称极性键。
2.极性分子和非极性分子⑴非极性分子①非极性键结合的双原子分子。
如:O2、N2、X2等。
②对称排列的以极性键结合的多原子分子,如CO2、CH4、CCl4等⑵极性分子①极性键结合的双原子分子,如:HCl②排列不对称的以极性键结合的多原子分子,如H2O、NH3等⑶常见的非极性分子和极性分子非极性分子:双原子单质分子:H2、O2、N2、X2;多原子分子CO2、CS2、CH4、CCl4。
极性分子:HX、H2O、H2S、NH3。
3.分子间作用力⑴分子间作用力又称范德华力,能量比化学键弱得多。
分子间作用力的大小,对由分子构成的物质的熔点、沸点、溶解度等有影响。
*⑵分子间的作用力的大小与分子的极性和相对分子质量的大小等因素有关。
如组成和结构相似的物质随着相对分子质量的增大,分子间的作用力也增大,表现在熔、沸点的升高上。
如F2、Cl2、Br2、I2。
⑶相似相溶原理极性分子易溶于极性溶剂。
如HCl易溶于水。
非极性分子易溶于非极性溶剂。
如Br2、I2易溶于CCl4、苯、汽油、酒精等有机溶剂【例题解析】例1 下列叙述中,错误的是A.离子化合物中不可能存在非极性键B.离子键只存在于离子化合物中,不存在于共价化合物中C.由极性键结合的分子不一定是极性分子D.极性分子中一定不含非极性键[分析]本题可用反例法确定叙述是否正确。
Na2O2为含非极性键的离子化合物,H2O2为含有非极性键的极性分子,CCl4是由极性键结合的非极性分子。
[答案]A、D例2 下列各组分子中,都是由极性键构成的极性分子的是A.CH3Cl与Cl2B.NH3和H2OC.H2S和CS2D.CO2和HI[分析] 如果从整个分子看,分子里电荷分布是对称的,也就是其正电荷中心与负电荷中心是重合的,则这样的分子属于非极性分子。
第14讲:非极性分子和极性分子

高三化学一轮复习精品教辅第14讲:非极性分子和极性分子【考纲要求】1.理解极性键与非极性键的形成原因,并能进行化学键的极性强弱比较。
2.理解化学键的极性与分子的极性的区别与联系,掌握极性分子与非极性分子的判断依据和判断方法。
3.理解分子间作用力和氢键的概念以及对物质性质的影响。
教与学方案一、概念辨析1.非极性键:(1)概念:同种元素原子形成的共价键,共用电子对没有发生偏移。
(2)形成条件:由同种非金属元素组成。
2.极性键:(1)概念:不同种元素原子形成的共价键,共用电子对发生偏移。
(2)形成条件:由不同种非金属元素组成。
(3)共价键极性强弱比较依据:形成共价键的共用电子对偏向与偏离程度越大,键的极性就越强。
试比较下列两组共价键的强弱:①H—H、H—F、H—O、H—N、H—C:;②H—F、C—F、N—F、O—F、F—F:。
3.极性分子:(1)含义:分子内各原子及共价键的空间排布不对称,分子内正、负电荷中心不重合的分子。
(2)举例:HCl、H2O、NH3、CH3Cl SO2。
4.非极性分子:(1)含义:分子内各原子及共价键的空间排布对称,分子内正、负电荷中心重合的分子。
(2)判断方法:①根据键角判断分子中的正负电荷重心是否重叠②根据AB n的中心原子A周围是否为完全等价的电子对③根据AB n的中心原子A的最外层价电子是否全部参与形成了同样的共价键。
(或A是否达最高价)(3)常见分子中,属非极性分子的不多,具体有:①非金属单质分子。
如:稀有气体、H2、Cl2、N2等。
②结构对称的直线型分子。
如:CO2 CS2③结构对称的正三角形分子。
如:BF3、BCl3 、SO3④结构对称的正四面体型分子。
如:CH4、CCl4、P4、SiF4、SiCl4而其它大多数分子则为极性分子。
如:HCl、H2O、NH3、CH3Cl等等。
(4).分子的极性与键的极性没有必然的联系。
由极性键形成的分子不一定是极性分子,如:CO2;由非极性键形成的分子也不一定是非极性分子,如:H2O25.几种常见共价分子的空间构型①直线型:O=C=O、H-Cl、N≡N、CH≡CH②V 型:H2O键角(H-O-H)为104°30´③平面型:CH2=CH2、及苯C6H6④三角锥型:NH3 键角(H-N-H)为107°18´⑤正四面体:CH4 和CCl4 及NH4+ 键角为109°28´;P4 键角为60°6.分子间作用力:(1)概念:使分子聚焦在一起的相互作用力,又称范德华力。
高中化学物质结构知识点

高中化学物质结构知识点引言物质结构是化学的核心内容之一,它涉及到原子、分子以及晶体等不同层面的结构特征。
掌握物质结构对于理解化学反应的本质、预测物质的性质以及指导实验操作都具有重要意义。
第一部分:原子结构与元素周期表1.1 原子的构成原子核:质子和中子的组成及其特性。
电子云:电子的排布规律和电子云模型。
1.2 元素周期表周期性:元素周期表的周期性和族的划分。
元素性质:元素周期律及其对元素性质的预测。
第二部分:化学键与分子结构2.1 离子键与共价键离子键:形成机制、特点及离子化合物。
共价键:形成机制、饱和性和方向性。
2.2 分子的极性极性分子:分子极性的判断和影响因素。
非极性分子:分子结构和极性的关系。
第三部分:晶体结构3.1 晶体的类型晶体与非晶体:区别和识别方法。
晶体类型:原子晶体、分子晶体、离子晶体和金属晶体。
3.2 晶体的物理性质熔沸点:晶体类型与熔沸点的关系。
导电性:金属晶体的导电机制。
第四部分:有机化合物的结构4.1 有机分子的骨架碳原子的杂化:sp、sp2、sp3杂化轨道。
同分异构体:构造异构和立体异构。
4.2 官能团与反应活性官能团:有机分子中的反应中心。
反应机理:官能团在有机反应中的作用。
第五部分:物质结构的表征方法5.1 光谱分析紫外-可见光谱:分子结构与光谱的关系。
红外光谱:化学键振动与红外光谱。
5.2 核磁共振(NMR)NMR原理:核磁共振现象及其在结构分析中的应用。
谱图解读:通过NMR谱图分析分子结构。
第六部分:物质结构与性质的关系6.1 结构对性质的影响硬度与脆性:晶体结构对物理性质的影响。
溶解性:分子极性与溶解性的关系。
6.2 结构对反应性的影响反应位点:分子结构中的反应活性区域。
催化作用:催化剂对反应途径的影响。
结语物质结构是化学学科的基石,它影响着物质的稳定性、反应性和多样性。
通过本文档的学习,学生将能够深入理解原子、分子和晶体的结构特征,掌握化学物质结构的基本知识,为进一步的化学学习和研究打下坚实的基础。
高考化学结构必备知识点

高考化学结构必备知识点化学是一门以物质的结构为基础的科学,在高考化学中,掌握物质的结构是非常重要的。
本文将介绍高考化学中必备的知识点,让同学们能够更好地应对高考。
一、化学键的类型化学键是指由原子间的相互作用力所形成的连接。
在化学中,常见的化学键有离子键、共价键和金属键。
离子键是由正负电离子之间的电荷相互吸引形成的。
例如,氯化钠(NaCl)是由钠离子和氯离子通过离子键连接在一起的。
共价键是由两个非金属原子之间的电子共享形成的。
例如,甲烷(CH4)是由一个碳原子和四个氢原子通过共价键连接在一起的。
金属键是由金属原子之间的电子云形成的。
金属元素通常具有自由电子,这些自由电子能够在金属结构中自由移动,形成金属键。
例如,铁(Fe)是由多个铁原子通过金属键连接在一起的。
二、分子的构成分子是由原子通过化学键连接在一起的。
分子的构成可以是单一元素的原子,也可以是多种元素的原子。
当分子由相同元素的原子组成时,称之为单质分子。
例如,氧气(O2)是由两个氧原子通过共价键连接在一起的。
当分子由不同元素的原子组成时,称之为化合物分子。
例如,水(H2O)是由两个氢原子和一个氧原子通过共价键连接在一起的。
三、离子晶体的结构离子晶体是由正负离子通过离子键连接在一起的固体结构。
离子晶体的晶格结构通常为正方晶系、立方晶系或三斜晶系。
在离子晶体中,正离子占据晶格的空间点,而负离子填充在正离子的空隙中。
例如,氯化钠(NaCl)的晶格结构是由钠离子和氯离子交替排列形成的。
四、分子晶体的结构分子晶体是由分子通过相互作用力连接在一起的固体结构。
分子晶体的晶格结构通常为正交晶系、单斜晶系或斜方晶系。
在分子晶体中,分子之间通过分子间力相互作用,形成晶体结构。
例如,冰(H2O)是由水分子通过氢键相互连接在一起的。
五、金属结构金属结构是由金属原子通过金属键连接在一起的固体结构。
金属结构的晶格结构通常为立方晶系、六方晶系或其他。
在金属结构中,金属原子紧密堆积,形成由正离子和自由电子共同构成的金属晶格。
极性分子和非极性分子课件

1
溶解性测试
将分子置于极性溶剂中观察其溶解性。
2
化学反应测试
与其他物质进行反应,观察化学反应是否发生。
3
电荷分布测试
使用分子模型分析分子中正负电荷的分布情况。
总结和回顾
极性分子
两个或更多不同元素组成,电荷不均匀分布。
非极性分子
相同元素组成,电荷均匀分布或不存在电荷。
极性分子的性质
1 溶解性
极性分子可以溶解在其他 极性溶剂中,如水。
2 静电作用
极性分子之间的正负电荷 吸引力较强,容易发生静 电强,其沸点通常 较高。
非极性分子的性质
1 溶解性
非极性分子通常不溶解在 极性溶剂中,如水。
2 惰性
非极性分子具有较低的反 应性,不容易与其他物质 发生化学反应。
3 低沸点
由于非极性分子之间的相 互作用力较弱,其沸点通 常较低。
极性分子和非极性分子的例子
极性分子
水分子 (H2O)
非极性分子
氧气分子 (O2)
极性分子和非极性分子的应用
极性分子
被广泛用于溶剂、草药提取和医药领域。
非极性分子
被用于润滑剂、绝缘材料和塑料制品等方面。
如何区分极性分子和非极性分子
极性分子和非极性分子
本课件将介绍分子的极性和非极性,包括其定义、性质、例子和应用。我们 还会分享如何区分极性分子和非极性分子。让我们开始探索这个有趣的话题 吧!
分子的极性和非极性定义
1 极性分子
极性分子是由两个或更多不同元素组成的分子,其中正负电荷在分子内分布不均匀。
2 非极性分子
非极性分子是由相同元素组成的分子,其中正负电荷在分子内分布均匀,或者不存在正 负电荷。
极性分子与非极性分子

极性分⼦与⾮极性分⼦极性分⼦与⾮极性分⼦你知道冰为什么在4℃时密度最⼤吗?这就是本讲所学内容——分⼦间作⽤⼒和氢键的有关知识。
由于⽔分⼦间有氢键缔合这样的特殊结构。
根据近代X射线的研究,证明了冰具有四⾯体的晶体结构。
这个四⾯体是经过氢键形成的,是⼀个敞开式的松弛结构,因为5个⽔分⼦不能把全部四⾯体的体积占完,在冰中氢键把这些四⾯体联系起来,成为⼀个整体。
这种通过氢键形成的定向有序排列,空间利⽤率较⼩,约占34%,因此冰的密度较⼩。
液态⽔不像冰那样完全是有序排列了,⽽是有⼀定程度的⽆序排列,即⽔分⼦间的距离不像冰中那样固定,H2O分⼦可以由⼀个四⾯体的微晶进⼊另⼀微晶中去。
这样,分⼦间的空隙减少,密度就增⼤了。
温度升⾼时,⽔分⼦的四⾯体集团不断被破坏,分⼦⽆序排列增多,使密度增⼤。
但同时,⽔分⼦的热运动也增加了分⼦间的距离,使密度⼜减⼩。
这两个⽭盾的因素在4℃时达到平衡,因此,在4℃时⽔的密度最⼤。
过了4℃后,分⼦的热运动使分⼦间的距离增⼤的因素,就占优势了,⽔的密度⼜开始减⼩。
知识延伸⼀、分⼦间作⽤⼒分⼦型物质⽆论是⽓态、液态或固态,都是由许多分⼦组成的,在分⼦间存在着⼀种较弱的作⽤⼒叫分⼦间作⽤⼒,也叫做范德华⼒。
它⽐分⼦内原⼦间的作⽤⼒(化学键)要⼩。
分⼦间的作⽤⼒是⼀个总的提法,按作⽤⼒产⽣的原因和特性可分为三种⼒:l.取向⼒当两个极性分⼦靠近时,同极相斥,异极相吸,产⽣相对转动,最后必然是异极相对,同极尽量远离,这叫做分⼦的取向。
这种由于极性分⼦取向⽽产⽣的⼒叫取向⼒。
2.诱导⼒当极性分⼦接近⾮极性分⼦时,极性分⼦的偶极电场使⾮极性分⼦发⽣极化从⽽产⽣正、负电荷重⼼不相重合,这种由于外来的影响⽽产⽣的偶极叫诱导偶极,诱导偶极与固有偶极产⽣的⼒称为诱导⼒。
⼀般说来,极性分⼦的极性越⼤,诱导⼒越⼤。
分⼦的变形性越⼤,诱导⼒也越⼤。
3.⾊散⼒⾮极性分⼦之间也存在着相互吸引⼒,⾮极性分⼦内部的原⼦核和电⼦都在不断地运动,不断地改变它们相对的位置。
极性分子和非极性分子课件高品质版
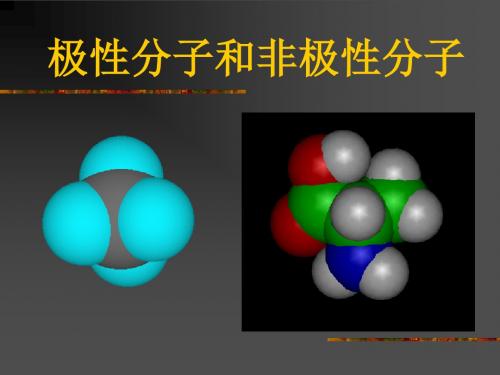
极性分子:分子中正负电荷中心不重合,从整个分子来看, 电荷的分布是不均匀的,不对称的,这样的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 电荷的分布是均匀的,对称的,这样的分子为极性分子。
键的极性与分子的极性的区别与联系
概念
键的极性
分子的极性
含义 决定因素
极性键和非极性键 极性分子和非极性分子 是否由同种元素原子形成 极性分子和非极性分子
结构
NH3
键的极性 分子极性
极性键 非极性分子 平面三角形
极性键 极性分子 三角锥形
类型 实例 XY4型 CH4
结构
CCl4
键的极性 分子极性 极性键 非极性分子
均为正四面体形
小结
离子键
化学键
非极性键 共价键
极性键
非极性分子 极性分子 非极性分子
分子间作用力与化学键的比较
作用微粒 作用力大小
意义
联系 说明
1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
键有极性,分子不一定有极性。
常见分子的构型及其分子的极性
类型 实例
结构
键的极性 分子极性
X2型: H2
非极性键 非极性分子
极性键
共价键的分类 非极性键
极性键的判断方法
由不同元素的原子形成的共价键一般是极性键,如HCl、CO2 CCl4、SO42-、OH-等都含有极性键。
非极性键的判断方法 由相同元素的原子形成的共价键是非极性键。如单质分子(Xn, n>1,如H2、Cl2、O3、P4等)和某些共价化合物(如乙醇、乙烯等) 某些离子化合物(如Na2O2等)含有非极性键。
极性分子与非极性分子

练习: 下列物质受热熔化时,不需要破坏化学键的是( ) A.食盐 B.纯碱 C.干冰 D.冰
01
C D
02
A、 B
2.下列说法中,正确的是( ) A.共价键是否有极性,决定于共用电子对是否有偏移 B.在多种元素形成的化合物中,可能含有几种化学键 C.分子是否有极性,只决定于形成的化学键 D.含有非极性键的分子必定是非极性分子
01
D
02
研究分子极性的实际意义
1.相似相溶规则
2.相对分子质量相近的分子,分子的极性越强,分子间的范德华力越大,物质的熔沸点越高。
极性分子的溶质易溶于非极性溶剂中。
如:Cl2、Br2、I2在水中溶解度不大,但在
极性分子的溶质易溶于极性溶剂,非
苯、四氯化碳等非极性溶剂中的溶解度大。
“相似相溶”原理——
D
极性分子和非极性分子
单击添加副标题
单击此处添加文本具体内容,简明扼要地阐述你的观点
目录
CONTENTS
02
03
04
05
01
练习:指出下列物质中哪些物质含极性 键,哪些物质含非极性键? CO2、Cl2、HCl、MgCl2、H2O
01
关于极性键、非极性键的判断
02
非极性分子和极性分子:
极性分子——正、负电荷重心不重合的分子。
B
下列固体,由具有极性键的非极性分子构成的是①干冰、②石英、③白磷、④固态四氯化碳、⑤过氧化钠,正确答案是 A.②③⑤ B.仅②③ C.仅①④ D.①③④⑤
C
下列微粒中,哪一组中的化学键都是极性共价键:
C2H6 ②H2O ③CH2Cl2 ④NH4+ A.①②③④ B.只有② C.只有①②③ D.只有②③④
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点十五非极性分子和极性分子
Ⅲ.教材精讲
1.键的极性与分子的极性
(1)同种元素的原子结合成双原子的分子,因为共用电子对不偏向于任何一方,整个分子电荷分布是对称的,所以全部是非极性键形成的非极性分子。
如H2、C12等单质分子。
(2)不同元素的原子结合成的双原子分子,由于共用电子对偏向吸引电子能力强的原子一方,使整个分子电荷分布不对称,所以全部是由极性键形成的极性分子。
如HCl、HBr等分子。
(3)以极性键结合的多原子分子,如果分子的空间构型是对称的,即为非极性分子,否则为极性分子。
(4)臭氧是一个特例,它属于极性分子。
2.判断AB n型分子是否有极性的经验规律
若分子中A原子的最外层电子全部参与成键,这种分子一般为非极性分子,如CO2、CH4、BF3等;若A原子的最外层电子未全部参与成键,则为极性分子,如H2O、NH3等。
上述经验规律也可表示为:
若A的化合价等于其价电子数目,则分子的空间结构对称,其分子为非极性分子;若A的化合价不等于其价电子数目,则分子的空间结构不对称,其分子为极性分子,具体分析如下表:
3.常见物质的分子构型
(1)直线型:H2、CO、NO、CO2、C2H2
(2)V型:H2O、H2S
(3)平面正三角型:BF3、BCl3
(4)三角锥型:NH3、PH3、NF3、H3O+
(5)正四面体型:CH4、CCl4、SiCl4(键角109。
28‟)、P4(键角60。
)
4.相似相溶原理
极性分子易溶于极性分子溶剂中(如:HCl、NH3、H2SO4易溶于水中),非极性分子易溶于非极性分子溶剂中(如:I2、Br2、S易溶于苯、CCl4中,白磷易溶于CS2难溶于水中)。
5.氢键
氢键是与非金属性很强的元素(如氮、氧、氟)相结合的氢原子和另一个分子中非金属极强的原子间所产生的引力而形成的。
氢键基本上还是属于静电作用,它比化学键弱得多,可看作是一种比较强的分子间作用力。
能形成氢键的物质很广泛,如水、醇、羧酸、无机酸、水合物、氨合物等。
氢键又分两种,一种是分子间氢键:一个分子的X-H键与另一个分子的原子Y相结合而成的氢键,分子间形成的氢键会使物质的熔点和沸点升高。
另一种是分子内氢键:一个分子的X--H键与它内部的原子Y相结合而成的氢键,分子内氢键的形成往往使化合物熔、沸点
降低。
Ⅳ.典型例题:
【例1】下列叙述中正确的是( )
A.极性分子中不可能含有非极性键B.离子化合物中不可能含有非极性键
C.非极性分子中不可能含有极性键 D.共价化合物中不可能含有离子键
【解析】H2O2、CH3CH2Cl等极性分子中含有非极性键,故A错;Na2O2、CaC2等离子化合物中含非极性键,故B错;CH4、CO2等非极性分子中含有极性键,故C错。
所以本题答案为D。
【例2】下列说法正确的是( )
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.在CaO和SiO2晶体中都不存在相应的分子
D .甲烷的结构式:是对称的平面结构,是非极性分子。
【解析】P4和NO2分子中都含有共价键,但P4是磷的单质故A项错。
CCl4、NH3分子虽都是由极性键结合而成,每个分子中各键极性又都分别相同,但CCl4是正四面体结构,应为非极性分子,故B项错。
原子晶体、离子晶体及金属晶体中都不存在小分子,只有分子晶体中晶体质点上才是分子,因而CaO、SiO2等式子并不是分子式,而只是相应物质的最简式,C项正确。
甲烷的结构式虽可以写成平面对称,但甲烷分子的实际构型是空间正四面体形.故D项错。
故选C。
【例3】下列结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键(示例:F2
)。
(1)根据各图表示的结构特点,写出该分子的化学式:
A. B.
C. D. 。
(2)在分子的结构式中,由一个原子提供成键电子对而形成的共价键用→表示,例如:
硫酸,硝基甲烷写出三硝酸甘油酯的结构式。
【答案】(1) A、NH3 B、HCN C、CO(NH2)2 D、BF3(2)
Ⅴ.跟踪训练:
1.(2003年桂林模拟题)在下列变化过程中,既有离子键又有共价键被破坏的是…( )
≡
A.Cl2通人品红溶液而褪色B.火碱溶于水中
C.将氧化钠投入水中D.将硫酸氢钠溶于水
2.(2005年北京西城高三抽样)下列分子有极性的是( )
A.CH≡CH B.C.CH3Cl D.N2
3.下列关于化学键的叙述,正确的是………………………………………( )
A.构成单质分子的粒子一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
4.(2004年大连测试题)同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中
一种,吸人后会引起慢性中毒。
有关二氯甲烷的说法正确的是…………( )
A.含有非极性共价键B.键角为109。
28'
C.有两种同分异构体D.分子属于极性分子
5.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。
请回答下列问题:
(1)Na3N的电子式是,该化合物由键形成。
(2)Na3N与盐酸反应生成种盐,其电子式分别是和。
(3)Na3N与水的反应属于(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+) r(N3-)(填“>”“=”“<”)。
6.已知H202分子的结构如图5—7所示:H202分子不是直线形的,两个H原子犹如在半展开的书的两面线上,氧原子则在书的夹缝上,书页角为93。
52…,而两个O-H键与O-O键的夹角均为96。
52‟。
试回答:
(1)写出H202分子的电子式和结构式;
(2)写出分子内的键型;
(3)估计它难溶于CS2,简要说明原因;
(4)指出氧元素的化合价,简要说明原因。
7.下列各组分子中,都属于含有极性键的非极性分子的是()
A.CO2、H2S B.C2H4、CH4C.Cl2、C2H2 D.NH3、HCl
8.下列各组分子中,都是由极性键构成的极性分子的是()
A.CH3Cl、Cl2B.NH3、H2O C.H2S、CS2D.CO2、HI
9.已知N、P同属于元素周期表的V A族元素,N在第二周期,P在第三周期。
NH3分子呈三角锥形,N原子位于锥顶,三个H原子位于锥底,N-H键间的夹角是107。
18‟。
(1)PH3分子与NH3分子的构型关系是(填“相同”或“相似”或“不相似”),P-H 极性(填“有”或“无”),PH3分子(填“是”或“不是”)极性分子。
(2)NH3与PH3相比,热稳定性更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是。
A.键的极性:N-H比P-H强B.分子的极性NH3比PH3强
C .相对分子质量PH 3比NH 3大
D .NH 3分子之间存在特殊的分子间作用力 考点十五“非极性分子和极性分子”参考答案:
1.D
2.C
3.B
4.D
5. (1) 、离子键
(2)两 、(3)复分解反应 (4)<
6、(1)
(2)分子内既有非极性键,又有极性键。
(3)过氧化氢是极
性分子,而CS 2是非极性分子,由相似相容原理知,H 2O 2难溶于CS 2 。
(4)氧元素为-1价。
因为,O-O 键为非极性键,H-O 为极性键,每个氧原子有一个不同元素形成的共用电子对。
7、B 8、B 9、(1)相似 有 是 (2)NH 3 (3)D
H H O O · · · ·
· · · · · · · · · · H-O-O-H
Na + Cl · ·
· ·
· · · ·
[ ]- Cl · · · · · · · ·
[ ]- N · ·
· · · · · · [ H H H
H ]+ N · · · · · · ·
· Na + [ ]3- Na + Na +。
