选修四第四章第3节《电解池》第1课时
人教化学选修4第四章第三节电解池第一课时(共15张PPT)
H 2HS2OSA4O溶4液溶液
C
CCuCul CDF2l2溶溶液液
用石墨电极电解CuCl2、NaCl水溶液:
电解质溶液
电极反应及总反应式
电解类型
CuCl2
阴极:Cu2++2e-=Cu
( Cu2+、Cl- 、 H+、OH- )
阳 总极式::C2uCCl-l2-电2=解e-C= uC+l2C↑ l2↑
将实验2中的两个电极反接,即附有铜的电极接
到电源的正极作为阳极,继续电解CuCl2溶液。
有Cu析出
Cu
惰性电极 :本身不反应
电 极
石墨、Pt、Au
材 料 活性电极
做阴极,本身不反应。 做阳极,优先失电子
除Pt、Au外 被氧化而溶解
的金属电极
zzz3zz、zzzz放电顺序
①阳极:
活性电极> S2-> I-> Br-> Cl-> OH-
【探究实验】探究以石墨(碳棒)为电
极进行电解时,电解质溶液在导电的过
程中发生了哪些变化。
1、电解
2、电解
NaCl 溶液
(滴加
6V CuCl2
6V
溶液
有酚酞)
【其它实验用品】KI-淀粉试纸、蒸馏水、镊子。
粒子 移向
电极 反应
电子:负极 外电路 阴极, 阳极 外电路 正极 电流:正极 → 阳极, 阴极 → 负极 阴离子 → 阳极 阳离子 → 阴极
阴极:阳离子得电子——还原反应
阳极:阴离子失电子——氧化反应 总反应:阴、阳两极反应式相加
zz2zz、zzzzz电解原理
⑴电解:使电Байду номын сангаас通过电解质
溶液而在阴、阳两极引起 氧化还原反应的过程。
高中人教版选修4 第4章第3节 电解池(第1课时) 课件(28张)

跟踪训练
第4页
经典品质/超越梦想
同步导练/RJ·选修④
化学
目标导航
目标导航 要点导学 典例导析 方法导拨 真题导思
跟踪训练
第5页
经典品质/超越梦想
同步导练/RJ·选修④
化学
1.了解电解池的工作原理,初步掌握一般电解 反应产物的判断
重点
2.学会书写电极反应
重点、难 点
目标导航 要点导学 典例导析 方法导拨 真题导思
b.两个电极阳 阴极 极: :与 与电 电源 源
相连,发生 相连,发生
反应。 反应。
③________溶液或熔融________。
④形成________。
(3)离子的定向移动:阴离子移向________,阳离子移向________。
化学
目标导航 要点导学 典例导析 方法导拨 真题导思
跟踪训练
第9页
经典品质/超越梦想
总反应 Cu2++2Cl-=电==解==________。
(3)CuCl2 溶液导电的过程,就是 CuCl2________的过程,就是在阴阳两极发生氧化还 原反应的过程。
目标导航 要点导学 典例导析 方法导拨 真题导思
跟踪训练
第8页
经典品质/超越梦想
同步导练/RJ·选修④
2.电解原理 (1)电解:使电流通过________而在两个电极上引起________的过程。 (2)电解池: ①定义:将________转化为________的装置。 ②构成:a.直流电源
C.CuCl2 溶液
D.酸性 AgNO3 溶液
【解析】 根据电解原理,推知 A 项,实质电解水,阴阳两极分别析出 H2 和 O2;B 项,阴阳两极分别析出 H2 和 Cl2;C 项,分别析出 Cu 和 Cl2;D 项,分别析出 Ag 和 O2。
人教版高二化学选修4教学课件:第四章4.3 电解池(共50张PPT)

第2课时 电解原理的 2 应用
• 1. 氯碱工业
• (1)概念 • 用电解饱和食盐水的方法来制取Cl2、NaOH、H2,并
以它们为原料生产一系列化工产品的工业,称为氯碱工业。
• 1. 氯碱工业
• (2)原理
• ①通电前,NaCl溶液中含有的离子是___________。
• 通电时,移向阴极的离子是______,移向Na阳+极C的l− 离H+子O是H−
Fe2+>Zn2+>H+(水)>
•
Al3+、Mg2+、Na+、Ca2+、K+
• 2. 电解产物的判断 • (3)电极产物的判断
离子 S2− 产物 S
SO32− SO42−
I− Br− Cl− OH−
I2
Br2 Cl2 O2
离子 Ag+ Hg2+ Fe3+ Cu2+ H+ 产物 Ag Hg Fe2+ Cu H2
借助于电流,反应进行是 不自发的氧化还原反应。
• 2. 构成条件
直流电源 两个电极 电解质溶液(或熔融电解质) 闭合回路
阴极
阳极
• 3. 工作原理
e-
e-
二、电解原理
• 1. 电解
• 使(直流)电流通过电解质溶液(或熔融电解质)而在阴、 阳两极引起氧化还原反应的过程叫做电解。
电离与电解的比较
合金的方法。 • (2)电解槽构成 • 阴极——待镀金属 • 阳极——镀层金属 • 电镀液——含有镀层金属离子 • (3)特点 • ①阳极参与电极反应 • ②电镀液浓度保持不变
• 3. 电解精炼铜
• (1)电解槽构成 • 阳极:粗铜 (含Zn、Fe、Ni、Au、Ag等杂质) • 阴极:纯铜 • 电解液:CuSO4溶液
人教化学选修4第四章第3节 电解池第1课时 (共17张PPT)

H+→H2↑ OH-→O2↑
电极反应:
-
阳极: 2Cl- - 2e- = Cl2↑
(氧化反应)
阴极C:u2+ + 2e- = Cu
(还原反应)
总反应式:CuCl2 电解 Cu + Cl2↑
一、电解原理
1.电解: 使直流电通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程,叫做电解。
2.电解池: 电能转变为化学能的装置。 C
2.根据放电规律,阳离子在阴极发生还原反应,而 阴离子在阳极发生氧化反应,完成电极反应式。
(注意得失电子守恒) 3.由阴阳两电极反应式,合并得总反应式。(弱电
解质的须保持分子形式)
想一想、做一做
[例]以石墨碳棒为电极,请写出分别电解下列溶液时,在 阴、阳两极上发生的电极反应式及总的化学方程式。 (1)NaCl溶液: 阳极:2Cl--2e-=Cl2↑
阳极:与电源正极相连
正极:较不活泼金属( 或能导电的非金属)
阴极:与电源负极相连
负 失电极 电: 子解氧池化与反原应电,池金有属 哪阳中极些极的金异:阴属同离失氧(子 电化续失 子反)电应子,或溶电液
正极:还原反应,溶液 中的阳离子得电子
阴极:还原反应,溶液 中的阳离子得电子
电子
导线
流向 负极
正极
电源负极→电解池阴极 电解池阳极→电源正极
阴极:2H++2e-=H2↑ (2H2O 2H++2OH-)
总反应:2Cl-+2H2O 电=解Cl2↑+H2↑+2OH-
(2)CuSO4溶液:
OH-在哪一极?
阳阴极极::42OCuH2-+-4+e4-e=-=2H2C2Ou+O2↑ (4H2O 4H++4OH-)
高中化学第四章第三节电解池第1课时课件新人教选修4.ppt

氧
气
气
—
+
电解
电解水 :2 H2O
2 H2 + O2
思考回忆
1、电解质是指在_水_溶__液_或__熔__融_状__态_下__能够导 电的化合物。
2、电离是指电解质在___水_溶__液___或_熔__融___ 状态下离解成_自__由__移_动__离_子___的过程。
3、原电池是把__化__学_能__转_化__为__电_能__的装置 。 4、构成原电池的条件是
阴极d: Cu2+ + 2e– = Cu
阳极
阴极
A、a为负极,b为正极 B、a为阳极,b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变
阳极: 2Cl-- 2e- = Cl2↑
通直流电
电解CuCl2溶液的化学反应方程式:CuCl2或=电=解Cu+Cl2↑
电解原理1、电ຫໍສະໝຸດ 的概念 使电流通过电解质溶液而在阴、阳两极引 起 氧化还原 反应的过程叫做电解。
注意: ①电流必须是直流电 而不是交流电。 ② 熔融态 的电解质也能被电解。
2、电解池:
(氧化反应)
阴极: Cu2++ 2e— = Cu 总反应: Cu2+ + 2Cl— 电解
离子化合价降低或得到电子
(还原反应)
Cu + Cl2↑
或 CuCl2 电解 Cu +Cl2↑ (氧化还原反应)
区别电离: CuCl2 电离 Cu2+ + 2Cl—
原理分析: 本实验的微观解释
成CuC2+uC和lC2是l-强。电Cu解Cl质2 且电离易溶C于u2+水+,在2C水l-溶液中 电离 生 通电前,Cu2+和Cl-在水里 自由 地移动着;
2018-2019学年人教版选修4 第4章第3节 电解池(第1课时) 课件(57张)

2.电解池 (1)概念:将________转变为________的装置。 (2) 构 成 条 件 : ① 两 个 ________ , ② ___________ , ③ _____________,④构成______________。
(3)工作原理(以惰性电极电解氯化铜为例)。 ①实验装置:
②原理分析: 电极 电极类型 实验现象 电子流向 电极反应 反应类型 总反应 与负极相连的电极 与正极相连的电极
- 2- 能力比 OH-的强,如 SO3 、MnO2 4 等。
(2)阴极阳离子的放电顺序 Ag+、Hg2+、Fe3+、Cu2+、H+‖Pb2+、Sn2+、Fe2+、Zn2+ Al3+、Mg2+、Na+、Ca2+、K+
阳离子的放电顺序基本上符合金属活动性顺序表, 在阳离子放 电能力由强到弱排列时,一般将 H+的位置放在 Cu2+之后。但在电 镀条件下,H+的位置放在 Zn2+之后,Fe2+、Zn2+与 H+顺序颠倒, 即在水溶液中 Fe2 、Zn2 的得电子能力比 H 强,可认为水电离产
第四章 电化学基础
第三节 电解池
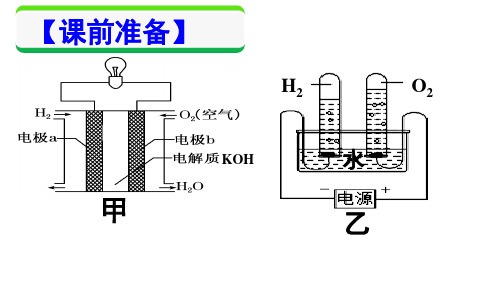
电解是重要的化工生产手段, 重要的化工原料盐酸、 烧碱等就 是以电解食盐水为基础制备的。 各种美观、 耐腐蚀的五金产品如水 龙头、拉手等都要进行电镀处理,电镀也是电解的应用之一。如今 电解又在治理环境污染,消除各种环境中的有害物质时大显身手。
1.了解使电能转化为化学能的条件和方法;知道电解是借助 电能使不能自发进行的氧化还原反应能够发生的过程; 熟悉电解池 的构成条件和阴、 阳离子的放电顺序, 并知道放电顺序还与其他因 素有关;掌握常见的电解池的电极反应式的书写。(重、难点) 2.了解电解原理在化工生产方面的应用;知道氯碱工业、电 解精炼铜、电镀以及电冶金等的原理。(重点)
人教版高中化学选修四第四章第3节电解池

选修四第四章第 3 节电解池第一课时电解原理【学习目标】1.理解电解原理、电解池的构造,准确判断电解池的阴阳两极2.初步掌握阴阳离子在两极的放电顺序3.初步掌握对电极反应物及生成物的判断4.提高对实验观察,动手操作,归纳总结的能力,养成自主学习的习惯5.感悟团队合作学习的乐处,提高学习积极性【学习重点】电解池的工作原理【学习难点】离子放电顺序、电极反应物及产物的判断学习过程【引言】1799 年,当意大利人发明了最原始的电池--- 伏打电池之后,许多科学家对电产生了浓厚的兴趣,电给世界带来了太多的不可思议,好奇心驱使着人们去进行各种尝试,想看看它还能否出现什么奇特的现象。
1807 年,当英国化学家戴维将铂电极插入熔融的氢氧化钾并接通直流电源时,奇迹终于产生了,在阴极附近产生一种银白色的金属,随即形成紫色的火焰。
这就是发现钾元素的主要过程,当时在社会上引起了轰动。
他随后用电解法又相继发现了钠、钙、锶、钡、镁、硼、硅等元素,戴维成为发现化学元素最多的。
这其中的奥妙是什么呢?电解时,物质的变化是如何发生的呢?【师生互动】学生展示预习成果,教师总结。
电解池1.概念:将转变为的装置。
2.阳极与阴极阳极:与电源相连的电极阴极:与电源相连的电极3.构成条件①电源②两个电极③或熔融电解质④【教师活动】讲述实验注意事项【学生活动】学生分组完成实验4-2,教师协助,注意观察实验现象,并完成探究一第一部分。
探究一电解 CuCl2溶液(一) 1、试验探究×CC若烧杯中的液体为 CuCl 2溶液,合上电源开关,给 CuCl 2溶液通电时现象:阴极上,此该物质是。
CuCl 2溶液阳极上:,经检验该物质是。
两支电极上发生的反应为:阳极:。
反应类型:反应。
阴极:。
反应类型:反应。
总反应式:。
【师生互动】小组成员选出代表展示实验成果,教师作出评价。
【自主学习】完成探究一第 2 部分.(二)归纳总结:过程分析:CuCl 2溶液能导电是因为存在,通电后这些自由移动的离子,在电场作用下发生移动,根据相互吸引的原理,带负电的氯离子向极移动,在阳极,氯离子失去电子被为氯原子,并两两结合成氯分子,从阳极放出,带正电的铜离子向极移动,在阴极铜离子获得电子被成铜原子,覆盖在阴极上。
选修四第四章第三节《电解池》第一课时1

化。
(2)装置Y实现由 ________ 电能 。 (3)装置X的电极反应式为
2H++2e-= H2 ↑
2 2
-= 2H O+O ↑ ______________ ,____________________ 4O下列说法不正确的是( A ) A与电源正极相连的是电解池的阴极 B与电源负极相连的是电解池的阴极 C在电解池的阳极发生氧化反应 D电子从电源的负极延导线流入电解池的阴极 2.如图所示是电解氯化铜溶液的装置,其中c、d为石 墨电极,下列有关判断正确的是(C ) A a为负极,b为正极 B a为阳极,b为阴极 C 电解过程中,d电极质量增加 D 电解过程中,氯离子的浓度不变
4.接通电源,约1 min时 用镊子取一片用蒸馏水湿润的碘化钾
淀粉试纸靠近阳极碳棒(与电源正极相连),观察实验现象。 5.关闭电源,取下阴极碳棒(与电源负极相连),仔细观察实 验现象。
注意用电安全!
实验分析
阴极
阳极
电极现象 电极产物
有红色物质析出
有刺激性气味的气体 产生,且可使湿润的 淀粉 KI变蓝
生成Cu
Cu2+ + 2e- = Cu
还原反应
生成Cl2
2Cl-- 2e-= Cl2↑
氧化反应
电极反应
反应类型 总反应
CuCl2
电解
Cu + Cl2↑
请阅读课本P79,了解放电概念。 用石墨作电极电解氯化铜溶液时,阴极上为什么
是Cu2+放电,而不是H+?阳极上为什么是 Cl- 放电
而不是OH-?
放电顺序:H+<Cu2+;OH-<Cl-
课后提升
分析下图装置,写出电极反应式和电解池总反应式。
电解法在元素发现史上的地位
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
判断阳极材料及阴阳两极附近离子种 类及离子放电顺序 (后电解)
根据阳极氧化,阴极还原分析得出产物
2、书写电解方程式的注意事项
①首先看阳极材料,若阳极是活性电极阳极本身失去电子
被氧化,若阳极是惰性电极,阴离子在阳极放电。
②电极反应式要注意溶液的酸碱性对书写的影响;要注意
微观解释
什么是放电
【问题5】为什么在阴极Cu2+优先得电子、阳极Cl优先失电子?你能从中得出什么规律? 阴离子失电子顺序:还原性更强,则优先失电子
阳离子得电子顺序:氧化性更强,则优先得电子 放电:阴离子在阳极失电子、阳离子在阴极得电 子的过程 (谁强谁放电)
★(一)电解池的基本概念
起氧化还原反应的过程。
第四章《电化学基础》
第3节《电解池》
第1课时:电解池工作原理
1、会描述电解池的工作原理, 2 、能正确书写电解池的电极反应式和电解反应方程 式。
【知识链接】氧化还原性强弱的判断
1、根据金属活动顺序表判断:
2、根据元素非金属性强弱判断:
什么是电解池
化学能
转化
电能
电能
转化
化学能
原电池的本质是自发的氧化还原反应。 电解池能让非自发的氧化还原反应得以发生
1.下列关于电解池的叙述中,正确的是
A.电解池中的闭合回路仅是由电子的定向移动形成的 B. 金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴 极 流向电源的正极 C.在电解质溶液中,阴离子向阴极移动,阳离子向阳极移动 D.相同时间内,阳离子在阴极上得到的电子数与阴离子在阳极上失去
答 案
的 电子数相等
(三)电极反应式与电解离子方程式书写
【例1】写出用石墨做电极电解CuSO4溶液的电极反应式及总电 解方程式 ①首先明确溶液中存在哪些离子,分析比较阴阳极的放电顺序 阳极:OH- > SO42ˉ 阴极:H+ < Cu2+ ②然后写电极反应式 :按离子方程式要求处理 阴极: 2Cu2+ + 4eˉ =2Cu 阳极: 4OHˉ -4eˉ =O2↑+2H2O 来自弱电解质的离子改用分子形式,否则仍 ③两极相加得总方程式 为离子 电解 2Cu2++2H2O = 2Cu+O2↑+4H+
ห้องสมุดไป่ตู้
√
(3)原电池的正极和电解池的阳极均发生氧化 反应( × )
5、写出用惰性电极电解时所发生的电极反应方程式
阳极
氧 气
Na2SO4溶液
阴极 氢 气
阳极: 4OH- - 4e- =2H2O+O2 ↑ 阴极: 4H ++ 4e- = 2H2 ↑ 2H2O
电解
2H2 ↑ + O2 ↑
+
6、在浸泡过碘化钾溶液和 淀粉溶液的滤纸上,接上电源(如图)。 通电后,发现在A处出现蓝色。 (1)请写出A、B处的电极方程式和写出总反应 - - 2e- = I 2I A、 , 2 B、 2H+ + 2e- =H2↑ ,
得电子能力(氧化性)强的阳离子先放电 3+ + 其中K ~ Al 在水溶液中不放电。
★必记:Ag+ > Fe3+ > Cu2+ > H+
2、阳极:先看电极后看溶液
(1)若阳极材料为活性金属电极(除Pt 、Au、外),则 阳极电极反应为金属失电子
金属 - ne-
=
金属阳离子
(2)若阳极材料为惰性电极(Pt、Au、石墨),则阳极电 极反应为溶液中阴离子放电。
电解
—
A
B
总反应: 2KI+2H2O
2KOH+I2+H2↑。
(2)若有0.02mol电子流入电源正极, 理论上可产生 0.01 molH2。
【高考链接】
1.如图所示,X、Y 分别是直流电源的两极,通 电后,a 极板质量增加,b 极板处有无色无臭气 体放出。符合这一情况的是(
a 极板 A B C D 锌 石墨 银 铜 b 极板 石墨 石墨 铁 石墨 X 电极 负极 负极 正极 负极
2、下图是电解CuCl2溶液的装置,其中c、d为 石墨电极。则下列有关的判断正确的是( ) A a为负极、b为正极 B a为阳极、b为阴极 阳极 C 电解过程中,d电极质量增加 D 电解过程中,氯离子浓度不变
C
+
阴极
练一练
1.有关电解原理的说法正确的是( D ) ①电解是把电能转变成化学能;②电解是 把化学能转变成电能;③电解质溶液导电 是化学变化,金属导电是物理变化;④不 能自发进行的氧化还原反应,通过电解的 原理可以实现;⑤任何溶液被电解时,必 然导致氧化还原反应的发生。 A.①②③④ B.仅②③⑤ C.仅③④ D.①③④⑤
A
)
Z 溶液 CuSO4 NaOH AgNO3 CuCl2
2、某同学按右图所示的装置进行电解实验。下 列说法正确的是 A.电解过程中,铜 电极上有H2产生 B.电解初期,主反 应方程式为:
BC
Cu+H2SO4=CuSO4+H2↑ C.电解一定时间后,石墨电极上有铜析出 D.整个电解过程中,H+的浓度不断增大
电子流出的一极 电流 流入 一极
发生氧化 反应的极 阴离子 移入的一极 电极质量 减少 的一极 该电极为活性电极
3、以惰性电极电解 CuSO4 溶液。若阳极上 产生气体的物质的量为 0.01 mol。则阴极 上析出 Cu 的质量为( B A.0.64 g C.2.56 g
阴极:2Cu +4e
2+
)
B.1.28 g D.5.12 g
-
解析:根据电极反应,阳极:4OH -4e
-
2H2O+O2↑,
2Cu ~ 2Cu 2×64 g 1.28 g
练一练
2、下列说法错误的是(
C)
A 由电能转化为化学能的装置叫电解池 B 在电解池中跟直流电源的正极相连的电极是电解 池的阳极 C 在电解池中通电时,电子从电解池的阴极流出,
并沿导线流回电源的负极
D 电解池中阴极发生还原反应,阳极发生氧化反应
活学活用
3.如下图所示装置中,属于电解池的是
答 案
解 析
1、电解:使电流通过电解质溶液,而在阴、阳两极引
2、电解池:借助于电流引起氧化还原反应的装
置,也就是把电能转化为化学能的装置叫做电解池或 电解槽。
【特别注意】
原电池的本质是自发的氧化还原反应; 而电解池的本质是非自发的氧化还原反应。
阴极:与电源负极相连 阳极:与电源正极相连 3、电解池构成条件:
①直流电源 ②两个电极(注意惰性电极为Pt、Au或石墨) ③电解质溶液(或熔融电解质) ④形成闭合回路
(二)电解时离子放电顺序:各种离子得失电子的能力顺序
阳离子得电子或阴离子失电子使离子电荷降低 的过程叫做放电。
1、阴极:阳离子放电,金属活动顺序的反顺序
溶液中阳离子得电子,得电子能力为:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+ >Zn2+ >H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
4、电解池的两极
电解池的两极是由与之相连的电源电极决定的。
阴极:与电源负极相连的电极。(发生还原反应) 阳极:与电源正极相连的电极。(发生氧化反应)
★(二)电解池的工作原理
1、电解池中的电子的移动方向
电源负极→电解池阴极→电解液中的阳离子(被还原)
电解池中阴离子(被氧化)→电解池阳极→电源正极 电源 负极 电解 池阴极
【问题2】通电后,两根电极附近将分别聚集哪些 微粒?各会发生什么样的反应?产物可能是什么? 电极区1: Cu2+→Cu 电极区2: Cl-→Cl2↑ H+→H2↑ OH-→O2↑
实验现象
电极 实验现象
阴极 阳极
出现红色固体 使湿润的淀粉碘 化钾试纸变蓝
产物验证
产物确定
铜
有气泡逸出
氯气
【问题4】请从微观角度解释电解原理。
2CuSO4+ 2H2O
电解
2Cu +O2 ↑+ 2H2SO4
•【例2】写出下列装置中所发生的电极反应式及总电解方程式
铜
铁
阳极:Cu— 2e- = Cu2+ 阴极:Cu2++ 2e- =Cu Cu+
Cu2+
电解
Cu+ Cu2+
CuSO4溶液
•【例3】写出下列装置中所发生的电极反应式及总电解 方程式
通过电解质溶液中离子定向移动 电子本身不能通过电解质溶液
电解 池阳极
电源 正极
2、离子的运动方向 阳离子→阴极;阴离子→阳极
归纳总结 电解池的工作原理
(1)电解池的工作原理示意图
还原
阴极
阳极 氧化
【注意】电解质导电的过程就是电解质的电解过程。
思考:
为何当一个电极存在多种可能的放电 离子时,不是大家共同放电,而是只有 一种离子放电?放电能力与什么因素有 关?
铁
铜
阳极: Fe— 2e- = Fe2+ 阴极:Cu2++ 2e- =Cu
Fe+
CuSO4溶液 (C)
Cu2+
电解
Cu+ Fe2+
【方法总结】
e
阳离子
e
①确定电源的正负极 ②确定电解池的阴阳极
③确定阴阳极聚集的离子 ④确定离子的放电顺序
阳 极
阴离子
