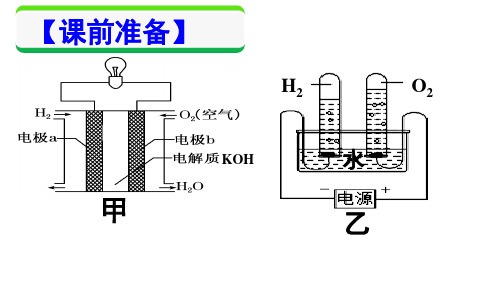
选修四第四章第三节《电解池》第一课时4
高中人教版化学选修四课件:4-3-1 电解池

1.用惰性电极电解氯化镁溶液,在阴极观察到现象是怎样的? 提示:用惰性电极电解氯化镁溶液,Mg2+和 H+向阴极移动,因 H+的氧化性强,故 H+ 放电产生氢气,同 时生成的 OH-与 Mg2+结合产生氢氧化镁沉淀。 2.若将等物质的量的 CuSO4 和 MgCl2 混合溶于水,对该溶液以惰性电极进行电解,试讨论两个电极可 能的产物,并写出总反应式。 提示:在此混合溶液中,含有的阳离子放电顺序为 Cu2+ > H+> Mg2+ ,阴离子放电顺序为 Cl-> OH->
02 课堂导学探究
要点 电解的规律
1.电解池的阴、阳极的判断方法
2.电解池中按规律书写电极反应式
3.给出电解总反应方程式书写电极反应式
4.用惰性电极电解电解质溶液的规律小结
[特别提醒]
(1)用惰性电极电解电解质水溶液时, 首先要全面分析电解质溶液的组成, 找全离子并
分为阴、阳两组,然后排出阴、阳离子的放电顺序,写出两极上的电极反应式,根据两极的电极反应式写出 总反应方程式。 (2)若阴极为 H+ 放电,则阴极区 c(OH- )增大;若阳极区 OH-放电,则阳极区 c(H+ )增大;若阴、阳极分 别同时有 H+、 OH- 放电,相当于电解水,电解质溶液浓度增大 (饱和溶液例外 )。 (3)电解后要恢复原电解质溶液的浓度,须加适量的某物质,该物质可以是阴极与阳极产物的化合物。如 用惰性电极电解 CuSO4 溶液,要恢复原溶液浓度,可向电解后溶液加入 CuO,也可以加入 CuCO3,但不能 加入 Cu(OH)2,因为 Cu(OH)2 与 H2SO4 反应生成水,使水量增加。电解质溶液恢复的原则是“析出什么加什 么”。
例
下图是一个用铂丝作电极,电解稀的 MgSO4 溶液的装置,电解液中加有中性红指示剂,此时溶液呈
人教化学选修4第四章第三节电解池第一课时(共15张PPT)
H 2HS2OSA4O溶4液溶液
C
CCuCul CDF2l2溶溶液液
用石墨电极电解CuCl2、NaCl水溶液:
电解质溶液
电极反应及总反应式
电解类型
CuCl2
阴极:Cu2++2e-=Cu
( Cu2+、Cl- 、 H+、OH- )
阳 总极式::C2uCCl-l2-电2=解e-C= uC+l2C↑ l2↑
将实验2中的两个电极反接,即附有铜的电极接
到电源的正极作为阳极,继续电解CuCl2溶液。
有Cu析出
Cu
惰性电极 :本身不反应
电 极
石墨、Pt、Au
材 料 活性电极
做阴极,本身不反应。 做阳极,优先失电子
除Pt、Au外 被氧化而溶解
的金属电极
zzz3zz、zzzz放电顺序
①阳极:
活性电极> S2-> I-> Br-> Cl-> OH-
【探究实验】探究以石墨(碳棒)为电
极进行电解时,电解质溶液在导电的过
程中发生了哪些变化。
1、电解
2、电解
NaCl 溶液
(滴加
6V CuCl2
6V
溶液
有酚酞)
【其它实验用品】KI-淀粉试纸、蒸馏水、镊子。
粒子 移向
电极 反应
电子:负极 外电路 阴极, 阳极 外电路 正极 电流:正极 → 阳极, 阴极 → 负极 阴离子 → 阳极 阳离子 → 阴极
阴极:阳离子得电子——还原反应
阳极:阴离子失电子——氧化反应 总反应:阴、阳两极反应式相加
zz2zz、zzzzz电解原理
⑴电解:使电Байду номын сангаас通过电解质
溶液而在阴、阳两极引起 氧化还原反应的过程。
人教版高二化学选修4教学课件:第四章4.3 电解池(共50张PPT)

第2课时 电解原理的 2 应用
• 1. 氯碱工业
• (1)概念 • 用电解饱和食盐水的方法来制取Cl2、NaOH、H2,并
以它们为原料生产一系列化工产品的工业,称为氯碱工业。
• 1. 氯碱工业
• (2)原理
• ①通电前,NaCl溶液中含有的离子是___________。
• 通电时,移向阴极的离子是______,移向Na阳+极C的l− 离H+子O是H−
Fe2+>Zn2+>H+(水)>
•
Al3+、Mg2+、Na+、Ca2+、K+
• 2. 电解产物的判断 • (3)电极产物的判断
离子 S2− 产物 S
SO32− SO42−
I− Br− Cl− OH−
I2
Br2 Cl2 O2
离子 Ag+ Hg2+ Fe3+ Cu2+ H+ 产物 Ag Hg Fe2+ Cu H2
借助于电流,反应进行是 不自发的氧化还原反应。
• 2. 构成条件
直流电源 两个电极 电解质溶液(或熔融电解质) 闭合回路
阴极
阳极
• 3. 工作原理
e-
e-
二、电解原理
• 1. 电解
• 使(直流)电流通过电解质溶液(或熔融电解质)而在阴、 阳两极引起氧化还原反应的过程叫做电解。
电离与电解的比较
合金的方法。 • (2)电解槽构成 • 阴极——待镀金属 • 阳极——镀层金属 • 电镀液——含有镀层金属离子 • (3)特点 • ①阳极参与电极反应 • ②电镀液浓度保持不变
• 3. 电解精炼铜
• (1)电解槽构成 • 阳极:粗铜 (含Zn、Fe、Ni、Au、Ag等杂质) • 阴极:纯铜 • 电解液:CuSO4溶液
高中化学第四章第三节电解池第1课时课件新人教选修4.ppt

氧
气
气
—
+
电解
电解水 :2 H2O
2 H2 + O2
思考回忆
1、电解质是指在_水_溶__液_或__熔__融_状__态_下__能够导 电的化合物。
2、电离是指电解质在___水_溶__液___或_熔__融___ 状态下离解成_自__由__移_动__离_子___的过程。
3、原电池是把__化__学_能__转_化__为__电_能__的装置 。 4、构成原电池的条件是
阴极d: Cu2+ + 2e– = Cu
阳极
阴极
A、a为负极,b为正极 B、a为阳极,b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变
阳极: 2Cl-- 2e- = Cl2↑
通直流电
电解CuCl2溶液的化学反应方程式:CuCl2或=电=解Cu+Cl2↑
电解原理1、电ຫໍສະໝຸດ 的概念 使电流通过电解质溶液而在阴、阳两极引 起 氧化还原 反应的过程叫做电解。
注意: ①电流必须是直流电 而不是交流电。 ② 熔融态 的电解质也能被电解。
2、电解池:
(氧化反应)
阴极: Cu2++ 2e— = Cu 总反应: Cu2+ + 2Cl— 电解
离子化合价降低或得到电子
(还原反应)
Cu + Cl2↑
或 CuCl2 电解 Cu +Cl2↑ (氧化还原反应)
区别电离: CuCl2 电离 Cu2+ + 2Cl—
原理分析: 本实验的微观解释
成CuC2+uC和lC2是l-强。电Cu解Cl质2 且电离易溶C于u2+水+,在2C水l-溶液中 电离 生 通电前,Cu2+和Cl-在水里 自由 地移动着;
2018-2019学年人教版选修4 第4章第3节 电解池(第1课时) 课件(39张)

当 堂 达 标 • 固 双 基
合 作 探 究 • 攻 重 难
学 业 分 层 测 评
返 首 页
[基础自测]
自 主 预 习 • 探 新 知
1.判断正误(正确的打“√”,错误的打“×”)。 (1)电解池中阳极发生氧化反应。(
+
) ) ) )
(2)电解 CuCl2 溶液时,Cu2 向阳极移动。(
当 堂 达 标 • 固 双 基
当 堂 达 标 • 固 双 基
合 作 探 究 • 攻 重 难
学 业 分 层 测 评
返 首 页
自 主 预 习 • 探 新 知
4.构成电解池的条件:①直流电源;②两个电极;③电解质溶液或熔融电 解质;④形成闭合回路。 5.离子的定向移动:阴离子移向 阳极 ;阳离子移向 阴极。 6.电子的流向:电源负极―→阴极;阳极―→电源正极。
D [b 与电源负极相连,b 为阴极,阴极上发生还原反应,A 项错误;该装 置是电解池,将电能转化为化学能,B 项错误;电解池中,阳离子(Cu2 )向阴极
+
当 堂 达 标 • 固 双 基
合 作 探 究 • 攻 重 难
(b 极)移动,C 项错误;a 为阳极,若 a 为 Cu,属于活性电极,则阳极反应为 Cu-2e-===Cu2+,D 项正确。]
合 作 探 究 • 攻 重 难
学 业 分 层 测 评
返 首 页
自 主 预 习 • 探 新 知
A
ห้องสมุดไป่ตู้
[可利用电解质溶液中离子的移动方向判断出电源的正负极,并写出电
极反应式和反应现象。A.铜离子应移向阴极,则 a 为负极。B.CuCl2 发生电离是 在水分子的作用下完成的,并非通电才能发生。C.反应 Cu2++2e-===Cu 应在阴
2018-2019学年人教版选修4 第4章第3节 电解池(第1课时) 课件(57张)

2.电解池 (1)概念:将________转变为________的装置。 (2) 构 成 条 件 : ① 两 个 ________ , ② ___________ , ③ _____________,④构成______________。
(3)工作原理(以惰性电极电解氯化铜为例)。 ①实验装置:
②原理分析: 电极 电极类型 实验现象 电子流向 电极反应 反应类型 总反应 与负极相连的电极 与正极相连的电极
- 2- 能力比 OH-的强,如 SO3 、MnO2 4 等。
(2)阴极阳离子的放电顺序 Ag+、Hg2+、Fe3+、Cu2+、H+‖Pb2+、Sn2+、Fe2+、Zn2+ Al3+、Mg2+、Na+、Ca2+、K+
阳离子的放电顺序基本上符合金属活动性顺序表, 在阳离子放 电能力由强到弱排列时,一般将 H+的位置放在 Cu2+之后。但在电 镀条件下,H+的位置放在 Zn2+之后,Fe2+、Zn2+与 H+顺序颠倒, 即在水溶液中 Fe2 、Zn2 的得电子能力比 H 强,可认为水电离产
第四章 电化学基础
第三节 电解池
电解是重要的化工生产手段, 重要的化工原料盐酸、 烧碱等就 是以电解食盐水为基础制备的。 各种美观、 耐腐蚀的五金产品如水 龙头、拉手等都要进行电镀处理,电镀也是电解的应用之一。如今 电解又在治理环境污染,消除各种环境中的有害物质时大显身手。
1.了解使电能转化为化学能的条件和方法;知道电解是借助 电能使不能自发进行的氧化还原反应能够发生的过程; 熟悉电解池 的构成条件和阴、 阳离子的放电顺序, 并知道放电顺序还与其他因 素有关;掌握常见的电解池的电极反应式的书写。(重、难点) 2.了解电解原理在化工生产方面的应用;知道氯碱工业、电 解精炼铜、电镀以及电冶金等的原理。(重点)
人教版高中化学选修四第四章第3节电解池

选修四第四章第 3 节电解池第一课时电解原理【学习目标】1.理解电解原理、电解池的构造,准确判断电解池的阴阳两极2.初步掌握阴阳离子在两极的放电顺序3.初步掌握对电极反应物及生成物的判断4.提高对实验观察,动手操作,归纳总结的能力,养成自主学习的习惯5.感悟团队合作学习的乐处,提高学习积极性【学习重点】电解池的工作原理【学习难点】离子放电顺序、电极反应物及产物的判断学习过程【引言】1799 年,当意大利人发明了最原始的电池--- 伏打电池之后,许多科学家对电产生了浓厚的兴趣,电给世界带来了太多的不可思议,好奇心驱使着人们去进行各种尝试,想看看它还能否出现什么奇特的现象。
1807 年,当英国化学家戴维将铂电极插入熔融的氢氧化钾并接通直流电源时,奇迹终于产生了,在阴极附近产生一种银白色的金属,随即形成紫色的火焰。
这就是发现钾元素的主要过程,当时在社会上引起了轰动。
他随后用电解法又相继发现了钠、钙、锶、钡、镁、硼、硅等元素,戴维成为发现化学元素最多的。
这其中的奥妙是什么呢?电解时,物质的变化是如何发生的呢?【师生互动】学生展示预习成果,教师总结。
电解池1.概念:将转变为的装置。
2.阳极与阴极阳极:与电源相连的电极阴极:与电源相连的电极3.构成条件①电源②两个电极③或熔融电解质④【教师活动】讲述实验注意事项【学生活动】学生分组完成实验4-2,教师协助,注意观察实验现象,并完成探究一第一部分。
探究一电解 CuCl2溶液(一) 1、试验探究×CC若烧杯中的液体为 CuCl 2溶液,合上电源开关,给 CuCl 2溶液通电时现象:阴极上,此该物质是。
CuCl 2溶液阳极上:,经检验该物质是。
两支电极上发生的反应为:阳极:。
反应类型:反应。
阴极:。
反应类型:反应。
总反应式:。
【师生互动】小组成员选出代表展示实验成果,教师作出评价。
【自主学习】完成探究一第 2 部分.(二)归纳总结:过程分析:CuCl 2溶液能导电是因为存在,通电后这些自由移动的离子,在电场作用下发生移动,根据相互吸引的原理,带负电的氯离子向极移动,在阳极,氯离子失去电子被为氯原子,并两两结合成氯分子,从阳极放出,带正电的铜离子向极移动,在阴极铜离子获得电子被成铜原子,覆盖在阴极上。
高中化学选修4人教版:4.3《电解池》课件

第一课时 电解原理
金属钠是在1807年通过电解氢氧化钠制得的,这 个原理应用于工业生产,约在1891年才获得成功。 1921年电解氯化钠制钠的工业方法实现了。由于金属 钠在现代技术上得到重要应用,它的产量显著地增加。 目前,世界上钠的工业生产多数是用电解氯化钠的方 法,少数仍沿用电解氢氧化钠的方法。
阳极 : 4OH- - 4e– =O2 ↑+2H2O 阴极 : 4H+ + 4e– =2H2↑
总 : 2H2O 电==解= 2H2↑+ O2↑
变红 变蓝
15
4达标训练
下图所示装置中,a、b都是惰性电极,通电一段时间,
b极附近溶液呈红色。下列说法正确的是 ( AC )
A.X是正极,Y是负极
B.X是负极,Y是正极
直流电,观察现象。约3~5min后切断电源。
现象 阴极--- 有红色的固体 Cu
阳极--- 有气泡产生
解释 阴极--- Cu2++2e-=Cu 阳极--- 2Cl--2e-=Cl2↑
总反应式:2Cl-+Cu2+=通=电 Cl2 ↑ +Cu
O2? Cl2?
如何检验?
6
电极产物反思
为什么不产 生氢气呢?
②用惰性电极(Pt、Au、石墨),溶液中阴离子放电
S 2->I ->Br ->Cl ->OH -> 含氧酸根>F阴极: 电极永远不反应,溶液中阳离子放电。
顺序:Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+> Al3+>Mg2+>Na+>Ca+>K+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节《电解池》学案
【学习目标】
1.了解电解池的构成条件。
2.了解电解池的工作原理。
一、【实验4-2】以石墨棒为阴阳极电解氯化铜溶液
【思考与交流1】通过阅读教材P79实验4-2,与直流电源
....正负极相连的两根碳棒名称如何定义?
二、【分组实验】以铜棒和石墨棒为阴阳极电解氯化铜溶液
【思考与交流2】查阅资料,活性电极和惰性电极的概念。
分组实验1(第1,2小组):石墨棒作阳极,铜棒作阴极,电解质溶液为CuCl2溶液。
分组实验2(第3,4小组):石墨棒作阴极,铜棒作阳极,电解质溶液为CuCl2溶液。
三、探究电解池的工作原理
【思考与交流3】关于电极反应的思考
1.根据实验现象,完成实验4-2及分组实验中阴阳极的电极反应
【实验4-2】石墨阴极:
石墨阳极:
总电极反应式:
【分组实验1】铜棒阴极:
石墨阳极:
【分组实验2】 石墨棒阴极:
铜棒阳极:
2. 阴极的反应类型是什么,阳极的反应类型是什么?
3. 阴极的放电规律
①阴极上的反应物是哪类物质?
②如果溶液中的阳离子不止一种,这些阳离子是同时反应还是先后反应。
③溶液中的阳离子不只一种,这些阳离子是依据什么性质先后参与反应的?
【当堂练习】
1.如右图所示:阳极材料是 ,
阳极上的电极反应式为 ; 阴极材料是 ,
阴极上的电极反应式为 。
2.写出下列电解池的电极反应式及总化学方程式。
(1)用石墨为电极电解饱和的氯化钠溶液
(2)用铜为阳极,石墨为阴极电解硫酸溶液
3.下列关于电解池的叙述中不正确的是:( )
A . 与电源正极相连的是电解池的的阴极
B . 与电源负极相连的是电解池的阴极
C . 在电解池的阳极发生氧化反应
D . 电子从电源的负极沿导线流入电解池的阴极
【小结】电解池阴阳极的判断依据 AgNO 3。
