浙江选考化学选考复习专题题化学反应原理
高中化学练习:反应原理图像专题复习
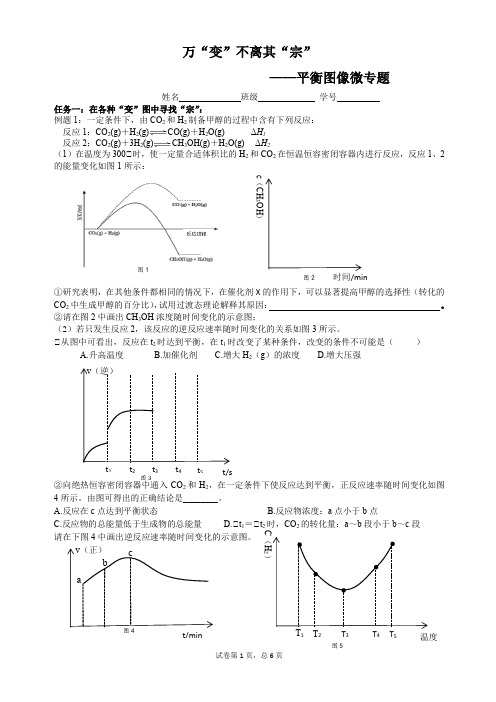
v (正) 图3图1t 5 t 4 t 3 t 2 t 1 v (逆) t/s 图4 a cbt/min 图5T 5 T 4 T 3 T 2 T 1 温度C (H 2)万“变”不离其“宗”——平衡图像微专题姓名 班级 学号任务一:在各种“变”图中寻找“宗”:例题1:一定条件下,由CO 2和H 2制备甲醇的过程中含有下列反应: 反应1:CO 2(g)+H 2(g)CO(g)+H 2O(g) ΔH 1 反应2:CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g) ΔH 2(1)在温度为300℃时,使一定量合适体积比的H 2和CO 2在恒温恒容密闭容器内进行反应,反应1、2的能量变化如图1所示:①研究表明,在其他条件都相同的情况下,在催化剂X 的作用下,可以显著提高甲醇的选择性(转化的CO 2中生成甲醇的百分比),试用过渡态理论解释其原因: 。
②请在图2中画出CH 3OH 浓度随时间变化的示意图;(2)若只发生反应2,该反应的逆反应速率随时间变化的关系如图3所示。
℃从图中可看出,反应在t 2时达到平衡,在t 1时改变了某种条件,改变的条件不可能是( )A.升高温度B.加催化剂C.增大H 2(g )的浓度D.增大压强②向绝热恒容密闭容器中通入CO 2和H 2,在一定条件下使反应达到平衡,正反应速率随时间变化如图4所示。
由图可得出的正确结论是________。
A.反应在c 点达到平衡状态B.反应物浓度:a 点小于b 点C.反应物的总能量低于生成物的总能量D.℃t 1=℃t 2时,CO 2的转化量:a ~b 段小于b ~c 段 请在下图4中画出逆反应速率随时间变化的示意图。
时间/min c (CH 3OH )图2图 4 α型 β型 T 1T 6 T 5 T 4 T 3 T 2 温度/℃ d a c b CO 2转化率 图5 (3)在某温度T 1、压强P 1下,将一定量CO 2和H 2置于密闭容器中,发生反应CO 2(g)+3H 2(g) CH 3OH(g)+H 2O(g) ΔH 2;在t 时刻,测定容器中H 2气体的浓度。
浙江省高考化学选考实验制备大题 化学实验操作专练

(1)实验步骤:
先将适量TiO2、炭粉混合均匀,制成多孔状TiO2团粒。然后进行如下操作,正确的顺序为____________________(填序号)。
【解析】试题分析:(1).滴液漏斗内压强与三颈烧瓶中压强保持一致;冷凝管中的冷凝水应低进高出;(2)根据装置图回答仪器X的名称;反应生成的氯化氢易溶于水;(3) Na2CO3溶液与盐酸反应;碳酸钠可溶于水;(4)联苄的沸点是284℃;(5)120mL苯(密度0.88g/mL)的物质的量为120×0.88÷78=1.35mol,10.0mL 1,2-二氯乙烷的物质的量为10.0×1.27÷99=0.1283mol,根据苯、1,2-二氯乙烷为原料制备联苯的方程式可知,苯过量,根据1,2-二氯乙烷的物质的量计算联苄的理论产量;
(5)制备反应的主要化学方程式为_________________________________________。
(6)该装置存在明显的缺陷,提出改进措施__________________________________。
【答案】③①④②⑤增大反应物接触面a无水硫酸铜检验装置中的水蒸气是否除尽将生成的TiCl4气体完全排入冷凝管;防止冷却时,烧碱溶液或水蒸气倒吸入锥形瓶中N2冷凝管末端没有TiCl4液滴继续滴下TiO2+2C+2Cl2 TiCl4+2CO在装置末端c出口处,放一盏点燃的酒精灯
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_____________。为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是___________(填一种)。
浙江省普通高中2019学考选考(4月)化学试卷-答案

化学答案解析
1.【答案】C 【解析】 C2H5OH 属于醇, Na2CO3 属于盐, Ca(OH)2 属于碱, Cu2 (OH)2 CO3 属于碱式盐,故选
C。 【考点】物质的分类 2.【答案】A 【解析】硫酸钡是盐,属于强电解质;食盐水是混合物,既不是电解质也不是非电解质;二氧 化硅属于非电解质;醋酸是弱酸,属于弱电解质,故选A。 【考点】强电解质的概念 3.【答案】C 【解析】A项为萃取,B项为一定浓度溶液配制过程中的定容,C项为过滤,D项为一定浓度溶 液配制过程中的转移溶液,故选C。 【考点】实验操作 4.【答案】D 【解析】置换反应是指单质与化合物反应,生成另外一种单质和化合物的化学反应。D项中 Cl2
8.【答案】B 【解析】天然气的主要成分是甲烷,而甲烷水合物是可燃冰的主要成分,B项错误。 【考点】元素及其化合物的性质
9.【答案】C 【解析】蒸馏时加碎瓷片可以防止暴沸,A项正确;精密pH试纸可以精确到0.1,B项正确;由 于苯和四氯化碳相互溶解,且均不易溶于水,加水后液体分为两层,一层为水层,而另一层为
苯和四氯化碳的混合溶液,无法对苯和四氯化碳进行分离,C项错误;棉纤维的主要成分属于 糖类,燃烧时无气味,而蛋白质纤维燃烧时有烧焦羽毛的气味,故可根据燃烧产生的气味区分
两者,D项正确,故选C。 【考点】蒸馏时的防暴沸操作,精密pH试纸的使用,苯和四氯化碳的性质,糖类和蛋白质的鉴 别
10.【答案】B
【解析】同位素的研究对象为原子,而“ 18O2 和 16 O3 为单质,A项错误;正已烷和2,2-二甲基
不移动,正逆反应速率增大相同的倍数,A项错误;碳的质量不变,说明正、逆反应速率相等, 反应已达平衡状态,B项正确;恒温恒容条件下,若A、C同时为气体,当压强不变时,也能说 明反应达到平衡状态,C项错误;设 N2 (g) 3H2 (g) 2NH3(g) H a(a 0) kJ mol1 ,1 mol N2 ,
高中化学 微专题8 化学反应原理图像图表的分析与应用[针对30题]
![高中化学 微专题8 化学反应原理图像图表的分析与应用[针对30题]](https://img.taocdn.com/s3/m/24976304ad02de80d5d84034.png)
2016.10浙江选考T30(1)
往往还借助于图像、图 温度或压强的变化关系,作图也
2017.4浙江选考T30(2)
表、数据等表达化学信 是如此。运用图中曲线特征、
2017.11浙江选考T30
息,试题综合性强,难度较 规律,通过联想、迁移、应用三
2018.4浙江选考T30
大。
个步骤达到解题的目的
重难点一
图W8-4
图W8-5
[答案] (1)小于 由图可知,随着温度升高,K1增大,则ΔH1>0,根据盖斯定律又得ΔH3=ΔH1+ΔH2,所以ΔH2<ΔH3 (2)
[解析] (1)由图可知,随着温度的升高,K1 增大,K2、K3 减小,可知 ΔH1>0,ΔH2<0,ΔH3<0,由盖斯定律可知 ΔH1+ΔH2=ΔH3,可得 ΔH2<ΔH3。 (2)由 ΔH3<0,当温度降低时,反应会向着放热的反应方向移动,即向正反应方向 移动,c(CH3OH)会继续加大,但反应速率会降低,即其浓度随时间变化会较温度 改变前有所放缓,即曲线的斜率应偏小,并在某一时刻达到平衡。
W8-6 所示。下列说法正确的是
。
图W8-6
A.平衡常数大小:KM>KN B.其他条件不变,若不使用催化剂,则 250 ℃时 CO2 的平衡转化率可能位于点 M1 C.图中 M 点乙烯的体积分数为 7.7% D.当压强或 ������(H2) 不变时均可证明化学反应已达到平衡状态
������ (C O 2 )
此ppt下载后可自行编辑 高中化学课件
PART2
微专题8
针对30题
化学反应原理图像图表的分析与应用
三年真题
考向
解题关键
2022年1月浙江选考化学试题及答案

2022年1⽉浙江省选考化学试题可能⽤到的相对原⼦质量:H-1C-12N-14O-16Na-23Mg-24Al-27Si-28S-32Cl-35.5K-39Ca-40Mn-55Fe-56Cu-64Zn-65Ba-137⼀、选择题(本⼤题共25⼩题,每⼩题2分,共50分。
每⼩题列出的四个备选项中只有⼀个是符合题⽬要求的,不选、多选、错选均不得分)1.⽔溶液呈酸性的盐是A .NH 4ClB .BaCl 2C .H 2SO 4D .Ca(OH)22.下列物质属于⾮电解质的是A .CH 4B .KI C .NaOH D .CH 3COOH 3.名称为“⼲燥管”的仪器是A .BCD 4.下列物质对应的化学式不正确...的是A .氯仿:Ca(OH)2B .⻩铜矿的主要成分:Cu 2SC .芒硝:Na 2SO 4·10H 2OD .铝⼟矿的主要成分:Al 2O 35.下列表示不正确...的是A .⼄炔的结构简式HC ≡CHB .KOH 的电⼦式K +[:O ····:H]¯C .⼄烷的球棍模型:D .氯离⼦的结构示意图:88+1726.下列说法不正确...的是A .液化⽯油⽓是纯净物B .⼯业酒精中往往含有甲醇C .福尔⻢林是甲醛的⽔溶液D .许多⽔果和花卉有芳⾹⽓味是因为含有酯7.下列说法不正确...的是A .32S 和34S 互为同位素B .C 70和纳⽶碳管互为同素异形体C .CH 2ClCH 2Cl 和CH 3CHCl 2互为同分异构体D .C 3H 6和C 4H 8⼀定互为同系物8.下列说法不正确...的是A .镁合⾦密度较⼩、强度较⼤,可⽤于制造⻜机部件B .还原铁粉可⽤作⻝品⼲燥剂C .氯⽓、臭氧、⼆氧化氯都可⽤于饮⽤⽔的消毒D .油脂是热值最⾼的营养物质9.下列说法不正确...的是A .铁与碘反应易⽣成碘化铁B .电解ZnSO 4溶液可以得到ZnC .⽤⽯灰沉淀富镁海⽔中的Mg 2+,⽣成碳酸镁D .SO 2通⼊溶液中⽣成BaSO 3沉淀10.关于反应4CO 2+SiH 4====⾼温4CO+2H 2O+SiO 2,下列说法正确的是A.CO是氧化产物B.SiH4发⽣还原反应C.氧化剂与还原剂的物质的量之⽐为1∶4D.⽣成1molSiO2时,转移8mol电⼦11.下列说法不正确...的是A.灼烧法做“海带中碘元素的分离及检验”实验时,须将海带进⾏灰化B.⽤纸层析法分离铁离⼦和铜离⼦时,不能将滤纸条上的试样点浸⼊展开剂中C.将盛有苯酚与⽔形成的浊液的试管浸泡在80℃热⽔中⼀段时间,浊液变澄清D.不能将实验室⽤剩的⾦属钠块放回原试剂瓶12.设N A为阿伏加德罗常数的值,下列说法正确的是A.在25℃时,1LpH为12的Ba(OH)2溶液中含有OH−数⽬为0.01N AB.1.8g重⽔(D2O)中所含质⼦数为N AC.⾜量的浓盐酸与8.7gMnO2反应,转移电⼦的数⽬为0.4N AD.32g甲醇的分⼦中含有C—H键的数⽬为4N A13.下列实验对应的离⼦⽅程式不正确...的是A.将碳酸氢钙溶液与过量的澄清⽯灰⽔混合:HCO¯3+Ca2++OH−===Ca CO3↓+H2OB.将少量NO2通⼊NaOH溶液:2NO2+2OH−===N O¯3+NO¯2+H2OC.将少量SO2通⼊NaClO溶液:SO2+H2O+2ClO−===SO2¯3+2HClOD.向氨⽔中滴⼊少量硝酸银溶液:Ag++2NH3·H2O===Ag(NH3)+2+2H2O14.下列说法正确的是A.苯酚、⼄醇、硫酸铜、氢氧化钠和硫酸铵均能使蛋⽩质变性B.通过⽯油的常压分馏可获得⽯蜡等馏分,常压分馏过程为物理变化C.在分⼦筛固体酸催化下,苯与⼄烯发⽣取代反应获得苯⼄烯D.含氮量⾼的硝化纤维可作烈性炸药15.关于化合物,下列说法正确的是A.分⼦中⾄少有7个碳原⼦共直线B.分⼦中含有1个⼿性碳原⼦C.与酸或碱溶液反应都可⽣成盐D.不能使酸性KMnO4稀溶液褪⾊16.W、X、Y、Z为原⼦序数依次增⼤的短周期主族元素。
浙江化学学考选考易错知识点

浙江化学学考选考易错知识点1.无机化学(1)化学键的键长和键能:需要掌握不同类型键的键长和键能,例如金属键、离子键和共价键,以及在化学反应中如何改变键长和键能。
(2)锌和铝的还原性:由于锌在电位表上位于铝之上,所以锌的还原性比铝更强,容易被氧化剂氧化。
(3)酸碱中和反应:需要了解如何根据酸碱的化学计量关系进行计算,例如酸碱滴定中酸和碱的化学计量关系。
(4)非金属氧化物的性质:需要了解非金属氧化物和水的反应产物,例如二氧化硫和二氧化氮的反应。
(5)锂离子电池:需要了解锂离子电池的工作原理和构成,以及在充放电过程中的化学反应。
2.有机化学(1)脂肪族化合物:要掌握脂肪族化合物的命名规则和结构特点,例如烷烃、卤代烷和醇类化合物的命名。
(2)烯烃的加成反应:了解烯烃的加成反应机理,例如烯烃与卤素、氢氯酸和水的加成反应。
(3)酸碱性和氧化还原性:了解有机化合物的酸碱性和氧化还原性,例如醇类化合物的酸碱性和选择还原剂还原醛酮的反应条件。
(4)酯的酸酐反应:了解酯酸酐反应的机理和实际应用,例如酯酸酐反应制备有机酸的反应条件。
(5)多官能团化合物:要掌握多官能团化合物的命名和化学性质,例如醛酮和羧酸的化学反应和化学属性。
3.分析化学(1)pH值和酸碱指示剂:了解pH值的定义和计算方法,以及不同pH 值对应的溶液酸碱性。
同时,要了解常用酸碱指示剂的酸碱性范围和颜色变化。
(2)水中溶解氧的测定:要了解测定水中溶解氧的方法和原理,例如溶解度和气压的关系,并能计算氧的溶解度。
(3)化学计量关系:需要了解摩尔比、化学计量关系等概念,并能在化学计量问题中应用。
(4)工业生产中的化学分析:需要了解工业生产中的化学分析方法,例如酸碱滴定、气态分析等,并能应用于实际问题。
(5)质量分析的定性分析:需要掌握质量分析的定性分析方法和实验步骤,例如火焰试验、沉淀试验等。
以上只是选考化学中的部分易错知识点,希望对你复习有所帮助。
高考化学复习-《化学反应原理》专题训练 (2)
《化学反应原理》专题训练(下)一.选择题(西2)1.下列离子方程式书写不.正确..的是 A .Cl 2通入FeCl 2溶液中:Cl 2+Fe 2+=Fe 3++2Cl -B .Na 2CO 3溶液显碱性:CO 32-+ H 2O HCO 3-+ OH -C .Al 和NaOH 溶液反应:2Al+2OH -+2H 2O =2AlO 2-+3H 2↑D .少量SO 2通入氨水中:SO 2+2NH 3•H 2O =2NH 4++SO 32-+H 2O(西2)2.Li-SO 2电池具有输出功率高和低温性能好等特点。
其电解质是LiBr ,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li + 2SO 2 Li 2S 2O 4。
下列说法正确的是 A .该电池反应为可逆反应 B .放电时,Li +向负极移动C .充电时,阴极反应式为Li + + e -=LiD .该电池的电解质溶液可以换成LiBr 的水溶液(西2)3.25℃时,下列关于分别由等体积0.1 mol/L 的2种溶液混合而成溶液的说法中,不正确...的是 A .Ba(OH)2溶液与 Na 2SO 4溶液:pH =13B .醋酸与CH 3COONa 溶液:c (Na +)+c (H +)=c (CH 3COO -)+c (OH -)C .Na 2CO 3溶液与 NaOH 溶液:c (Na +)>c (CO 32-)>c (OH -)>c (H +)D .Na 2CO 3溶液与 NaHCO 3溶液:2c (Na +)=3c (CO 32-) + 3c (HCO 3-) + 3c (H 2CO 3)(海2)4.下图所示的实验装置不能够...达到实验目的的是(海2)5.下列叙述正确的是A .25 ℃时,MgCO 3饱和溶液中c (Mg 2+)=2.6×10-3 mol ·L -1,CaCO 3饱和溶液中c (Ca 2+)=5.3×10-5 mol ·L -1,向浓度均为0.1 mol ·L -1的MgCl 2和CaCl 2混合溶液中逐滴加入0.1 mol ·L -1 的Na 2CO 3溶液,首先生成CaCO 3沉淀B .向硫酸亚铁溶液中加入氯水,再加入KSCN 溶液,溶液变为红色,说明硫酸亚铁溶液中存在Fe 3+C .向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO 42-D .除去Cu 粉中混有的CuO ,可将混合物加入到稀硝酸中,充分反应后过滤、洗涤(海2)6.已知: H 2(g)+ 1/2O 2(g)=H 2O(l) ΔH = -285.8 kJ ·mol -1CH 4(g)+ 2O 2(g)=CO 2(g)+2H 2O(l) ΔH = -890.3 kJ ·mol -1现有H 2和CH 4的混合气体112 L (标准状况),使其完全燃烧生成CO 2(g)和H 2O(l),共放出热量3242.5 kJ ,则原混合气体中H 2合CH 4的物质的量之比是A .1∶1B .1∶3C .1∶4D .2∶ 3放电 充电 A .喷泉实验 B .实验室制乙烯C .酯化反应 D .铜锌原电池 浓NaOH溶液SO 2(海2)7.下列说法正确的是A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg + 6H+ + NO3-= 4Mg 2+ + NH4++ 3H2OB.25 ℃时,将20 mL 0.1 mol·L-1 H2SO4溶液和30 mL 0.15 mol·L-1 NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11C.将10 mL 0.1 mol·L-1 KAl(SO4)2溶液和10 mL 0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH) + 2c(H+) =c(CH3COO-)+ 2c(OH-)(东2)8.温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示。
浙江省化学《选考总复习》(练习)专题10 有机化学基础 第五单元 含解析
考点一依据特征结构、性质及现象推断1.根据试剂或特征现象推知官能团的种类(1)使溴水褪色,则表示该物质中可能含有“”或“—C≡C—”结构。
(2)使KMnO4(H+)溶液褪色,则该物质中可能含有“"、“—C≡C—”或“—CHO”等结构或为苯的同系物.(3)遇FeCl3溶液显紫色,或加入溴水出现白色沉淀,则该物质中含有酚羟基.(4)遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质。
(5)遇I2变蓝则该物质为淀粉.(6)加入新制Cu(OH)2悬浊液,加热煮沸有砖红色沉淀生成或加入银氨溶液加热有银镜生成,表示含有—CHO.(7)加入Na放出H2,表示含有—OH或—COOH。
(8)加入NaHCO3溶液产生气体,表示含有—COOH。
2.根据反应条件推断反应类型(1)在NaOH的水溶液中发生水解反应,可能是酯的水解反应也可能是卤代烃的水解反应。
(2)在NaOH的乙醇溶液中加热,发生卤代烃的消去反应。
(3)在浓H2SO4存在的条件下加热,可能发生醇的消去反应、酯化反应、成醚反应或硝化反应等.(4)能与溴水或溴的CCl4溶液反应,可能为烯烃、炔烃的加成反应.(5)能与H2在Ni作用下发生反应,则为烯烃、炔烃、芳香烃、醛、酮的加成反应或还原反应。
(6)在O2、Cu(或Ag)、加热(或CuO、加热)条件下,发生醇的氧化反应.(7)与O2或新制的Cu(OH)2悬浊液或银氨溶液反应,则该物质发生的是—CHO的氧化反应。
(如果连续两次出现O2,则为醇―→醛―→羧酸的过程)(8)在稀H2SO4加热条件下发生酯、低聚糖、多糖等的水解反应。
(9)在光照、X2(表示卤素单质)条件下发生烷基上的取代反应;在Fe 粉、X2条件下发生苯环上的取代反应。
3。
根据有机反应中定量关系进行推断(1)烃和卤素单质的取代:取代1 mol 氢原子,消耗1 mol 卤素单质(X2)。
(2)的加成:与H2、Br2、HCl、H2O等加成时按物质的量比1∶1加成。
2024年6月浙江省普通高校招生选考科目考试(化学)附试卷分析
2024年6月浙江省普通高校招生选考科目考试(化学)可能用到的相对原子质量:H—1B—11C—12N—14O—16Na—23Mg—24 Al—27S—32 P—31Cl—35.5K—39Ca—40Fe—56Cu—64 Br—80 Ag—108I—127Ba—137一、选择题(本大题共 16 小题,每小题 3 分,共 48 分。
每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)1.按物质组成分类,KAl(SO4)2·12H2O 属于A.酸B.碱C.盐D.混合物2.下列说法不正确的是A.Al(OH)3呈两性,不能用于治疗胃酸过多B.Na2O2能与 CO2反应产生 O2,可作供氧剂C.FeO有还原性,能被氧化成 Fe3O4D.HNO3见光易分解,应保存在棕色试剂瓶中3.下列表示不正确的是A.CO2的电子式:B.Cl2中共价键的电子云图:C.NH3的空间填充模型:D.3,3-二甲基戊烷的键线式:4.下列说法不正确的是A.装置①可用于铜与浓硫酸反应并检验气态产物B.图②标识表示易燃类物质C.装置③可用于制取并收集氨气D.装置④可用于从碘水中萃取碘5.化学与人类社会可持续发展息息相关。
下列说法不正确的是A.部分金属可在高温下用焦炭、一氧化碳、氢气等还原金属矿物得到B.煤的气化是通过物理变化将煤转化为可燃性气体的过程C.制作水果罐头时加入抗氧化剂维生素 C,可延长保质期D.加入混凝剂聚合氯化铝,可使污水中细小悬浮物聚集成大颗粒6.利用 CH3OH可将废水中的 N O3-转化为对环境无害的物质后排放。
反应原理为:H++ CH3OH+N O3- CO2 +X+H2O(未配平)。
下列说法正确的是A.X 表示 NO2B.可用 O3替换 CH3OHC.氧化剂与还原剂物质的量之比为 6 ∶5D.若生成标准状况下的 CO2气体 11.2 L,则反应转移的电子数为 2N A(N A表示阿伏加德罗常数的值)7.物质微观结构决定宏观性质,进而影响用途。
2020版化学浙江学考大一轮考点精讲复习讲义:考点5氧化还原反应方程式的配平及相关计算
考点5氧化还原反应方程式的配平及相关计算知识条目加试要求1。
氧化还原反应中电子转移的方向和数目c2.氧化还原反应方程式的配平c一、氧化还原反应方程式的配平方法1.一般氧化还原反应方程式的配平——化合价升降法发生化合价变化的元素只有两种,而且属于不同的反应物,这样的氧化还原反应的配平,首先从反应物开始,根据化合价升降的总数相等先找出氧化剂和还原剂的化学计量数,然后配出氧化产物和还原产物的化学计量数,进而配出其他物质的化学计量数。
如下面的化合价升降法的配平。
①标好价:写出反应物、生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
错误!+H错误!O3——错误!O2↑+错误!O2↑+2H2O②找变化:找出反应前后元素化合价的变化。
③求总数:使化合价升高和降低的总数相等。
④配系数:依据质量守恒,用观察的方法配出其他物质的化学计量数,配平后,把短线改成等号,即得C+4HNO3===CO2↑+4NO2↑+2H2O。
2.逆向配平法:部分氧化还原反应、自身氧化还原反应、歧化反应一般从右边着手配平,即从氧化产物和还原产物开始配平。
例如:S+KOH―→K2S+K2SO3+H2O即得S+6KOH===2K2S+K2SO3+3H2O。
3.缺项配平法:对于“氧化还原反应方程式缺项配平法”都是先确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,再通过比较反应物与生成物,确定缺项(一般为H2O,H+或OH-),最后观察配平。
例如:实验室可由软锰矿(主要成分为MnO2)制备KMnO4。
方法如下,软锰矿与过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl……按照题意可写出如下方程式:MnO2+KOH+KClO3―→K2MnO4+KCl+________配平含变价元素的物质得3MnO2+6KOH+KClO3―→3K2MnO4+KCl根据元素守恒比较反应物和生成物可知左边比右边多O:15-12=3,左边比右边多H:6-0=0,肯定在生成物中有水,且化学计量数为3,即得3MnO2+6KOH+KClO3===3K2MnO4+KCl+3H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
30.化学反应原理1.(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图1所示。
(1) 收集到(CH3)4NOH的区域是 (填a、b、c或d)。
(2) 写出电池总反应。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) CH3COOC2H5(l)+H2O(l) ΔH=-2.7 kJ·mol-1已知纯物质和相关恒沸混合物的常压沸点如下表:纯物质沸点/℃恒沸混合物(质量分数)沸点/℃乙醇78.3 乙酸乙酯(0.92)+水(0.08) 70.4乙酸117.9 乙酸乙酯(0.69)+乙醇(0.31) 71.8乙酸乙酯77.1 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) 70.2请完成:(1) 关于该反应,下列说法不合理...的是。
A.反应体系中硫酸有催化作用B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零C.因为反应的△H接近于零,所以温度变化对平衡转化率的影响大D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计(2) 一定温度下该反应的平衡常数K=4.0。
若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y=;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图2中绘制x随n变化的示意图(计算时不计副反应)。
(3) 工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。
控制乙酸过量的作用有。
(4) 近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g)CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图3所示。
关于该方法,下列推测合理的是。
A.反应温度不宜超过300℃B.增大体系压强,有利于提高乙醇平衡转化率C.在催化剂作用下,乙醛是反应历程中的中间产物D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键2.(一) 十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。
已知:C10H18(l)C10H12(l)+3H2(g) △H1,C10H12(l)C10H8(l)+2H2(g) △H2△H1>△H2>0;C10H18→C10H12的活化能为E a1,C10H12→C10H8的活化能为E a2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。
请回答:(1) 有利于提高上述反应平衡转化率的条件是。
A.高温高压B.低温低压C.高温低压D.低温高压(2) 研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显着释氢,理由是。
(3) 温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。
①在8 h时,反应体系内氢气的量为 mol(忽略其他副反应)。
②x1显着低于x2的原因是。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图...。
(二) 科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。
阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:和2Fe+3H2O+N2=2NH3+Fe2O3。
3.以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。
电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
请回答:(1) 已知:2Al2O3(s)= 4Al(g) +3O2(g) ΔH1=3351 kJ·molˉ12C(s)+O2(g)= 2CO(g) ΔH2=-221 kJ·molˉ1 2Al(g)+N2(g)= 2AlN(s) ΔH3=-318 kJ·molˉ1碳热还原Al2O3合成AlN的总热化学方程式是,该反应自发进行的条件。
(2) 在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2O(g)ΔH4,反应Ⅱ.CO2(g)+H2(g)CO(g)+H2O(g)ΔH5①下列说法不正确...的是。
A.△H4小于零B.温度可影响产物的选择性C.CO2平衡转化率随温度升高先增大后减少D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率② 350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为(用a、V表示)③ 350℃下CH4物质的量随时间的变化曲线如图3所示。
画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。
(3) 据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是。
4.氯及其化合物在生活和生产中应用广泛。
(1) 已知:900 K时,4HCl(g)+O2(g)2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由。
②900 K时,体积比为4 :l的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图。
保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×l05~4.5×105 Pa范围内,HCl的平衡转化率α(HCl) 随压强(P)变化曲线示意图。
(2) 已知:Cl2(g) + 2NaOH(aq) =NaCl(aq) + NaClO(aq) + H2O(l) △H l = -102 kJ·molˉ13Cl2(g) + 6NaOH(aq) = 5NaCl(aq) + NaClO3(aq) + 3H2O(1) △H2 = -422 kJ·molˉ1①写出在溶液中NaClO分解生成NaClO3的热化学方程式: 。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClOˉ的浓度为c0 mol·Lˉ1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClOˉ浓度为c t mol·Lˉ1,写出该时刻溶液中Clˉ浓度的表达式;c(Clˉ)= mol·L-1 (用c0、c t表示)。
③有研究表明,生成NaClO3的反应分两步进行:I. 2ClOˉ = ClO2ˉ+ Clˉ II. ClO2ˉ + ClOˉ = ClO3ˉ+ Clˉ常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:。
(3)电解NaClO3水溶液可制备NaClO4。
在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。
为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式。
5.氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用。
(1) 以Fe为催化剂,0.6 mol氮气和1.8 mol氢气在恒温、容积恒定为1 L的密闭容器中反应生成氨气,20 min后达到平衡,氮气的物质的量为0.3 mol。
①在第25min时,保持温度不变,将容器体积迅速增大至2 L并保持恒容,体系达到平衡时N2的总转化率为38.2%。
请画出从第25min起H2的物质的量浓度随时间变化的曲线。
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是(填增大、减少或不变)。
(2) ①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式。
②N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1 N2H4水溶液的pH等于(忽略N2H4的二级电离和H2O的电离)。
③已知298K和101kPa条件下:N2(g) + 3H2(g)=2NH3(g) ΔH1, 2H2(g) + O2(g)=2H2O(l) ΔH2,2H2(g) + O2(g)=2H2O(g) ΔH3, 4NH3(g) + O2(g)=2N2H4(l) + 2H2O(l) ΔH4则N2H4(l)的标准燃烧热ΔH=。
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸。
实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释。
6.由某精矿石(MCO3·ZCO3)可以制备单质M,制备过程中排放出的二氧化碳可以作为原料制备甲醇,取该矿石样品1.84g,高温灼烧至恒重,得到0.96g仅含两种金属氧化物的固体,其中m(M)︰m(Z) =3︰5,请回答:(1) 该矿石的化学式为。
(2) ①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2︰1)。
写出该反应的化学方程式。
②单质M还可以通过电解熔融MCl2得到。
不能用电解MCl2溶液的方法制备M的理由是。
(3) 一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1反应2:CO(g)+2H2(g)CH3OH(g) △H2反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图1所示。
则△H2 △H3(填“大于”、“小于”或“等于”),理由是。
(4) 在温度T1时,使体积比为3︰1的H2和CO2在体积恒定的密闭容器内进行反应。
T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。
试在图2中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线。
7.(1) 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得。
实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75 : 2);②在碳存在下,X与N2反应生成AlN。
