2018年湖北黄冈中学自主招生化学试题2(无答案)
2018年湖北黄冈中学自主招生化学试题2(无答案)

黄冈中学自主招生化学试题2时间:40分钟分值:50分可能用到的相对原子质量:H :1,C :12,N :14,O :16,S :32,K :39,Ca :40,Fe :56 一、单项选择题(每小题2分,共8小题,共16分)1.以下是我们熟悉的几种气体,其中可用右图所示装置干燥并收集的是(省略了铁架台等仪器) :( ) ①H 2 ②O 2 ③CO 2 ④SO 2 ⑤CH 4 A .①② B .③④ C .①⑤ D .①②⑤2.某同学用含有杂质碳酸钠的烧碱样品与盐酸发生中和反应,那么与等质量等溶质质量分数的盐酸溶液恰好中和时,所用烧碱样品质量比用纯氢氧化钠的质量( ) A .偏高 B .偏低 C .不变 D .无法比较3.有A 、B 两种混合粉末,质量分别为m 1,m 2。
A 由CaCO 3和KHCO 3组成,B 由MgCO 3和NaHCO 3组成。
将A 、B 分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg 。
下列说法正确的是( ) (已知:KHCO 3+HCl=KCl+CO 2↑+H 2O NaHCO 3+HCl=NaCl + CO 2↑+ H 2O ) A .100m 1 = 84m 2 B .m 1 = m 2C .混合物B 中MgCO 3和NaHCO 3质量比可为任意比D .混合物A 中CaCO 3和KHCO 3质量比一定为1∶1 4.取一定量氧化铁与氧化铜的混合物,向其中加入50克、14.6%的稀盐酸,恰好完全反应生成盐和水,则原混合物中氧元素的质量是( ) A.6.4克B.3.2克 C .1.6克 D .0.8克5.已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高.海洋中有丰富的资源,如图所示利用海水可获得许多化工产品。
下列有关说法正确的是( )A .第①步中除去粗盐中的SO 42﹣、Ca 2+、Mg 2+等杂质,加入的试剂顺序为:Na 2CO 3溶液、NaOH溶液、BaCl 2溶液,过滤后加盐酸B .第②步中加入的试剂为CaCl 2溶液C .第③步中发生分解反应D .在第④步中溴元素被还原6.把5.1g 镁和铝的合金加入到一定质量、一定质量分数的稀硫酸中,恰好完全反应,产生的0.5gH 2,向反应后的溶液中加入一定量的NaOH 溶液,恰好使上述溶液中的MgSO 4、Al 2(SO 4)3完全转化为沉淀,则同时生成的Na 2SO 4的质量为( )A .32.5gB .35.5gC .40.5gD .45.5g7.为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如下图所示的实验。
湖北省黄冈中学化学自主招生试卷
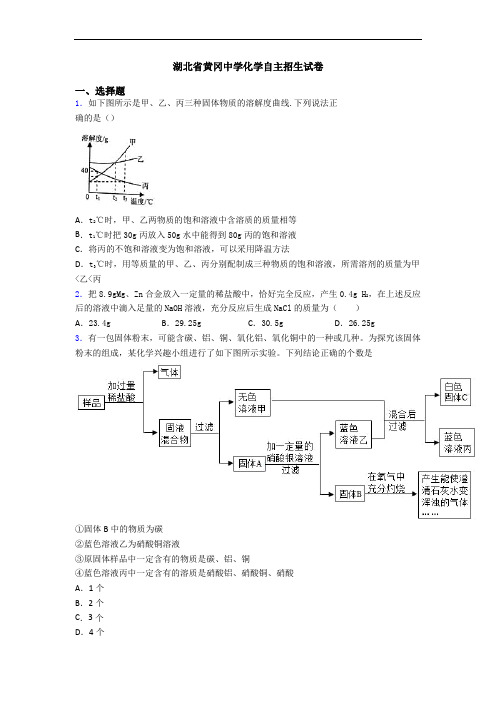
湖北省黄冈中学化学自主招生试卷一、选择题1.如下图所示是甲、乙、丙三种固体物质的溶解度曲线.下列说法正确的是()A.t2℃时,甲、乙两物质的饱和溶液中含溶质的质量相等B.t1℃时把30g丙放入50g水中能得到80g丙的饱和溶液C.将丙的不饱和溶液变为饱和溶液,可以采用降温方法D.t3℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙2.把8.9gMg、Zn合金放入一定量的稀盐酸中,恰好完全反应,产生0.4g H2,在上述反应后的溶液中滴入足量的NaOH溶液,充分反应后生成NaCl的质量为()A.23.4g B.29.25g C.30.5g D.26.25g3.有一包固体粉末,可能含碳、铝、铜、氧化铝、氧化铜中的一种或几种。
为探究该固体粉末的组成,某化学兴趣小组进行了如下图所示实验。
下列结论正确的个数是①固体B中的物质为碳②蓝色溶液乙为硝酸铜溶液③原固体样品中一定含有的物质是碳、铝、铜④蓝色溶液丙中一定含有的溶质是硝酸铝、硝酸铜、硝酸A.1个B.2个C.3个D.4个4.如图所示,其中甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钙、二氧化碳、碳酸钠中的一种.图中相连的两圆表示相应物质能发生反应,已知乙是铁.下列说法错误的是A.五种物质中,只有铁是单质B.丙是盐酸C.戊是氢氧化钙D.甲与丁反应属于复分解反应5.除去下列各组物质括号内的杂质,所选用的试剂及操作方法均正确的是A.Fe2O3(Fe)——用盐酸浸泡,然后过滤、洗涤、烘干B.CO(CO2)——先通入足量的浓NaOH溶液,后通过浓硫酸C.CaO(CaCO3)——加水溶解,过滤、烘干D.NaCl(Na2CO3)——加入过量CaCl2溶液,过滤、蒸发、结晶6.用数形结合的方法表示某些化学知识直观、简明、易记.下列用数轴表示正确的是()A.不同物质的着火点:B.硫及其化合物与化合价的关系:C.50g19.6%的稀硫酸与足量的金属反应产生氢气的质量:D.物质形成溶液的pH:7.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。
2016—2018年湖北省黄冈中学自主招生化学汇编:工业流程(含详细解析)

2016_2018湖北省黄冈中学自主招生化学汇编:工业流程(含详细解析)一.填空题(共4小题)1.(2018•黄州区校级自主招生)为防止大气污染,工业上产生的硫化氢(H2S)要经过处理,使其变成硫单质.富玛克斯法治理硫化氢的方法和步骤如下:①用2%~3%的Na2CO3溶液作吸收剂生成两种酸式盐,其中一种为NaHS;②再加入一种RNO(液)(R表示一种有机基团)与生成的这种酸式盐的水溶液反应生成硫、碱和RNHOH;③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;④RNHOH与空气中的氧发生反应又得到RNO.(1)写出上述四步反应的化学方程式.①H2S+Na2CO3=NaHCO3+NaHS;②NaHS+RNO+H2O=S↓+NaOH+RNHOH;③NaOH+NaHCO3=Na2CO3+H2O;④2RNHOH+O2=2RNO+2H2O.(2)富玛克斯法的总反应的化学方程式为:2H2S+O22S↓+2H2O,RNO在整个过程中起到催化的作用.【解答】解:(1)根据信息Na2CO3和H2S反应两种酸式盐,其中一种是NaHS,则另一种为NaHCO3,化学方程式为H2S+Na2CO3=NaHCO3+NaHS;(2)由信息可知该反应的反应物为NaHS和RNO和H2O,生成物为S和NaOH和RNHOH,化学方程式为NaHS+RNO+H2O=S↓+NaOH+RNHOH;(3)第三步反应的反应物为NaOH和NaHCO3;生成物为Na2CO3和H2O化学方程式为NaOH+Na HCO3=Na2CO3+H2O;(4)RNHOH与空气中的氧发生反应又得到RNO,反应物为RNHOH和O2,生成物为RNO和H2O,化学方程式为2RNHOH+O2=2RNO+2H2O(5)由以上四个化学方程式叠加,左右两边相同的删除,可得出总反应式为2H2S+O2=2S↓+2H2O,RNO在整个过程中起到催化作用.故答案为:(1)H2S+Na2CO3=NaHCO3+NaHS;(2)NaHS+RNO+H2O=S↓+NaOH+RNHOH;(3)NaOH+NaHCO3=Na2CO3+H2O;(4)2RNHOH+O2=2RNO+2H2O;(5)2H2S+O22S↓+2H2O;催化2.(2014•黄冈)以氯化钾和硫酸亚铁为原料生产硫酸钾和氧化铁(铁红颜料),其主要流程如下,请认真观察工艺流程,回答下列问题:(1)铁红的化学式是Fe2O3;(2)FeSO4与NH4HCO3反应生成FeCO3、(NH4)2SO4、H2O和CO2,其反应的化学方程式是FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑;(3)硫酸酸化是为了除去过量的NH4HCO3,反应后逸出的气体是二氧化碳;(4)沉淀池Ⅱ中溶质有KCl、K2SO4、H2SO4,还含有(NH4)2SO4.【解答】解:(1)铁红是氧化铁,氧化铁中铁元素的化合价为+3,氧元素的化合价为﹣2,化学式为:Fe2O3;(2)FeSO4与NH4HCO3反应生成FeCO3、(NH4)2SO4、H2O和CO2,反应的化学方程式为:FeSO4+2NH4HCO3=FeCO3+(NH4)2SO4+H2O+CO2↑;(3)加入酸,酸化的目的是除去溶液中的HCO3﹣,硫酸和NH4HCO3反应生成二氧化碳,故反应后逸出的气体是二氧化碳;(4)由(2)(3)可知沉淀池Ⅱ中溶质有KCl、K2SO4、H2SO4,还含有生成的(NH4)2SO 4.答案:(1)Fe 2O 3;(2)FeSO 4+2NH 4HCO 3=FeCO 3↓+(NH 4)2SO 4+H 2O+CO 2↑;(3)二氧化碳;(4)(NH 4)2SO 4.3.(2016•黄州区校级自主招生)硅单质及其合物应用范围很广.请回答下列问题:(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl 3)还原法是当前制备高纯硅的主要方法.生产过程示意图如图:①写出由纯SiHCl 3,制备高纯硅的化学反应方程式 SiHCl 3+H 2高温 Si+3HCl .②整个制备过程必须严格控制无水无氧.SiHCl 3遇水剧烈反应生成H 2SiO 3,HCl 和另一种物质,写出配平的化学反应方程式 SiHCl 3+3H 2O ═H 2SiO 3↓+H 2↑+3HCl ;H 2还原SiHCl 3过程过程中若混入O 2,可能引起的后果是 爆炸 .(2)石英砂的主要成分是二氧化硅,高纯度的二氧化硅可用于制造高性能通讯材料﹣光导纤维.二氧化硅和二氧化碳一样,也能与氢氧化钠溶液生成硅酸钠9其水溶液称水玻璃和水.请写出二氧化硅与氢氧化钠溶液的化学方程式 2NaOH+SiO 2=Na 2SiO 3+H 2O .【解答】解:(1)①SiHCl 3,能与氢气高温反应生成硅和氯化氢气体,故填:SiHCl 3+H 2高温 Si+3HCl ;②SiHCl 3与水反应生成H 2SiO 3,HCl 和氢气,H 2还原SiHCl 3过程过程中若混入O 2,可能引起爆炸,故填:SiHCl 3+3H 2O ═H 2SiO 3↓+H 2↑+3HCl ,爆炸;(2)氢氧化钠能与二氧化硅反应生成硅酸钠和水,故填:2NaOH+SiO 2=Na 2SiO 3+H 2O .4.(2016•黄冈校级自主招生)肼(N 2H 4)是氮和氢形成的一种化合物,易溶于水.工业上利用尿素法生产肼,同时得到出副产品十水合碳酸钠,其工艺流程如下:制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH═N2H4+Na2CO3+NaCl+H2O.(1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有BD(填编号).A.漏斗B.烧杯C.烧瓶D.量筒(2)已知:Cl2+H2O═HCl+HClO,请推测Cl2与NaOH溶液发生反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71:160.(3)在实验室中,欲从母液中分离出十水合碳酸钠晶体.可采用的操作依次为BED (填编号).A.蒸馏B.蒸发C.灼烧D.过滤E.冷却结晶(4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等.请写出肼除氧时发生反应的化学方程式:N2H4+O2=N2+2H2O.【解答】解:(1)配制溶液需要在烧杯内进行,需要用量筒量取水,用玻璃棒搅拌,还用到胶头滴管,所以选择:BD;(2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80,再根据方程式:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O,可知还需要氢氧化钠两份质量,所以液氯与烧碱的质量之比为71:160;(3)碳酸钠的溶解度随温度变化比较大从溶液中结晶析出的方法:冷却热饱和溶液的方法,所以先将溶液加热蒸发,再降温,使晶体析出,再进行过滤,所以步骤为:BED;(4)肼除氧的反应物是肼和氧气,因为氧化产物无污染所以是氢和氧结合成的水,根据质量守恒定律可知生成物还有氮气,再根据观察法配平,所以化学方程式是:N2H4+O2=N 2+2H 2O .故答案为:(1)BD ;(2)Cl 2+2NaOH =NaCl+NaClO+H 2O ,160;(3)BED ;(4)N 2H 4+O 2=N 2+2H 2O .二.解答题(共9小题)5.(2017•黄州区校级自主招生)醋酸钙[Ca (Ac )2]是国家允许使用的补钙制剂之一。
2018年湖北省黄冈市中考真题化学试题(答案+解析)

2018年湖北省黄冈市中考真题可能用到的相对原子质量:H-1 C-12 O-16 C1-35.5 Ca-40一、选择题(每小题只有一个选项符合题意。
每小题2分,共16分)1.下列四个事例中一定发生了化学变化的是()①玻璃片上出现水珠②大理石投入到稀盐酸中③自制汽水④品红在水中扩散A. ①②B. ②③C. ③④D. ①④【答案】B【解析】①玻璃片上出现水珠,没有生成新物质,属于物理变化;②大理石投入到稀盐酸中,生成二氧化碳、水等新物质,属于化学变化;③自制汽水,小苏打和柠檬酸反应生成二氧化碳等新物质,属于化学变化;④品红在水中扩散,没有生成新物质,属于物理变化;只有②③属于化学变化。
故选B。
2.下列实验操作错误的是()A. 滴加液体B. 点燃酒精灯C. 称量反应物质量D. 稀释浓硫酸【答案】D【解析】A、滴加液体时,滴管要悬空垂直放在试管口上方,正确;B、用火柴引燃酒精灯,正确;C、用托盘天平称量时,应遵循“左物右码”,正确;D、稀释浓硫酸沿器壁导入水中,错误。
故选D。
3.下列说法:①二氧化硫和臭氧都是空气污染物;②洁净的空气和水都是纯净物;③因为水体有自净能力,所以生活污水可任意排放;④降低可燃物的着火点是灭火的途径之一;⑤烧碱和熟石灰的溶液都显碱性;⑥复合肥中一定要含有氮、磷、钾三种元素;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有机化合物。
其中正确的是()A. ①⑤⑦ B. ①②④⑥ C. ④⑤⑦ D. ①②⑤⑥【答案】A【解析】①二氧化硫和臭氧都是空气污染物,故正确;②水是由一种分子构成的,属于纯净物,故错误;③生活污水可任意排放,会导致水体受到污染,故错误;④可燃物的着火点是物质的性质,不能降低,故错误;⑤烧碱和熟石灰都属于碱,溶液都显碱性,故正确;⑥复合肥中一定要含有氮、磷、钾三种元素中任两种元素,故错误;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有机化合物,故正确;只有①⑤⑦正确。
2018年湖北省黄冈市试中考理综化学真题及参考解析

湖北省黄冈市二○一八年初中学业考试暨高中阶段统一招生考试理综(化学部分)试题注意事项:1.答题前,考生务必先核对条形码上的姓名、准考证号和座号,然后用0.5毫米黑色墨水签字笔将本人的姓名、准考证号和座号填写在答题卡相应位置。
2.答第Ⅰ卷时,必须使用2B铅笔填涂答题卡上相应题目的答案标号,如需改动,必须先用橡皮擦干净,再改涂其它答案。
3.答第Ⅱ卷时,必须使用0.5毫米黑色墨水签字笔在答题卡上书写。
务必在题号所指示的答题区域内作答。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 C1-35.5 Ca-40五、选择题(每小题只有一个选项符合题意。
每小题2分,共16分)18、下列四个事例中一定发生了化学变化的是①玻璃片上出现水珠②大理石投入到稀盐酸中③自制汽水④品红在水中扩散A.①②B.②③C.③④D.①④19、下列实验操作错误的是A.滴加液体B.点燃酒精灯C.称量反应物质量D.稀释浓硫酸20、下列说法:①二氧化硫和臭氧都是空气污染物;②洁净的空气和水都是纯净物;③因为水体有自净能力,所以生活污水可任意排放;④降低可燃物的着火点是灭火的途径之一;⑤烧碱和熟石灰的溶液都显碱性;⑥复合肥中一定要含有氮、磷、钾三种元素;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有机化合物。
其中正确的是A.①⑤⑦B.①②④⑥C.④⑤⑦D.①②⑤⑥21、小雨同学依据描述书写的化学符号:①3个锌原子;3Z N;②两个氢分子:2H2;③两个氢氧根离子:2OH-;④原子结构示意图对应的粒子:Mg2+;⑤氯化亚铁的化学式:FeCl2;⑥-2价的氧元素:O2-。
其中正确的有A.②③⑤B.①⑤⑥C.②③④D.①③⑤22、一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。
下列说法中,不正确的是A.x的值等于0.5B.甲一定是化合物C.丙和丁的质量变化比为8:1D.该反应是化合反应23、金属钨(W)可做白炽灯泡的灯丝。
湖北黄冈中学自主招生考试化学模拟试题

2018年预录模拟考试化学试题(五)相对原子质量H:1 C:12 N:14 O:16 Mg:24 S:32 Cu:64 Cl:35.5 Ag:108 Ba:137 一、选择题(本题包括9个小题,每小题有1个或2个选项符合题意,共18分。
) 1.下列各组内的物质充分反应后过滤 , 所得溶液的质量与反应前溶液的质量相比,一定减少的是 A. 铜加入到硝酸银溶液中 B. 铝加入到稀硫酸中C.二氧化碳通入到石灰水中D. 碳酸钠固体加入到稀盐酸中 2.根据下表物质的命名规律,可将K 2CS 3应命名为名称 硫代硫酸钠 多硫化钙 过氧化钡 超氧化钾化学式Na 2S 2O 3 CaS x BaO 2 KO 2 A .三硫代碳酸钾 B .多硫碳酸钾 C .过硫碳酸钾 D .超硫碳酸钾3.工业品盐酸中因含有Fe 3+而带黄色,若某工业品盐酸中的H +和Cl -的个数比为91:94,则该盐酸中Fe 3+和Cl -的个数比为A .1:1B .1:3C .91:94D .1:944、如右图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体 积对气球体积的影响)。
则滴管和烧瓶中所用试剂可能是5.某溶液中存在Mg 2+、Ag +、Ba 2+三种金属离子,现用NaOH 、Na 2CO 3、NaCl 三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液滤出一种沉淀,所加溶液顺序正确的是A 、Na 2CO 3 NaCl NaOHB 、NaOH NaCl Na 2CO 3C 、NaCl NaOH Na 2CO 3D 、NaCl Na 2CO 3 NaOH 6.根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:该方案的主要目的是为了制备A .HBrB .CaOC .H 2 D. Hg7.新型纳米材料MFe 2O x 中M 表示+2价的金属元素,在反应中化合价不发生变化。
湖北省黄石二中自主招生考试试题2018年素质考核化学试卷和答案(word版)

湖北省黄石二中自主招生考试试题2018年素质考核化学试卷和答案(word版)2018 年化学试卷可能用到的相对原子质量:H:1 C:12 O:16 Na:23 P:31 S:32 K:39 Ti:48 一、选择题(本题共5 小题,每小题8 分,共40 分。
每小题只有一个选项符合题目要求。
)1.中国科技大学钱逸泰教授以CCl4和金属钠为原料,700℃时制造出纳米级金刚石粉末,该成果发表在世界权威的《科学》杂志上,立即被科学家评价为“稻草变黄金”。
同学们对此的一些“理解”,不正确的是()A.CCl4是一种化合物B.制造过程中元素种类没有变化C.金刚石属于金属单质D.这个反应是置换反应2.工业上用海水晒盐,使食盐晶体析出。
这样制得的食盐含有较多的杂质,叫做粗盐。
要除去粗盐中含有的可溶性杂质CaCl2、MgCl2及Na2SO4,加入的化学试①HCl②NaOH③Na2CO3④BaCl2先后顺序正确的是()A.①②④③B.④②①③C.②①③④D.④②③①3.为完全中和某一强酸溶液,需用10 克溶质的质量分数为4%的NaOH 溶液。
如果改用10 克溶质的质量分数为4%的KOH 溶液,反应后,溶液的pH()A.大于7 B.小于7 C.等于7 D.无法判断4.现有10.6g 碳酸钠和8.4g 碳酸氢钠,分别与过量的盐酸反应,其中()A.碳酸钠消耗的氯化氢多B.碳酸钠生成的二氧化碳多C.碳酸氢钠消耗的氯化氢多D.碳酸氢钠生成的二氧化碳多5.右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。
现有142g 温度为T2 K 的饱和硫酸钠溶液,当温度降为T1 K 或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K 时Na2SO4的溶解度为( )。
A.30g B.32.8g C.40g D.40.8g二、填空题(本题包括 6、7、8、9、10 五道题,共 60 分)6.(12分)I.右图中 A、B、C、D、E 是初中化学常见的五种不同类别的物质。
黄冈中学自主招生化学汇编:实验题(含详细解析).doc

黄冈中学自主招生化学汇编:实验题(含详
细解析)
一.解答题(共11小题)
1.(2018•黄州区校级自主招生)在焊接两根铁轨时,为确保施工质量,工程技术人员常用到一种叫做“引火铁”的反应活性材料.实验室的制备过程如下:
(1)在高温条件下用普通铁粉和水蒸气反应,得到粉末状的四氧化三铁;
(2)将四氧化三铁粉末在高温条件下经过与上述过程相反的反应生成“引火铁”粉末.请分别用以下两套装置,制取四氧化三铁和“引火铁”.实验中必须使用普通铁粉和稀硫酸,其他试剂和用品自选.(注:装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 / 2
黄冈中学自主招生化学试题2
时间:40分钟 分值:50分
可能用到的相对原子质量:H :1,C :12,N :14,O :16,S :32,K :39,Ca :40,Fe :56 一、单项选择题(每小题2分,共8小题,共16分)
1.以下是我们熟悉的几种气体,其中可用右图所示装置干燥并收集的是(省略了铁架台等仪器) :( ) ①H 2 ②O 2 ③CO 2 ④SO 2 ⑤CH 4
A .①②
B .③④
C .①⑤
D .①②⑤
2.某同学用含有杂质碳酸钠的烧碱样品与盐酸发生中和反应,那么与等质量等溶质质量分数的盐酸溶液恰好中和时,所用烧碱样品质量比用纯氢氧化钠的质量( ) A .偏高 B .偏低 C .不变 D .无法比较
3.有A 、B 两种混合粉末,质量分别为m 1,m 2。
A 由CaCO 3和KHCO 3组成,B 由MgCO 3和NaHCO 3组成。
将A 、B 分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg 。
下列说法正确的是( ) (已知:KHCO 3+HCl=KCl+CO 2↑+H 2O NaHCO 3+HCl=NaCl + CO 2↑+ H 2O ) A .100m 1 = 84m 2 B .m 1 = m 2
C .混合物B 中MgCO 3和NaHCO 3质量比可为任意比
D .混合物A 中CaCO 3和KHCO 3质量比一定为1∶1 4.取一定量氧化铁与氧化铜的混合物,向其中加入50克、14.6%的稀盐酸,恰好完全反应生成盐和水,则原混合物中氧元素的质量是( )
A.6.4克
B.3.2克 C . 1.6克 D .0.8克
5.已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高.海洋中有丰富的资源,如图所示利用海水可获得许多化工产品。
下列有关说法正确的是( )
A .第①步中除去粗盐中的
SO 42﹣、Ca 2+、Mg 2+
等杂质,加入的试剂顺序为:Na 2CO 3溶液、NaOH
溶液、BaCl 2溶液,过滤后加盐酸
B .第②步中加入的试剂为CaCl 2溶液
C .第③步中发生分解反应
D .在第④步中溴元素被还原 6.把5.1g 镁和铝的合金加入到一定质量、一定质量分数的稀硫酸中,恰好完全反应,产生的0.5gH 2,向反应后的溶液中加入一定量的NaOH 溶液,恰好使上述溶液中的MgSO 4、Al 2(SO 4)3完全转化为沉淀,则同时生成的Na 2SO 4的质量为( )
A .32.5g
B .35.5g
C .40.5g
D .45.5g
7. 为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如下图所示的实验。
下列分析和结论正确的是( )
A .若II 、III 均有明显现象,则说明样品一定完全变质
B .若D 为白色固体,则溶液A 是Na 2CO 3溶液
C .若
D 为气体,则加入甲溶液的目的是证明样品已变质
D .若D 为白色固体、且溶液C 为红色,则样品一定是部分变质 8.向一定质量CaCl 2和HCl 的混合溶液中逐滴加入溶质质量分数为10.0%的 Na 2CO 3溶液.反应过程中加入的Na 2CO 3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( ) A .图中0a 段表示生成沉淀的过程 B .b 点溶液中溶质有2种 C .c 点溶液的pH=7 D .x 值为106.0 选择题答题卡:每小题2分,共16分
9.(4分)(1)用氨水(NH 3·H 2O)中和废水中的硫酸,并得到一种氮肥[(NH 4)2SO 4]。
其反应方程式为 。
(2)有一种技术可将糖[通式为C a (H 2O)b ]发酵进行无氧分解,生成两种化合物,其中一种物质是沼气的主要成分。
写出糖发酵进行无氧分解的化学方程式: 。
(3)CaCl 2溶液和NaHCO 3溶液反应生成CaCO 3沉淀。
为表示这个反应写出了下列两个反应方程式: CaCl 2 + NaHCO 3 == CaCO 3↓+ NaCl + HCl CaCl 2 + 2 NaHCO 3 == CaCO 3↓+ 2 NaCl + CO 2↑+ H 2O 你认为哪一个反应的化学方程式不合理,并简述理由。
(4)已知难溶的物质在一定条件下可转化成更难溶的物质。
将白色Mg(OH)2加到FeCl 3溶液中有红棕色沉淀生成。
请写出反应的化学方程式,并简述理由。
2 / 2
11.(4分)甲、乙、丙是三种单质,A 、B 、C 是三种化合物,它们之间有下列转化关系:
(1)用化学式表示下列物质:丙 ;B 。
(2)A 可能是 。
溶液反应后的溶液呈浅绿色,则甲为 。
13.(4分)为防止大气污染,工业上产生的硫化氢(H 2S )要经过处理,使其变成硫单质。
富玛克斯法治理硫化氢的方法和步骤如下:
①用2%~3%的Na 2CO 3溶液作吸收剂生成两种酸式盐,其中一种为NaHS ; ②再加入一种RNO (液)(R 表示一种有机基团)与生成的这种酸式盐(NaHS )的水溶液反应生成硫、碱和RNHOH ;
③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐; ④RNHOH 与空气中的氧发生反应又得到RNO 。
(1)写出上述有关反应的化学方程式。
① ;③ ; (2)富玛克斯法的总反应的化学方程式为: , RNO 在整个过程中起到 的作用。
14.(8分)已知Na 2CO 3与HCl 反应分两步进行:第一步Na 2CO 3与HCl 反应生成NaHCO 3:Na 2CO 3+HCl =NaHCO 3+ NaCl ;第二步NaHCO 3与HCl 反应生成CO 2:NaHCO 3+HCl = NaCl +CO 2↑+H 2O 。
现有这样一个实验:在两支试管中分别加入3mL 稀盐酸,将两个各装有0.3g NaHCO 3或 Na 2CO 3粉末的小气球分别套在两支试管口,将气球内的NaHCO 3或Na 2CO 3同时倒入试管中(反应中盐酸足量)。
观察到现象如下:
(1)盛______的试管中产生气体的速率要快得多。
(2)盛______的试管中气球变得更大, 大小气球中生成气体的质量之比为(最简单整数比)______。
(3)甲同学用手触摸试管,发现盛NaHCO 3粉末的试管变冷,而盛Na 2CO 3的试管温度有升高。
为研: 通过上述实验可得出五条结论:
①NaHCO 3的溶解是_______(吸热或放热)过程; ②Na 2CO 3的溶解是_______(吸热或放热)过程;
③NaHCO 3的饱和溶液和盐酸的反应是____________(吸热或放热)反应; ④Na 2CO 3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
⑤NaHCO 3固体与稀盐酸反应的反应热是由________(填①~⑤序号)的热效应之和。
15.(4分)硫化钠是由无水硫酸钠与炭粉在高温下反应制得.反应的化学方程式为: ①Na 2SO 4+4C=Na 2S+4CO ↑;②Na 2SO 4+4CO=Na 2S+4CO 2↑.
(1)要制取Na 2S 15.6g ,需原料芒硝(Na 2SO 4?10H 2O ) g 。
(2)已知在标准状况下,28克CO 和44克CO 2的体积相等,都为22.4L 。
若在反应过程中,产生CO 和CO 2的混合气体在标准状况的体积为44.8L ,生成Na 2S 的质量为m ,请通过计算确定m 的取值范围。
