2019中考化学复习考点系统分析课件(甘肃专用):第5单元 化学方程式
2019中考化学 第五单元 化学方程式(共56张PPT)
6.
二氧化碳和氢气可在一定条件下反应,生成
一种重要的化工原料甲醇:CO2+3H2钌-膦铬合物加压CH3OH+H2O。下 列有关该反应的说法正确的是( A ) A.为CO2的利用创造了一种新途径 B.钌-膦铬合物的质量在反应前后发生了变化 C.氢原子数在反应前后发生了改变 D.属于复分解反应
3.
据报道,中国科学技术大学研究人员利用钴及其氧化物
成功研制一种新型催化剂,可将二氧化碳高效“清洁”地转化为液体燃料,反应的
微观示意图如下。有关该反应的说法正确的是( D )
A.反应前后原子总数减少 B.反应物和生成物中共有两种氧化物 C.得到的液体燃料化学式是H2C2O D.可用于减少温室气体的排放
4.
如图为汽车尾气净化装置中发生反应的微观示
意图,有关叙述错误的是( A )
A.该反应是置换反应 B.图中单质的化学式为N2 C.反应后分子总数减少 D.该装置可净化汽车尾气
5.
如图是某个化学反应的微观模拟图,下列关于
该反应前、后的说法正确的是( A )
A.均为混合物 B.质量减少
C.原子总数减少
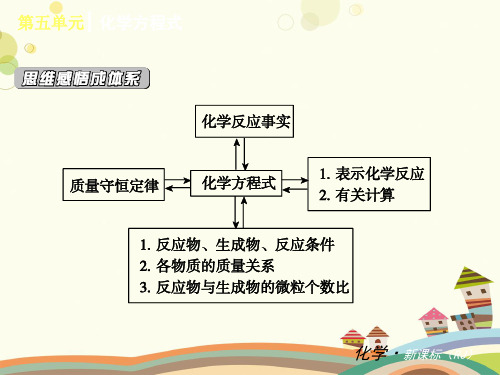
微观解释 验证实验
2.化学反应前后各种量的关系
3.质量守恒定律的应用
(1)推断物质的组成。
依据:化学反应前后元素种类不变。 (2)确定物质的化学式。
依据:化学反应前后原子种类、原子数目不变。
(3)推断化学方程式中的化学计量数。 依据:化学反应前后原子数目不变。
(4)解释反应前后物质的质量变化及用质量差确定某一物质的原子的质量不变。
4.质量守恒定律使用时的注意事项 (1)前提:化学反应。即该规律的适用范围是一切化学变化,不包括物理变化。 (2)条件:参加反应。在化学反应的前提下要注意该物质是否参加反应或是否完 全参加反应,没有参加反应的物质的质量不包括在内。 (3)核心:质量守恒。并不包括其他方面的守恒,如体积、密度、分子数等。 (4)强调“各物质”。很多化学反应中有气体、沉淀生成,因此生成的各物质包 括固、液、气三种状态的物质,不能因为生成了气体,而误认为质量减少不符合 质量守恒定律。
初中化学人教九年级上册第五单元 化学方程式 第五单元—化学方程式PPT
化学·新课标(RJ)
第五单元┃ 化学方程式
11.工业上使用一种“渗铬(Cr)技术”可以大大提高钢铁制品的抗腐蚀能力。其中 一个主要反应的化学方程式为Fe+CrCl2===Cr+FeCl2。已知参加反应的铁的质量为28 g,则生成的铬的质量为多少克?
(2)根据化学方程式计算的步骤依次是①设: 设未知量 ;②写:写出化
学方程式;③找: 找相关量 ;④列: 列比例式 ;⑤求:
;
⑥答:求未知量
。 简明地写出答案
化学·新课标(RJ)
第五单元┃ 化学方程式
典例1 :质量守恒定律的理解 例1 碳在氧气中燃烧,下列说法中,符合质量守恒定律的是( B ) A.8 g碳和32 g氧气完全反应,可生成11 g二氧化碳 B.6 g碳和16 g氧气完全反应,可生成22 g二氧化碳 C.6 g碳和20 g氧气完全反应,可生成26 g二氧化碳 D.32 g碳和12 g氧气完全反应,可生成44 g二氧化碳
四种说法,其中错误的是( A )
A
B
图5-1
C
D
化学·新课标(RJ)
第五单元┃ 化学方程式
[解析] A 因该反应有氧气参加,只生成一种固体物质P2O5,根据质量守恒定律 可知,反应后生成的固体质量比反应前固体磷的质量增加了。
点拨 本题主要考查通过化学方程式提取信息。在阐述化学方程式意义时, 要从内在因素和外在条件、质的意义和量的意义等方面出发,抓住关键, 有序表达,避免在表面等无关紧要的方面纠缠。
石灰水变浑浊
_____________
初三化学第五章化学方程式

初三化学第五章化学方程式第五章化学方程式教学目标1.识记:质量守衡定律2.理解:从微观角度认识质量守衡定律3.理解化学方程式的意义及书写化学方程式的两条原则,能正确书写化学方程式。
教学内容一、质量守恒定律1、质量守恒定律是自然界的客观规律(1)内容:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
关键词语:参加、化学反应、质量总和。
2.质量守恒的原因:一切化学反应前后,原子的种类、数目、质量不变。
(分子种类一定改变,数目可能改变。
)3.质量守恒定律的应用:解释现象,推断化学式,相关计算等。
4.研究质量守恒定律的方法:定量实验分析法。
5.质量守恒定律六个不变:原子的种类不变原子的数目不变原子的质量不变元素的种类不变元素的质量不变反应物和生成物总质量不变6.木炭在氧气中燃烧生成二氧化碳的反应用文字表示为:和反应条件生成碳+氧气点燃二氧化碳反应物生成物木炭在氧气中燃烧生成二氧化碳的反应用化学式变回为:C +O2 点燃CO27.化学方程式:用化学式来表示化学反应的式子。
8.化学方程式是重要的化学用语化学方程式提供的信息。
如:4P+5O2点燃2P2O5其质的方面的信息:磷和氧气点燃生成五氧化二磷;量的方面信息:微观上,4个磷原子和5个氧分子反应生成2个五氧化二磷分子,宏观上,每124份质量的磷和160份质量的氧气反应生成284份质量的五氧化二磷。
练习1.参加化学反应的物质在反应前后一定发生的是()A.原子的种类B.原子的数目C.分子的种类D.分子的数目2.下列现象不能用质量守恒定律解释的是()A.将2g氢气在20g氧气中燃烧,生成18g水B.将20ml酒精与20ml水混合,总体积小于40mlC.将浓硫酸置于空气中一段时间,溶液质量增加D.将二氧化碳的水溶液加热,溶液质量减轻3.下列变化中,属于化学变化,并且能用质量守恒定律解释的是()A.5g水受热变成5g水蒸汽B.5g食盐溶解在95g水中,成为100g 食盐溶液C.100ml水加入100ml酒精,成为体积小于200ml的溶液D.木炭燃烧后质量减少二、如何正确书写化学方程式1.正确书写化学方程式(配平,条件,箭号。
人教部编版九年级化学上册《第5单元 化学方程式【全单元】》精品PPT优质课件

(2) H2 + O2
H2O
点燃
(3)2H2 + O2
2H2O
导入新课
认知与了解
学习目标
1.了解化学方程式的书写原则。 2.掌握化学方程式书写的步骤。(重点) 3.能正确书写并配平简单的化学方程式。(难点)
讲授新课
一 化学方程式的书写
观察与思考
1.化学方程式的书写原则 (1)必须以客观事实为基础。 (2)必须遵守质量守恒定律。
讲授新课
实验与探究
讲授新课
实验与探究
方案二: 【实验原理】 铁+硫酸铜 【实验步骤】
铜+硫酸亚铁
在锥形瓶中倒入适量的CuSO4溶液,塞好 橡皮塞,几根铁钉(用砂纸打磨光亮),将
其放入天平上称量,记录数据m1;将铁丝 伸入CuSO4溶液中,过一会,观察现象? 再将其放在天平上称量,记录数据m2。
讲授新课
讲授新课
观察与思考
水通电分解的微观展示
讲授新课
交流与讨论
化学变化的实质是: 化学反应的过程,就是参加反应的各物质(反应物)的原 子重新组合而生成其他物质(生成物)的过程,由分子构 成的物质在化学反应中的变化过程可表为:
分子 分解为 原子 重组 新分子
讲授新课
交流与讨论 化学反应前后
宏观
微观
元素种类 元素质量
说出该方程式所表达的含义
点燃
S+O2
SO2
(1)硫和氧气在点燃的条件下反应生成二氧化硫; (2)每32份质量的硫与32份质量的氧气恰好完全反应生成64
份质量的二氧化硫; (3)该反应中微粒的个数比为1∶1∶1。
导入新课
观察与思考
判断下列方程式的正误,并说明原因。
人教版九年级化学(上)第五单元《化学方程式》复习教学课件

《化学方程式》复习课(一)质量守恒定律的理解与运用反应 各 质量 生成 各 化学 物理 质量 不能 原子的重新组合种类数目质量密闭实验现象分析:(1 )所选实验现象一定要现象明显(说明一定发生了化学反应)。
(2)实验中用到气体或生成气体的都必须在_________中进行才能验证质量守恒。
(3)所用反应都遵循_________ 。
造成天平不平衡的原因有:有的生成物或反应物的状态不同,其质量没有计算在内;反应装置_________不好;使得部分物质溢散或进入,造成质量发生变化。
密闭容器质量守恒定律气密性引申:质量守恒可以理解为 : 六个不变;两个一定变;一个可变可不变。
六个不变:化学反应前后物质总质量不变,元素种类,元素质量不变,原子的种类不变,原子的数目不变,原子的质量不变。
两个一定变:物质的种类;分子的种类一定会变一个可变可不变:分子的数目不一定变1.判断题:(1)100g 水加热变成100g 水蒸气遵守质量守 恒。
(2)因为四氧化三铁的质量大于铁丝的质量,所有铁丝在氧气中燃烧的实验不遵守质量守恒。
(3)3g 镁和3g 氧气充分反应会生成6g 氧化镁。
(4)化学反应前后原子种类、数目一定守恒,但分子数目不一定守恒。
x 因为是物理变化x 所有的化学变化都遵循质量守恒。
× 要求是参加反应的等于生成的。
√DA 如果X 前面没系数,则化学式是什么?已知反应前原子种类及个数N 4H 12O 6已知反应后原子种类及个数 N ? H 12O 6利用化学反应前后原子种类数目质量不变N 4化学反应前后原子种类、数目不变 4.工业上煅烧硫铁矿用来生产硫酸,用X 表示硫铁矿中的主要成分。
煅烧反应的化学方程式为: 4X + 11O 2 ===2Fe 2O 3 + 8SO 2,则x 为( ) A. FeS 2 B. Fe 2S 3 C. FeSO 4 D. Fe 4S 8高温Fe 4个 O (6+16)=22个S 8个O 22个X A D 已知反应物中已知生成物中还差Fe 4个, S 8个A利用化学反应前后元素种类不变A利用化学反应前后元素种类不变化学反应的关系式:有机物 + O 2 → CO 2 + H 2O + SO 2已知变化后元素种类 CHSO已知变化前元素种类O 点燃根据参加化学反应的各物质质量总和等于生成的各物质的质量总和。
(甘肃地区)2019年中考化学总复习-第五单元 化学方程式课件

独家教育资源为你2提供,thank you
考点一
考点二
考点三
考点·必备梳理 考法·必研突破
3.读法(以4P+5O2 (1)质的方面。
2P2O5为例)
磷和氧气在点燃 的条件下反应生成五氧化二磷 。
(2)量的方面。
①每124 份质量的磷和160 份质量的氧气完全反应生成284
份质量的五氧化二磷。
②每4 个磷原子和5 个氧气分子完全反应生成2 个五氧化
A.N2O 答案 B
B.NO C.NO2D.N2O5
解析 由3Cu+8HNO3 3Cu(NO3)2+2X↑+4H2O可知, 反应前铜原子是3个,反应后是3个;
反应前氢原子是8个,反应后氢原子是8个;
反应前氮原子是8个,反应后应该是8个,其中2个包含在2X中;
反应前氧原子是24个,反应后应该是24个,其中2个包含在2X中;
由分析可知,每个X中含有1个氮原子和1个氧原子,是一氧化氮,
化学式是NO。
独家教育资源为你2提供,thank you
考法1
考法2
考点·必备梳理 考法·必研突破
方法点拨化学反应遵循质量守恒定律,即化学反应前后,元素的 种类不变,原子的种类、总个数不变,这是书写化学方程式、进行 相关方面计算的基础。
独家教育资源为你2提供,thank you
二磷分子。
4.书写原则
(1)必须以客观事实 为基础;
(2)要遵守质量守恒定律 ,等号两边各原子的种类 与数目 必
须相等。
独家教育资源为你2提供,thank you
考点一
考点二
考点三
5.书写步骤
考点·必备梳理 考法·必研突破
注意事项:(1)化学方程式必须符合客观事实。 (2)在配平过程中不得更改化学式,只能更改化学式前的化学计量 数。
