有机化学讲义芳香杂环化合物
合集下载
有机化学---第17章 杂环化合物

、 内酯、环状酸酐等。
环为平面型共轭体系,环内π电子数符合4n+2规 则,具有一定芳香性的杂环化合物。
2
2、杂环化合物的分类
五元杂环, 如 单杂环 六元杂环, 如 杂环化合物 稠杂环 两个以上单杂环稠并
N N N H
O N
N H
S
苯环与单杂环稠并, 如 N H
N
N
3
3、杂环化合物的命名 (1)音译法 ——在同音汉字左边 + 口字旁
N ..
H2SO4,HgSO4 220℃
N
N
NO2
β-硝基吡啶
SO3H
β-吡啶磺酸
34
当吡啶环上连有供电子基团时,将有利于亲电取
代反应的发生;反之,就更难以进行亲电取代反应。
NO2
HNO3,H2SO4
H3 C N CH3
100℃
H3 C
N
CH3
吡啶环也象硝基苯一样,不能发生F―C烷基化和 酰基化反应。
吲哚具有芳香性,亲电取代反应发生在吡咯环上; 吲哚亲电取代反应的活性比苯高,但比吡咯低。 亲电取代反应的位置:
5 4 3 7
E+
1
苯 环
6
N H
2
吡咯环
26
进攻 C2 N H + E
+
进攻 C3
只有一个带有完 E N 2 H 整苯环的共振杂化体。 H 3 E 3 E H H + + N N H H
OH
6
S1
苯并呋喃
1
苯并吡咯 喹啉
N
9 7 8
苯并噻唑
N N
3
5 4
HO
N H
OH
12 杂环化合物《有机化学》

Br
(80%)
O
O Cl2
-40℃ , CH3COOH
Cl
O
(64%)
Br2
CH3COOH
Br
S
(78%)
S Cl2
50℃
Cl
S
(36%)
I2,HgO C6H6, 0℃
I
S
(70%)
吡咯极易卤化生成四卤吡咯。
(2)硝化
呋喃和吡咯很易被氧化,遇无机酸容易发生聚合, 因而不能用硝酸硝化。通常用比较温和的非质子硝化试 剂,如用硝酸乙酰酯
离域能 呋喃、吡咯和噻吩的离域能分别为: 67 kJ·mol-1、 88 kJ·mol-1和117 kJ·mol-1 比苯的离域能(150.5 kJ·mol-1 )低,但比大多数共 轭二烯烃的离域能(约12~28 kJ·mol-1 )要大得多。
芳香性:苯>噻吩>吡咯>呋喃
2、 呋喃、噻吩和吡咯化学性质
有机化学 第12章 杂环化合物
基本要求:
• 1.掌握呋喃、吡咯、噻吩、吡啶、嘧啶、 喹啉、吲哚、嘌呤及其衍生物的命名。
• 2.掌握呋喃、吡咯、噻吩、吡啶的结构 与芳香性的关系,结构与亲电取代反应 活性的关系。
• 3.掌握吡咯和吡啶的酸碱性,呋喃、吡 咯、噻吩、吡啶的亲电取代反应(卤代、 磺化),还原反应,吡啶侧链的氧化反应。
COOH
(烟酸 )
N
HNO3
COOH
COOH
N
△
COOH △
N
N
吡啶可被催化加氢或用乙醇和钠还原而成为六氢吡啶。
Na + C2H5OH
N
或 H2/Pt ,0.3MPa,25℃
N H
常见吡啶衍生物
有机化学杂环化合物

呋喃、噻吩和吡咯的原子轨道示意图:
. .. O .. .. S .. . . . . . . .
.
..
O
..
.
..
S
..
.
..
N H
.
..
N H
芳香性大小: 苯>噻吩>吡咯>呋喃
呋喃、噻吩和吡咯的结构
N ..
吡啶中氮原子采取不等性sp2杂化:
p N sp 2 p 结果是: sp 2 N
p轨道与环平面垂 直,相互重叠形 成六个原子在内 的闭合共轭体系
17 杂环化合物
(Heterocyclic Compounds)
基本内容和重点要求
杂环化合物的分类和命名;
杂环化合物的结构和芳香性;
杂环化合物的化学性质;
生物碱
重点要求掌握芳香性;五元、六元杂环化合物 的化学性质,杂环化合物的亲电取代反应的活性及 规律;酸碱性规律。
17 杂环化合物
17.1 杂环化合物的分类和命名
N O SO3 O SO3H
N N H
H2SO4 S 30℃
SO3 N H SO3H
S
SO3H
吡啶与硝基苯相似,亲电取代比苯困难, 并且主要发生在β位上,反应条件要求较高。
¡¡ + Br2
300 C Ò É Ô Ï
¡
Br N
N N N
å ú Á ¤ b-ä ´ ß à
+ H2SO4 + » Ë ì á
. . .
. .
.
N
..
未共用电子对占据 sp2杂化轨道,与 环共平面,不能参 与环系的共轭
吡啶的结构
有机化学精品课件——杂环化合物

理学、毒理学和临床研究等方面的内容。
05
有机化学与绿色化学
有机化学的发展趋势
1 2 3
新的合成方法
例如,定向合成、组合合成和高选择性催化等 新技术的开发和应用,极大地推动了有机化学 的发展。
新的反应性和反应机制
例如,电化学和光化学反应以及超分子和纳米 反应器等新技术的应用,为有机化学提供了新 的反应性和反应机制。
总结词
杂环化合物在分子生物学领域具有广泛的应用,涉及多种生物学实验技术。
详细描述
杂环化合物可以作为药物分子、基因治疗剂、分子探针等应用于分子生物学研究中。生物学实验技术包括细胞 培养、基因克隆和表达、蛋白质分离和分析等。这些技术可以用来研究杂环化合物在生物体内的吸收、分布、 代谢和排泄等特性。
杂环化合物的应用研究实验
合成方法
通过取代反应
杂环化合物可以通过取代反应合成,如卤代烃、醇、羧酸等 中的杂原子被其他原子取代。
通过成环反应
某些杂环化合物可以通过成环反应合成,如氨基酸、腺苷等 。
02
杂环化合物的种类与性质
含氮杂环化合物
吡啶
弱碱,碱性来自于氮原子上的孤对电子,可参与多种有机反应。
咪唑
碱性较弱,作为配体参与有机反应。
抗疟活性
青蒿素及其衍生物是具有抗疟活性的重要杂环化合物,通过干扰疟原虫的细胞膜 结构和功能,导致疟原虫死亡。
04
有机化学实验技术
杂环化合物的合成实验
总结词
有机化学实验技术中,杂环化合物的合成 实验是掌握杂环化合物性质的重要环节。
VS
详细描述
杂环化合物的合成实验涉及到多种反应类 型,如缩合反应、取代反应、加成反应等 。在实验过程中需要用到各种不同的试剂 和溶剂,如酸、碱、氧化剂、还原剂等。 实验操作也有一定难度,需要掌握一定的 实验技能和操作技巧。
05
有机化学与绿色化学
有机化学的发展趋势
1 2 3
新的合成方法
例如,定向合成、组合合成和高选择性催化等 新技术的开发和应用,极大地推动了有机化学 的发展。
新的反应性和反应机制
例如,电化学和光化学反应以及超分子和纳米 反应器等新技术的应用,为有机化学提供了新 的反应性和反应机制。
总结词
杂环化合物在分子生物学领域具有广泛的应用,涉及多种生物学实验技术。
详细描述
杂环化合物可以作为药物分子、基因治疗剂、分子探针等应用于分子生物学研究中。生物学实验技术包括细胞 培养、基因克隆和表达、蛋白质分离和分析等。这些技术可以用来研究杂环化合物在生物体内的吸收、分布、 代谢和排泄等特性。
杂环化合物的应用研究实验
合成方法
通过取代反应
杂环化合物可以通过取代反应合成,如卤代烃、醇、羧酸等 中的杂原子被其他原子取代。
通过成环反应
某些杂环化合物可以通过成环反应合成,如氨基酸、腺苷等 。
02
杂环化合物的种类与性质
含氮杂环化合物
吡啶
弱碱,碱性来自于氮原子上的孤对电子,可参与多种有机反应。
咪唑
碱性较弱,作为配体参与有机反应。
抗疟活性
青蒿素及其衍生物是具有抗疟活性的重要杂环化合物,通过干扰疟原虫的细胞膜 结构和功能,导致疟原虫死亡。
04
有机化学实验技术
杂环化合物的合成实验
总结词
有机化学实验技术中,杂环化合物的合成 实验是掌握杂环化合物性质的重要环节。
VS
详细描述
杂环化合物的合成实验涉及到多种反应类 型,如缩合反应、取代反应、加成反应等 。在实验过程中需要用到各种不同的试剂 和溶剂,如酸、碱、氧化剂、还原剂等。 实验操作也有一定难度,需要掌握一定的 实验技能和操作技巧。
有机化学课件:第十四章杂环化合物和维生素

O
N H
次黄嘌呤
黄嘌呤
N N H
尿酸
O HN ON
H
H N
N H
O
黄嘌呤(2,6-二羟基嘌呤),存在酮式-烯醇式互变异构
H ON
NHNNH NhomakorabeaO
HO N N
N
N
H
OH
咖啡因 具有利尿和 O
CH3 NN
兴奋中枢
N
N
神经作用 H3C
O
CH3
O
HN
NH
O NH NH O
尿酸
酮式(为主)
OH
6
1N
5
N7
2
4
8
反应活性部位有何不同? 3. 核酸中存在的嘧啶衍生物有哪些?嘌呤衍生物呢? 4. 什么是维生素?维生素是如何分类的? 5. 对人体重要的维生素有哪些?其生理功能分别有何表现?
第十四章 杂环化合物和维生素
主要内容:重点学习杂环化合物的结构、命名、典型性质; 了解磺胺类药物、维生素的结构和功能。
由碳原子与其它原子(O,S,N 等)组成的具有一定程度芳香 性的稳定的环状化合物叫杂环化合物。(属非苯型芳烃)
2. 有几个相同杂原子时,一般从连氢的杂原子开始编号,
并使杂原子的位置数字之和最小。
3. 有几个不同杂原子时,按 O→S→-NH → =N 顺序编号。 4. 少数稠杂环有特定的编号方法,与上述规则不相符合。
呋4
3
喃5O 2
1
4
5
3
6
2
N
1
吡啶
4 N3
5
2
N H
1
咪唑
43
5
2
S
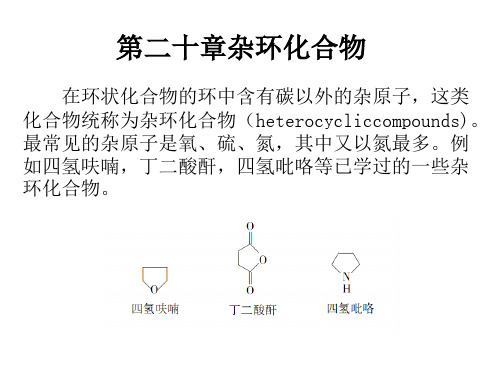
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
有机化学-第16章杂环化合物

O NH3Cl
-
O + Me Me
H3C NaOH N H CH3
O NH3Cl
-
O NaOH O H N H H HO OHN H -OHH3C N H CH3 Me Me O N H
16.3 一杂六元杂环化合物
16.3.1 吡啶的结构
H H N H H
0.140 nm 0.139 nm
N
H
吡啶的轨道结构
Cl N
与重氮盐的偶联反应
H N N N Cl N H N N N H N N
呋喃、噻吩 、吡咯的合成
H Me O O Me Me O O H Me Me O OH Me P2O5 -H2O Me O Me
H Me O O Me (NH4)2CO3 OH Me H N O H H Me Me N H2 Me Me N H OH2 Me
16.3.1 吡啶的性质
N 0.134 nm C–N: 0.146 nm C=N: 0.128 nm
• 是弱碱:pKb = 8.8,但比三级胺弱: pKb = 4.2
碱 性
• 原因:吡啶上氮原子的孤对电子在SP2轨道上,比三级 胺(孤对电子在SP3轨道上)S成分多,降低了结合质子 的能力。 • 碱性比苯胺强
N
1. 吡啶很难发生亲 电取代反应 2. 不发生FreidelCrafts烷基化和 酰基化反应
• 亲电取代反应需要 Brønsted酸或Lewis酸促 进,而吡啶的氮原子和酸 作用使氮带正电荷,进一 步降低电子云密度。
吡啶和苯的亲电取代反应比较
Br N NO2 N SO3H N R N RX/ AlCl3 R 发烟 H2SO4 SO3H HNO3/H2SO4 50 oC NO2 Br
有机化学杂环化合物

在非强酸性条件下,有些亲电试剂也可以在吡 啶环上进行。
亲核取代反应
喹啉和异喹啉也可以发生亲核取代反应。喹啉 在2位C, 4位C较少。异喹啉主要在1位C,几乎没有 3位C的产物。
氧化反应
衍生物
喹啉的衍生物是许多生物碱的母体结构
H
CH3O H
HO
N H
CH3O
N
N 奎 宁 (金 鸡 纳 霜 )
1
嘧啶pyrimidine mp 22oC
4
5 N3
6
2
N
1
吡嗪pyrazine
mp 57oC
4
5
N3
6 N2 N
1
1, 2, 3-三嗪
4
5N 3
6 N2 N
1
1, 2, 4-三嗪
4
5N
3
N
6
2
N
1
1, 3, 5-三嗪
都有弱碱性,但比吡啶碱性弱。
最重要的衍生物是嘧啶衍生物,在生理和药理上 有重要地位:
黄样离子
CH3 HO
CH3
O CH3
O 黄酮
VE
第三节 稠杂环
一、苯并五元杂环
N
O
S
N
茚
H 吲哚
苯并呋喃
苯并噻吩 异 吲 哚
mp52oC bp173~175oC bp221oC
N
N
N
N H
O
S
苯 并 咪 唑 苯 并 恶 唑 苯 并 噻 唑
N
N N
N N
H
H
吲 唑 苯 并 三 唑
吲哚有一定的酸性,可以与碱反应生成盐。
制备:甘蔗渣、花生壳、高粱杆、棉子壳等含 有戊多糖,将它们打碎放入反应釜,加入稀硫 酸,通入水蒸气加热,戊多糖水解为戊糖,戊 糖失水成糠醛。
