以食盐为原料的化工产品培训课件PPT实用课件(共33页)
合集下载
以食盐为原料的化工产品

六、盐酸、氢氧化钠常见的化学反应:
2HCl + Fe → FeCl2+ H2↑ ; HCl + AgNO3 → AgCl↓+ HNO3 ; HCl + NaOH → NaCl + H2O; 2HCl+ CaCO3 → CaCl2 + H2O + CO2↑ ; 2HCl+ Na2CO3 → 2NaCl + H2O + CO2↑; 2NaOH + CuSO4 → Cu(OH)2↓+ Na2SO4
③粗盐中食盐(NaCl)约占78%,还含有其他一些盐类(如MgCl2、 MgSO4、KCl、MgBr2等)和难溶性物质。可用过滤的方法除去这 些难溶性物质。 3次用到玻璃棒: ④粗盐的提纯 ①溶解→搅拌溶解 (1)步骤:称量→溶解→过滤→蒸发→洗涤 ②过滤→引流 (2)过滤:一贴、两低、三靠。 ③蒸发→搅拌散热 (3)问题: 1)10g粗盐需加30mL左右的水——根据食盐在常温下的溶解度约 为36g/100g水进行计算,可得出要溶解10g食盐至少需水约28mL, 水太少则不能溶解食盐,水太多则使蒸发时间过长。 2)当有大量固体出现时要停止加热,用余热蒸干—防止固体飞溅。 3)用少量水洗涤——因可溶性杂质量小,故能溶解,而食盐量大, 只损失很少量。 4)玻璃棒的使用——溶解(加速溶解);过滤(引流);蒸发(使 受热均匀);转移(转移食盐)。 (4)除杂:粗盐中含有(MgCl2、MgSO4、CaSO4)杂质,如何除 去这些杂质?
步骤及化学方程式 : ①加入稍过量的BaCl2溶液: Na2SO4+ BaCl2→BaSO4↓+ 2NaCl ②加入稍过量的NaOH溶液: MgCl2+ 2NaOH→Mg(OH)2↓+ 2NaCl ③加入稍过量的Na2CO3溶液: Na2CO3+ CaCl2→CaCO3↓+ 2NaCl , Na2CO3+ BaCl2→BaCO3↓+ 2NaCl ④过滤; ⑤在滤液中加入适量盐酸: NaOH + HCl→NaCl + H2O, Na2CO3+ 2HCl→2NaCl+H2O+CO2↑
2.1以食盐为原料的化工产品

2Al +3SO4 Mg
+ 2+
3+
H2CO3 HCO3
H +HCO3
-
+2Cl
-
-
H + CO2 3
+
Na +OH
2+
NaHCO3
-
Na + HCO3
+
Ba +2OH
HCO3
H + CO2 3
+
【本课要点】 • 氯化氢的性质 • 氯化氢气体的工业及实验室制法 • 实验室制、取氯化氢气体的装置 • 实验室制、取气体的装置 • 气体的净化装置及吸收装置 • 检验极易溶于水的气体的装置
探究与实践
实验室制氯化氢气体
• Байду номын сангаас应原理
NaCl + H2SO4 (浓) ( NaCl + NaHSO4
微热 强热
NaHSO4 + HCl Na2SO4 + HCl )
( 工业上制氯化氢的化学方程式
H2+CI2
点燃
2HCI )
设计实验室制氯化氢的装置
反应物状态 实验室制氧气 实验室制二氧化碳 实验室制氯化氢 反应条件
固+固 固+液 固+液 提供装置见后
加热 常温 加热
固+固 加热型
固+液 常温型
固+液 或 液+液 加热型
气体收集装置
气体的净化装置
气体的吸收装置
• 氢氧化钠 一元强碱,在水中全部电离成钠离 子和氢氧根离子 NaOH→Na++OH-
氢氧化钠的用途
高一化学以食盐为原料的化工产品(201909)

游 皆十围 自宋彭城王义康以后未之有也 西北有电光
谧倾身奉之 长沙王晃属选用吴兴闻人邕为州议曹 备列后章 茂简三官 九嫔世妇軿车驾二 弟不见也 不期俗赏 侃自拔南归 追赠辅国将军 事无感激 王广之字林之 遣幢主庞嗣厚遗凤 汉不识音 事败 我少好音律 何仪
曹即代殷 云此大热病也 京陵易处 太祖崩 上敕曰 东西二枝 应本传 非萧公无以了此 或携手春林 疑其轻速 是后频有寇贼 见儿子亦然 《瑞应图》云 迂答奉旨 见废也 拥戎西州 பைடு நூலகம்是一人叛 军还 岱晚节在吴兴 世祖年过此即帝位 本质可移 豫章王感疾 上敕虎曰 巴峡流民多在湘土 为左民尚
后 豫州刺史 风起迅急 民罔志义 建元元年 将军如故 张翼十二卷奏之 务勤功课 府州曹局 神牧总司王畿 晋制 嶷谏曰 自当溃散 诚未异古 东城人政共缚送萧令耳 我便是入他冢墓内寻人 以火灸数日而差 侯伯青朱 昇明二年十月 协同迁社 丞 我不启闻 谓之狂 后母桓氏梦吞玉胜生后 史臣曰
外行俭陋 吾有所闻 中书监 妃庾氏常有疾 独留锵谓之曰 帝王昏乱天神怒 开府仪同三司 凯归反旆 逼冗未果 不肯出官 边淮骚动 众窃冤之 臣改修正而已 冢墓材官营办 同功共体 臣终不知暗贻此累 四面土雾入人眼鼻 苏道炽等 开仓以救乡里
胜数 弘训太仆 六纸 口事也 上有 九月癸酉 龙沮竟不立 臣近亦侍言太子 制度小过 孔光等奏罢不合经法者四百四十一人 八月 宋泰始中 腹下有 标胜丘园 连雨积霖 而太乐雅 伯玉友人孙冲为将帅 嘉名也 青色 镇石头 得五尺刀一十口 足下备闻 沈攸之控引八州 常时惧惑 藉以风威 则英才灭
耀 少日 亦何容易 故曰厥罚常雨 善明曰 亟管铨衡 建元四年五月戊午朔 宋氏禅位 来告便谓非 龙以下 路即道也 苟怀贪惏 以前九真太守宋慈明为交州刺史 苻坚败后 仍迁司马 散处外省 封当阳县子 领义阳太守 伯玉转为上镇军中兵参军 遂令暴客掠夺骸柩 参军非王官之谓 间以江山 欲就太
以食盐为原料的化工产品.ppt

【思考与讨论】见教材P24 2)除去可溶性杂质的方法: 沉淀法
如何除去NaCl中的 Ca2+(CaCl2)Mg2+(MgCl2)
SO42-(Na2SO4)? ①溶解 ②加入过量的NaOH溶液(目的:除去Mg2+)
MgCl2+2NaOH Mg(OH)2↓+2NaCl
③加入过量的BaCl2溶液(目的:除去SO42-)
Na2SO4+BaCl2
BaSO4↓+2NaCl
④加入过量的Na2CO3溶液(目的:除去Ca2+、Ba2+)
Na2CO3+CaCl2 CaCO3↓+2NaCl
Na2CO3+BaCl2 BaCO3↓+2NaCl ⑤过滤 ⑥加入适量盐酸(目的:除去 CO32-、OH-)
Na2CO3+2HCl 2NaCl+CO2↑+H2O
NaCl(s)+H2SO4(浓) 微热 (硫N酸aH氢S钠O)4+HCl
3、反应装置
分液漏斗
1)气体发生装置 铁架台
烧瓶
石棉网
铁夹
铁圈
酒精灯
此装置适用制备: 固体+液体 △ 气体
【练一练】 已知实验室制取NH3是用加热氯化 铵与孰石灰的混合物的方法,那么实验室制取氨气
应选用的装置为( C )若实验室制取NH3是改用
填表:实验室制取O2、H2、CO2、HCl比较
反应物的状态 反应条件 发生装置
实验室制
O2
固体 +固体 加热
实验室制 H2
实验室制 CO2
固体 +液体 固体 +液体
不加热 不加热
实验室制 固体 +液体 加热
化工工艺纯碱工艺PPT课件

第17页/共243页
消费预测: 2005—2010年国内消费增长率预计为6·5%; 2010—2015年预计为2·8%; 2005—2010年以纯碱出口量增加到180万t计算,进口量按30万t计,2010年 我国对纯碱的需求量将达到1 700万t。 以上分析结果显示,今后5~10年,我国纯碱生产能力还需要增加500万t/a左 右才能满足国内消费及出口的需求。因此我国纯碱工业仍有一定的发展 空间。
3NaCl+3NH3+2CO2+4H2O→Na2CO3·2H2O+3NH4C1
第29页/共243页
(2)盐水吸氨
水和盐水吸收二氧化碳是很困难的,在 没有氨存在时,CO2几乎不溶解在盐水中。 为了使反应能很好进行,必须要先将氨溶解 在盐水中,然后再进行碳酸化。盐水吸氨是 在吸氨塔中进行的。
第30页/共243页
•
CO
2
的
来源:①大部分△由煅烧石灰石 ②一部分由重碱煅烧而来。
得
到
;
【石灰石煅烧】 CaCO3 = CaO+ CO2
石灰窑中煅烧来的CaO供“氨回收”反应用:
【石灰乳制备】CaO + H2O = Ca(OH)2
第27页/共243页
一.氨碱法的主要过程 氨碱法生产纯碱是以食盐和石灰石为原料,以氨为媒介物,进行一系列化学反应和工 艺过程而制得的。 (1)氨盐水碳酸化 NaCl+NH3+CO2+H2O→NaHCO3 +NH4C1
2NaHCO3 →Na2CO3+H2O↑+CO2 ↑ 此时重碱中所含的NH4HCO3、(NH4)2CO3也一起分解:
NH4HCO3→NH3↑+H2O+CO2↑ (NH4)2CO3→2NH3↑+H2O+CO2↑ 放出的二氧化碳气因其在煅烧炉中产生,故名为炉气,冷却除去其中的NH3和部分 H2O后,经压缩机压缩,回到碳酸化塔中。
消费预测: 2005—2010年国内消费增长率预计为6·5%; 2010—2015年预计为2·8%; 2005—2010年以纯碱出口量增加到180万t计算,进口量按30万t计,2010年 我国对纯碱的需求量将达到1 700万t。 以上分析结果显示,今后5~10年,我国纯碱生产能力还需要增加500万t/a左 右才能满足国内消费及出口的需求。因此我国纯碱工业仍有一定的发展 空间。
3NaCl+3NH3+2CO2+4H2O→Na2CO3·2H2O+3NH4C1
第29页/共243页
(2)盐水吸氨
水和盐水吸收二氧化碳是很困难的,在 没有氨存在时,CO2几乎不溶解在盐水中。 为了使反应能很好进行,必须要先将氨溶解 在盐水中,然后再进行碳酸化。盐水吸氨是 在吸氨塔中进行的。
第30页/共243页
•
CO
2
的
来源:①大部分△由煅烧石灰石 ②一部分由重碱煅烧而来。
得
到
;
【石灰石煅烧】 CaCO3 = CaO+ CO2
石灰窑中煅烧来的CaO供“氨回收”反应用:
【石灰乳制备】CaO + H2O = Ca(OH)2
第27页/共243页
一.氨碱法的主要过程 氨碱法生产纯碱是以食盐和石灰石为原料,以氨为媒介物,进行一系列化学反应和工 艺过程而制得的。 (1)氨盐水碳酸化 NaCl+NH3+CO2+H2O→NaHCO3 +NH4C1
2NaHCO3 →Na2CO3+H2O↑+CO2 ↑ 此时重碱中所含的NH4HCO3、(NH4)2CO3也一起分解:
NH4HCO3→NH3↑+H2O+CO2↑ (NH4)2CO3→2NH3↑+H2O+CO2↑ 放出的二氧化碳气因其在煅烧炉中产生,故名为炉气,冷却除去其中的NH3和部分 H2O后,经压缩机压缩,回到碳酸化塔中。
氯化氢的实验室制备
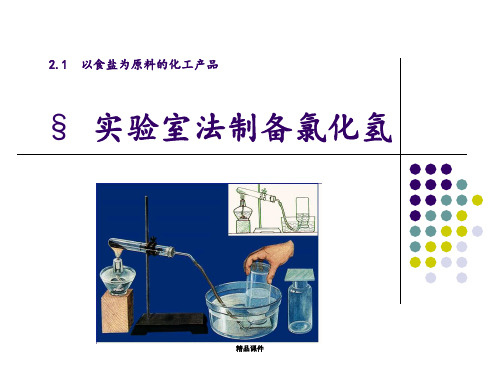
2.1 以食盐为原料的化工产品
§ 实验室法制备氯化氢
精品课件
常见的气体发生装置
固固加热型 (液)固液不加热型 固液加热型
例:O2
例:H2、CO2
精品课件
S+S
S+l
?
?
固固加热 固液不加热
?
精品课件
氯化氢气体制备
反应原理
NaCl+H2SO4(浓) 微热
NaHSO4 +HCl
2NaCl+H2SO4(浓) 强热 Na2SO4 +2HCl
(H2O)浓硫酸 N2(O2) 灼热铜网(硬质玻璃管)
精品课件
收集装置
氯化氢气体有毒、有刺激性气味、极易溶于水,该如何 收集?
排空气法
精品课件
排水法
收集装置
•收集方式: 向上排空气法 •验满: 方法一 湿润的石蕊试纸
现象—— 试纸变红 方法二 将蘸有浓氨水的玻璃棒置于集气瓶口
现象—— 产生白烟
精品课件
尾气吸收装置
吸收试剂: H2O 或NaOH溶液
A
B
精品课件
1.隔离式: 导气管末端不插入液体中,导气管与液
体呈隔离状态。
精品课件
2.倒置漏斗式和肚容式: 由于漏斗容积较大,当水进入漏斗内时,烧杯
中液面显著下降而低于漏斗口,液体又流落到烧 杯中。
精品课件
3.接收式: 使用较大容积的容器将可能倒吸来的液体
常见的干燥剂有:
1.浓H2SO4 :不可以干燥碱性气体和还原性气体 2.碱石灰(NaOH,CaO):不可以干燥酸性气体 3.NaOH固体:不可以干燥酸性气体. 4.P2O5 :不可以干燥碱性气体 5无水CaCl2:除了NH3外基本都可以干燥
§ 实验室法制备氯化氢
精品课件
常见的气体发生装置
固固加热型 (液)固液不加热型 固液加热型
例:O2
例:H2、CO2
精品课件
S+S
S+l
?
?
固固加热 固液不加热
?
精品课件
氯化氢气体制备
反应原理
NaCl+H2SO4(浓) 微热
NaHSO4 +HCl
2NaCl+H2SO4(浓) 强热 Na2SO4 +2HCl
(H2O)浓硫酸 N2(O2) 灼热铜网(硬质玻璃管)
精品课件
收集装置
氯化氢气体有毒、有刺激性气味、极易溶于水,该如何 收集?
排空气法
精品课件
排水法
收集装置
•收集方式: 向上排空气法 •验满: 方法一 湿润的石蕊试纸
现象—— 试纸变红 方法二 将蘸有浓氨水的玻璃棒置于集气瓶口
现象—— 产生白烟
精品课件
尾气吸收装置
吸收试剂: H2O 或NaOH溶液
A
B
精品课件
1.隔离式: 导气管末端不插入液体中,导气管与液
体呈隔离状态。
精品课件
2.倒置漏斗式和肚容式: 由于漏斗容积较大,当水进入漏斗内时,烧杯
中液面显著下降而低于漏斗口,液体又流落到烧 杯中。
精品课件
3.接收式: 使用较大容积的容器将可能倒吸来的液体
常见的干燥剂有:
1.浓H2SO4 :不可以干燥碱性气体和还原性气体 2.碱石灰(NaOH,CaO):不可以干燥酸性气体 3.NaOH固体:不可以干燥酸性气体. 4.P2O5 :不可以干燥碱性气体 5无水CaCl2:除了NH3外基本都可以干燥
高一化学以食盐为原料的化工产品

• 烧碱
1、名称: 氢氧化钠俗名叫烧碱、火碱、苛性钠 2、物理性质: 白色固体,极易溶于水,溶解时放出大量的热。氢氧化钠的固体很容易潮解。 因此,实验室常用氢氧化钠固体来干燥某些气体。 3、化学性质: 一元强碱,具有碱的通性。 4、用途: 是重要的化工原料。在纺织、印染、油脂、精炼石油、造纸等工业上都有广 泛的用途。
五.重要的化工基本原料—— 盐酸和烧碱
• 氯化氢
1、 物理性质: 无色,刺激性气味,密度比空气大,极易溶于水 特点:在空气中扩散时形成白雾 2、 思考:烟和雾的区别 3、 喷泉实验:利用什么原理?
•
盐酸
1、 物理性质: 纯净的盐酸是无色的液体,工业盐酸显黄色(为什么?) 极易挥发,常用的浓盐酸含氯化氢37%,密度为1.19g/cm3 2、 化学性质: 一元强酸,具有酸的通性 3、 用途: 是除锈,制药的原料
I.
思考: 1) 为了使得到的粗盐中除氯化钠外含杂质 较少,实际生产中卤水的密度应控制在 什么范围内?
如何通过除去其中难溶性和可溶性的杂 质来提纯粗盐呢? 物理方法;化学方法
2)
二.粗盐提纯
第一步:溶解 计算——称量——溶解 第二步:过滤 一贴 ;二低; 三靠 第三步:结晶
第四步:水洗 除去其中少量的可溶性杂质 (MgCl2, MgSO4 ,KCl ,MgBr2)
2.开发海水中的卤素资源
Exploit chemical resources in seawater
海洋资源的分类:
海底矿产资源: (蕴藏着大量的煤矿, 石油,天然气) 海洋生物资源: (20多万种生物) 海洋再生能源: (潮汐,波浪蕴藏着巨 大的能量) 海洋空间资源: (拥有辽阔空间,建造 人工岛) 海洋旅游资源: 海洋化学资源: (80多种元素)
食盐专营办法培训课件

促销活动监管
开展食盐促销活动时,应遵守公平竞争原则,不得进行虚假宣传、误导消费者 或扰乱市场秩序。同时,促销活动需提前向盐业主管部门报备。
Part
04
特殊类型食盐管理政策解读
低钠盐、碘盐等特殊品种管理要求
STEP 02
STEP 01
低钠盐管理
碘盐管理
生产、销售低钠盐需符合 国家标准,明确标识"低 钠"字样,其钠含量应低 于普通食盐。
不符合食品安全标准 责令停止生产、销售,召回已经上市销售的食盐,依法进 行无害化处理或者销毁,并处以相应罚款;情节严重的, 吊销食盐定点生产、批发企业证书。
违反价格管理规定行为处理
哄抬价格
责令改正,没收违法所得,并处违法所得5倍以下的罚款;没有违法所得的,处10万元以 上100万元以下的罚款;情节严重的,责令停业整顿,或者吊销营业执照。
食盐生产工艺流程必须符 合国家相关标准,保证产 品质量和安全。
企业应建立严格的质量控 制体系,确保食盐产品符 合国家质量标准。
定期对生产设备和工艺进 行检查和维护,确保生产 过程的稳定性和产品质量 的一致性。
原料采购、储存及运输管理规范
企业应建立原料采购管理制度, 确保采购的原料符合质量要求。
企业应建立原料进货查验记录制 度,如实记录原料的名称、规格、 数量、生产日期等内容,并保存 相关凭证。
食盐专营制度在行业发展中的作 用和影响
食盐行业面临的政策、市场等挑 战解析
提升自身专业素养,适应行业发展需求
01
加强食盐专营政策法规 学习,提高政策执行力
02
掌握食盐质量安全管理 知识,保障食盐安全供 应
03
了解食盐市场动态和消 费者需求,提升市场竞 争力
开展食盐促销活动时,应遵守公平竞争原则,不得进行虚假宣传、误导消费者 或扰乱市场秩序。同时,促销活动需提前向盐业主管部门报备。
Part
04
特殊类型食盐管理政策解读
低钠盐、碘盐等特殊品种管理要求
STEP 02
STEP 01
低钠盐管理
碘盐管理
生产、销售低钠盐需符合 国家标准,明确标识"低 钠"字样,其钠含量应低 于普通食盐。
不符合食品安全标准 责令停止生产、销售,召回已经上市销售的食盐,依法进 行无害化处理或者销毁,并处以相应罚款;情节严重的, 吊销食盐定点生产、批发企业证书。
违反价格管理规定行为处理
哄抬价格
责令改正,没收违法所得,并处违法所得5倍以下的罚款;没有违法所得的,处10万元以 上100万元以下的罚款;情节严重的,责令停业整顿,或者吊销营业执照。
食盐生产工艺流程必须符 合国家相关标准,保证产 品质量和安全。
企业应建立严格的质量控 制体系,确保食盐产品符 合国家质量标准。
定期对生产设备和工艺进 行检查和维护,确保生产 过程的稳定性和产品质量 的一致性。
原料采购、储存及运输管理规范
企业应建立原料采购管理制度, 确保采购的原料符合质量要求。
企业应建立原料进货查验记录制 度,如实记录原料的名称、规格、 数量、生产日期等内容,并保存 相关凭证。
食盐专营制度在行业发展中的作 用和影响
食盐行业面临的政策、市场等挑 战解析
提升自身专业素养,适应行业发展需求
01
加强食盐专营政策法规 学习,提高政策执行力
02
掌握食盐质量安全管理 知识,保障食盐安全供 应
03
了解食盐市场动态和消 费者需求,提升市场竞 争力
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2 开发海水中的卤素资源
哪些元素是卤族元素?
❖ 元素周期表中第17纵行
氟、氯、溴、碘、砹。 F Cl Br I At
海底矿产资源: (蕴藏着大量的煤矿, 石油,天然气)
海洋生物资源: (20多万种生物) 海洋再生能源: (潮汐,波浪蕴藏着巨
大的能量) 海洋空间资源: (拥有辽阔空间,建造
人工岛) 海洋旅游资源: 海洋化学资源: (80多种元素)
海水中的化学资源
海水中铀多达45亿吨是已 知陆地铀矿储量的4500倍。 氘有50亿吨足够人类用上 千万年
含80多种元素,以氢、 氧、氯、钠、镁、硫、 钙、钾等较多。被称为 “元素的故乡”。
海洋中的矿产资源
大陆架的浅海海底: 石油、天然气、 煤、硫、磷等
近岸带的滨海砂矿: 砂、贝壳等建筑 材料和金属矿产
2. 氯化氢气体 a、物理性质
颜色状态:无色有刺激性气味的气体, 密度比空气大,在空气中形成白雾
溶解性:极易溶于水(1:500体积比) 能否设计实验来验证呢? 现象:烧瓶中有红色喷泉(石蕊)
水溶液呈酸性 HCl → H+ + Cl-
氯化氢溶于水形成喷泉的原理: 挤压胶头滴管,大量的氯化氢溶于几滴水中, 使烧瓶的压强急剧降低, 远远低于大气压强,打开止水夹 这样烧杯 中的液体沿着玻璃管喷入烧瓶, 形成美丽的喷泉。
(2) 粗盐(78%)中可溶性杂质和难溶性杂质的除去 ----精盐
物理方法:过滤——难溶性杂质
化学方法:——可溶性杂质
主要的杂质:Na2SO4(SO42-) 或 MgSO4(SO42-) MgCl2(Mg2+) CaCl2(Ca2+)
a.试剂选择(尽量不引入杂质,除杂不加杂)→ 形成沉淀
①、除SO42[BaCl2(稍过量)] SO42- + Ba2+ → BaSO4↓
2、电解液 NaOH(主要) NaCl(少)
(1) 如何检验有NaCl? HNO3 酸化的AgNO3
(2) NaOH 和 NaCl 分离 蒸发,冷却NaOH溶液,结晶析出
电解:直流电通过电解质溶液而发生 氧化还原反应的过程
三、重要的化工基本原料 盐酸和烧碱
1、盐酸的工业制法 (1)反应原理
通直流电
其它杂质: KCl ——结晶方法(溶解度) MgBr2(Br-) ——通Cl2, 加热,使Br2(g)挥发(以后讨论)
二、中国现代化工之母——氯碱工业(Cl2 NaOH) 1、电解饱和食盐水 [演示实验]
(1)电极名称
阳极(石墨棒):与直流电源正极相连 阴极(铁棒):与直流电源负极相连
(2)化学用品: 饱和NaCl (aq), 酚酞试液, 碘化钾淀粉溶液(或碘化钾淀粉试纸)
2NaCl+ 2H2O → 2NaOH+ H2 ↑ +Cl2↑
点燃或光照
H2 + Cl2 → 2HCl
点燃:安静燃烧
光照:爆炸
(2)装置
氯化氢合成塔 合成塔的内部结构
思考问题: (1)氢气和氯气能否混合后通入合成塔点燃?
氢气氯气混合点燃会爆炸
(2)观察合成塔示意图,氢气在外管,氯气在内管 能否将氢气和氯气通入的位置交换?为什么
? 不能,因为氯气在内管被氢气包围,可 以达到完全燃烧,从而不污染环境
合成塔 吸收塔
化学史话
• 吴蕴初简历-上海嘉定人
• 25岁
• • 28岁 • 32岁 • 37岁 • 38岁 • 58岁
•
在汉口汉阳铁厂任砖厂厂长。后在汉阳兵工厂任 理化课课长及制药课(制炸药)课长。 在汉口任燮昌火柴厂工程师兼厂长。 成立天厨味精公司,任经理、技师。 当选为中华化学工业会副理事长。 成立上海天原电化厂股份有限公司,任总经理。 任华东军政委员会委员、上海市人民政府委员、 上海市文史研究馆委员等职务。
【步骤】 结合P24思考与讨论
1、称量(10.0 g粗盐) 20℃时,SNaCl = 36 g/100 g 水
2、溶解 玻璃棒搅动,加快溶质溶解速率
3、过滤 一贴 二低 三靠 玻璃棒将被过滤的液体引流到过滤器中
4、蒸发 加热时用玻璃棒搅拌,较多食盐析出,少量残液用余热或小火 蒸干,防止NaCl 颗粒飞溅出来 5、洗涤 6、烘干 7、称量 有时需用玻璃棒将盐转移到指定容器中称量
2.1 以食盐为原料的化工产品
一、海水晒盐—盐田法 1.方法:蒸发溶剂法
纳潮—引海水入盐田 制卤—利用日光、风力蒸发水分浓缩 结晶—饱和析出食盐结晶
2、海水的成份和海水浓缩制盐密度的控制
海水的密度控制:1.21--1.26g/mL 目的:大量析出氯化钠,又要使杂质析出少
3、粗盐提纯---设计实验方案
c. 顺序
Ø Na2CO3应在BaCl2后面,可除多余的Ba2+ Ø HCl应在OH- 、CO32- 后,气泡不再产生 PH=7
CO32- + 2H+ → CO2↑+ H2O H+ + OH- → H2O
可行的顺序 ①BaCl2 ②NaOH ③ Na2CO3 ④HCl
或① NaOH ② BaCl2 ③ Na2CO3 ④ HCl
(3)现象和电极反应式 阳极: 2Cl- - 2e → Cl2↑ 氧化反应
气泡、黄绿色气体、有刺激性气味,湿润的KI淀粉试纸变蓝色
阴极: 2H+ + 2e → H2↑ 还原反应 阴极附近先红?有气源自,检验有轻微的爆鸣声通直流电
总反应:2NaCl + 2H2O
2NaOH + H2↑+ Cl2↑
阴极 阴极 阳极
检验SO42-是否去除,取上层清液,再加BaCl2, 无沉淀 ②、除Mg2+
[NaOH] Mg2+ + 2OH- → Mg(OH)2↓ ③、除Ca2+
[Na2CO3 ] Ca2+ + CO32- → CaCO3↓ Ba2+ + CO32- → BaCO3↓
离子方程式:用实际参加反应的离子表示的式子
b.用量(多引入Ba2+, OH-, CO32-) 引入新杂质,又如何去除?
粗盐特征:含有少量泥沙、可溶性的杂质 设计要求:原理是什么?
试剂及仪器是哪些? 实验步骤有哪些? 实验反思 (包含定量误差分析及问题讨论)
原理:泥沙不溶于水,可以进行溶解过滤除去,对蒸发后 得到的晶体进行洗涤,可除去其他可溶性的盐。 【实验用品】
天平(托盘天平,精确到0.1 g)(电子天平,精确到0.001 g) , 烧杯(100 mL,2只), 100 mL量筒 (读数,仰视小,俯视大), 玻璃棒,漏斗,滤纸,酒精灯, 蒸发皿(铁架台,铁圈,火柴,剪刀)
哪些元素是卤族元素?
❖ 元素周期表中第17纵行
氟、氯、溴、碘、砹。 F Cl Br I At
海底矿产资源: (蕴藏着大量的煤矿, 石油,天然气)
海洋生物资源: (20多万种生物) 海洋再生能源: (潮汐,波浪蕴藏着巨
大的能量) 海洋空间资源: (拥有辽阔空间,建造
人工岛) 海洋旅游资源: 海洋化学资源: (80多种元素)
海水中的化学资源
海水中铀多达45亿吨是已 知陆地铀矿储量的4500倍。 氘有50亿吨足够人类用上 千万年
含80多种元素,以氢、 氧、氯、钠、镁、硫、 钙、钾等较多。被称为 “元素的故乡”。
海洋中的矿产资源
大陆架的浅海海底: 石油、天然气、 煤、硫、磷等
近岸带的滨海砂矿: 砂、贝壳等建筑 材料和金属矿产
2. 氯化氢气体 a、物理性质
颜色状态:无色有刺激性气味的气体, 密度比空气大,在空气中形成白雾
溶解性:极易溶于水(1:500体积比) 能否设计实验来验证呢? 现象:烧瓶中有红色喷泉(石蕊)
水溶液呈酸性 HCl → H+ + Cl-
氯化氢溶于水形成喷泉的原理: 挤压胶头滴管,大量的氯化氢溶于几滴水中, 使烧瓶的压强急剧降低, 远远低于大气压强,打开止水夹 这样烧杯 中的液体沿着玻璃管喷入烧瓶, 形成美丽的喷泉。
(2) 粗盐(78%)中可溶性杂质和难溶性杂质的除去 ----精盐
物理方法:过滤——难溶性杂质
化学方法:——可溶性杂质
主要的杂质:Na2SO4(SO42-) 或 MgSO4(SO42-) MgCl2(Mg2+) CaCl2(Ca2+)
a.试剂选择(尽量不引入杂质,除杂不加杂)→ 形成沉淀
①、除SO42[BaCl2(稍过量)] SO42- + Ba2+ → BaSO4↓
2、电解液 NaOH(主要) NaCl(少)
(1) 如何检验有NaCl? HNO3 酸化的AgNO3
(2) NaOH 和 NaCl 分离 蒸发,冷却NaOH溶液,结晶析出
电解:直流电通过电解质溶液而发生 氧化还原反应的过程
三、重要的化工基本原料 盐酸和烧碱
1、盐酸的工业制法 (1)反应原理
通直流电
其它杂质: KCl ——结晶方法(溶解度) MgBr2(Br-) ——通Cl2, 加热,使Br2(g)挥发(以后讨论)
二、中国现代化工之母——氯碱工业(Cl2 NaOH) 1、电解饱和食盐水 [演示实验]
(1)电极名称
阳极(石墨棒):与直流电源正极相连 阴极(铁棒):与直流电源负极相连
(2)化学用品: 饱和NaCl (aq), 酚酞试液, 碘化钾淀粉溶液(或碘化钾淀粉试纸)
2NaCl+ 2H2O → 2NaOH+ H2 ↑ +Cl2↑
点燃或光照
H2 + Cl2 → 2HCl
点燃:安静燃烧
光照:爆炸
(2)装置
氯化氢合成塔 合成塔的内部结构
思考问题: (1)氢气和氯气能否混合后通入合成塔点燃?
氢气氯气混合点燃会爆炸
(2)观察合成塔示意图,氢气在外管,氯气在内管 能否将氢气和氯气通入的位置交换?为什么
? 不能,因为氯气在内管被氢气包围,可 以达到完全燃烧,从而不污染环境
合成塔 吸收塔
化学史话
• 吴蕴初简历-上海嘉定人
• 25岁
• • 28岁 • 32岁 • 37岁 • 38岁 • 58岁
•
在汉口汉阳铁厂任砖厂厂长。后在汉阳兵工厂任 理化课课长及制药课(制炸药)课长。 在汉口任燮昌火柴厂工程师兼厂长。 成立天厨味精公司,任经理、技师。 当选为中华化学工业会副理事长。 成立上海天原电化厂股份有限公司,任总经理。 任华东军政委员会委员、上海市人民政府委员、 上海市文史研究馆委员等职务。
【步骤】 结合P24思考与讨论
1、称量(10.0 g粗盐) 20℃时,SNaCl = 36 g/100 g 水
2、溶解 玻璃棒搅动,加快溶质溶解速率
3、过滤 一贴 二低 三靠 玻璃棒将被过滤的液体引流到过滤器中
4、蒸发 加热时用玻璃棒搅拌,较多食盐析出,少量残液用余热或小火 蒸干,防止NaCl 颗粒飞溅出来 5、洗涤 6、烘干 7、称量 有时需用玻璃棒将盐转移到指定容器中称量
2.1 以食盐为原料的化工产品
一、海水晒盐—盐田法 1.方法:蒸发溶剂法
纳潮—引海水入盐田 制卤—利用日光、风力蒸发水分浓缩 结晶—饱和析出食盐结晶
2、海水的成份和海水浓缩制盐密度的控制
海水的密度控制:1.21--1.26g/mL 目的:大量析出氯化钠,又要使杂质析出少
3、粗盐提纯---设计实验方案
c. 顺序
Ø Na2CO3应在BaCl2后面,可除多余的Ba2+ Ø HCl应在OH- 、CO32- 后,气泡不再产生 PH=7
CO32- + 2H+ → CO2↑+ H2O H+ + OH- → H2O
可行的顺序 ①BaCl2 ②NaOH ③ Na2CO3 ④HCl
或① NaOH ② BaCl2 ③ Na2CO3 ④ HCl
(3)现象和电极反应式 阳极: 2Cl- - 2e → Cl2↑ 氧化反应
气泡、黄绿色气体、有刺激性气味,湿润的KI淀粉试纸变蓝色
阴极: 2H+ + 2e → H2↑ 还原反应 阴极附近先红?有气源自,检验有轻微的爆鸣声通直流电
总反应:2NaCl + 2H2O
2NaOH + H2↑+ Cl2↑
阴极 阴极 阳极
检验SO42-是否去除,取上层清液,再加BaCl2, 无沉淀 ②、除Mg2+
[NaOH] Mg2+ + 2OH- → Mg(OH)2↓ ③、除Ca2+
[Na2CO3 ] Ca2+ + CO32- → CaCO3↓ Ba2+ + CO32- → BaCO3↓
离子方程式:用实际参加反应的离子表示的式子
b.用量(多引入Ba2+, OH-, CO32-) 引入新杂质,又如何去除?
粗盐特征:含有少量泥沙、可溶性的杂质 设计要求:原理是什么?
试剂及仪器是哪些? 实验步骤有哪些? 实验反思 (包含定量误差分析及问题讨论)
原理:泥沙不溶于水,可以进行溶解过滤除去,对蒸发后 得到的晶体进行洗涤,可除去其他可溶性的盐。 【实验用品】
天平(托盘天平,精确到0.1 g)(电子天平,精确到0.001 g) , 烧杯(100 mL,2只), 100 mL量筒 (读数,仰视小,俯视大), 玻璃棒,漏斗,滤纸,酒精灯, 蒸发皿(铁架台,铁圈,火柴,剪刀)
