鲁科-化学反应原理-第1节 化学反应的热效应
2021-2022学年鲁科版选修4 第一章 第一节 化学反应的热效应(第1课时) 教案

第一节化学反应的热效应第一课时化学反应和反应热【教学目标】学问与技能目标:通过对化学反应热效应相关学问的学习,使同学能在定量的水平上重新生疏与描述化学反应的能量变化。
过程与方法目标:通过“联想.质疑”等活动,训练同学的思维力量;通过“活动探究”等实践活动,对同学进行定量试验的基本训练;通过“沟通研讨”等同学互动和师生互动活动,培育同学的动手、动脑力量以及猎取、分析处理、归纳信息的力量;通过阅读“拓展视野”“资料在线”“方法导引”“追根寻源”等资料,扩高校生的学问面,增加同学全面的力量。
情感态度价值观目标使同学能从能量角度比较深刻的了解化学科学对人类的贡献,通过进一步了解化学的争辩特点,激发学习的爱好,建立基本的化学科学思维。
【教学过程】一、新课引入教学环节老师活动同学活动设计意图引入:走进化学反应原理初步体会:通过视频引入,增加同学学习化学反应原理的爱好。
初步介绍学科观念。
试验探究演示试验:1.点燃镁条;2.冰袋的奇特:氯化铵氢氧化钡用牢固的塑料袋代替烧杯,称1.观看,思考能量的转化形式。
2.用手感觉塑料袋温度的变化状况。
留意事项:所用塑把反应热这一抽象的概念以具体的试验呈现出来,初步建立教学环节老师活动同学活动设计意图学问回顾取2 g氯化铵晶体倒人塑料袋中,从中间系扎。
再称4 g粉末状氢氧化钡晶体加人袋中用线绳扎紧密封备用(如上图所示)。
上课时解开中间的绳子,并用手轻轻搓揉使之混匀。
然后传给同学。
料袋必需牢固,不能在搓揉中弄破而腐蚀手臂。
思考:能量转化的形式与试验一的不同之处。
探究反应热的试验方法。
让同学学会自我反思,指明困惑点,明确学习目标。
二、化学反应的反应热环节老师活动同学活动设计意图提问引入【联想●质疑】化学反应中常伴随有能量变化,结合前面学问思考:1、化学反应中为什么有能量变化?2、哪些反应是放热反应?哪些反应是吸热反应?3、如何定量描述一个化学反应释放或吸取的热量?4、用什么方法可以精确地测量这些热量?【投影】1.下列对化学反应热现象的说法不正确的是()A.放热反应时不必加热B.化学反应肯定有能量变化C.一般地说,吸热反应加热后才能发生D.化学反应的热效应的数值与参与反应的物质的多少有关【归纳、回忆】常见的放热反应和吸热反应⑴常见的放热反应①活泼金属与水或酸的反应。
【化学】鲁科版选修4《化学反应原理》教案:第1章章节复习及练习讲评(第1课时)

章节复习及练习讲评知识与能力:1.建立化学反应中能量变化的观点,了解吸热反应和放热反应,并会正确书写热化学方程式;2.学会利用题目中所提供的信息,对电解池、原电池等电解原理实际应用的电极材料和电极反应式判断和书写;3.解决好电子转移的关系来完成电解有关计算。
过程与方法:通过知识点的简单回顾,以及考点的归纳分析,进一步在练习上加深对知识点的认识,在讲评中强化一些概念和多增加一些注意点,以协助和补充对课本内容的理解和掌握。
然后通过抓主干去枝叶来拓展思维,在头脑这高层领域里对知识点的有新的认识。
情感态度与价值观:养成循序渐进的思维历程,在研究和探讨中激发起学习的兴趣。
课型:练习研讨课教学重难点:旨在让学生了解考点以及对练习的把握,如何能够将知识融会贯通,在解决问题的过程中能够积极开动脑筋。
课时安排:2课时教学过程:(第一课时)【考点归纳】本章教科书以“能量转化”为主线,首先学习了通过实验测定方法和理论方法来定量描述化学反应的热效应,然后学习了化学能与电能相互转化的两种具体形式:一是电能转化为化学能—电解;二是化学能转化为电能—电池。
(一起阅读P26--27)【考点一】化学反应的热效应1.建立化学反应中能量变化的观点,了解吸热反应和放热反应2.书写热化学方程式应注意的问题【考点二】电解原理极其应用1.电解池判断2.电极反应3.电解有关计算的方法规律【考点三】原电池工作原理极其应用1.原电池判断2.电极反应3.化学电源【题1】下列各项与反应热的大小无关的是(D)A.反应物的状态B.生成物的状态C.反应物的多少D.表示反应热的单位【解析】反应热指化学反应在一定的温度下进行时,反应所释放或吸收的热。
反应热与反应物的物质的量成正比。
与物质状态有关,与表示反应热的单位无关。
【题3】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是(A)A.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=-4b kJ•mol-1B.C2H2(g)+5/2O2(g)==2CO2(g)+H2O(l) ΔH=-2b kJ•mol-1C.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=-2b kJ•mol-1D.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=b kJ•mol-1【解析】放热反应中ΔH <0,所以B、D错误。
化学反应原理第1章第1节化学反应的热效应

1mol
C→CO2 H→H2O(l) N→N2 S→SO2等。
不一定是1mol 生成的水为1mol
相 同 点
能量变化
放热反应
△Q<0 单位:kJ/mol 讲燃烧热或中和热的大小:不带“-”号
△Q
1、下列热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热Δ H=-57.3kJ/mol, 则H2SO4和Ca(OH)2反应的中和热Δ H=2×(-57.3)kJ/mol
一、化学反应的反应热
1、定义:当化学反应在一定的温度下进 行时,反应所释放或吸收的热量称为该反 应在此温度下的热效应,简称为反应热。 2、符号:用Q表示 Q<0,表示放热;Q>0,表示吸热; 3、单位:J/mol或kJ/mol 4、测量工具:许多化学反应的反应热可 以直接测量,其测量仪器叫做量热计
4.表示的意义:
例如:C的燃烧热为393.5kJ/mol(叙述燃烧热时,用正值), 表示: 在101kPa时1molC完全燃烧放出393.5kJ的热量。 ★ ★ ★燃烧热是以1mol物质完全燃烧放出的热量来 定义的,因此在书写它的热化学方程式时,应以燃 烧1mol物质为标准来配平其余物质的系数。例如:
1mol
~ 285.8 kJ
H2(g)+ 2 O2(g)=H2O(l) 2H2(g)+ O2(g)=2H2O(l)
1
△H(298K)=
-285.8 kJ· -1 mol -571.6 kJ· -1 mol
△H(298K)=
2mol
~
571.6 kJ
H2O(l)=H2(g)+ 1/2 O2(g) △H(298K)= + 285.8 kJ· -1 mol
高中化学化学反应的热效应知识精讲 鲁教版

高中化学化学反应的热效应知识精讲鲁教版一. 本周教学内容:《化学反应原理》第1章化学反应与能量变化第1节化学反应的热效应教学目的:1、了解化学反应中能量变化的特点及原因。
2、理解反应热、焓变的含义及其表示方法。
3、掌握热化学方程式的书写和意义。
4、理解盖斯定律,并能运用盖斯定律计算化学反应的焓变。
二. 重点、难点:焓变与热化学方程式的含义三. 知识分析在日常生活、生产中,人们广泛利用一些化学反应释放的能量,如何定量描述一个化学反应释放或吸收的热量呢?用什么方法可以测定、计算这些热量呢?(一)化学反应的反应热1、定义:化学上规定,当化学反应的反应物与产物的温度相同时,反应所吸收或释放的能量称为该反应在此温度下的热效应,简称反应热。
2、表示符号:通常用Q表示,且反应放热时,反应体系减少热量,Q为负;反应吸热时,反应体系增加热量,Q为正。
3、决定因素:对于一个给定的化学反应,反应热与反应物的物质的量、状态及反应条件(如温度、压强、溶液的浓度等)有关。
4、测量方法:反应热的数据可以用量热计测量。
在测量反应热的实验中,反应吸收或放出的热量可以通过反应前后体系温度的变化来计算:Q=-C(T2-T1)其中,C代表溶液及量热计的热容,T2、T1分别代表反应前和反应后体系的热力学温度(T=t +273.15℃)。
(二)化学反应的焓变1、焓变(1)定义:为了描述与反应热有关的能量变化,引入了一个叫做“焓”的物理量,产物的总焓与反应物的总焓之差,称为化学反应的焓变。
用焓变来描述与反应热有关的能量变化。
(2)表达式:△H =H(产物)-H(反应物)(3)焓变与反应热的关系:如果化学反应过程中发生的是等压反应,而且没有电能、光能等其他形式能量转化,则反应热等于反应焓变,即Qp=△H。
从上面的关系式可以看出:当△H>0时,产物总焓大于反应物总焓,反应是吸收能量的,为吸热反应;相反△H<0时,为放热反应。
2、热化学方程式(1)概念:将物质变化和反应热同时表示出来的化学方程式称为热化学方程式。
化学反应的热效应++课件++2022-2023学年高二上学期化学鲁科版(2019)选择性必修1

2、符号:Q Q > 0,表示吸热 Q < 0,表示放热
3、单位:J 或 kJ
反应热的数值可以通过实验测得,也可以通过理论计 算求得。
反应热的计算
键能:断裂1 mol化学键吸收的能量或形成1 mol化学键释放的能量。
Q=Σ反应物键能-Σ反应产物键能 注意系数和化学键数目
应(填“放热”或“吸热”)。
Q=280 kJ+3×160 kJ-330 kJ×6
(二)反应热的测定(中和反应)
1、装置: 量热计
测量反应前后溶 液温度的变化值
内筒:反应容器
使反应充分进行, 体系的温度均匀
外筒:起保温作用
保温、隔热, 减少热量损失
金属是热的良导体而玻璃不是,选用玻璃材质搅拌器可减少 反应过程中热量的损失,减少实验误差。
放热反应
化学能
热能(主要) 光能 电能 机械能
吸热反应
2.哪些反应是放热反应?哪些反应是吸热反应?
常见的放热反应:
常见的吸热反应:
①大多数化合反应;
①大多数分解反应;
②酸碱中和反应;
②铵盐与碱的反应,如
③所有燃烧反应;
Ba(OH)2·8H2O或Ca(OH)2与NH4Cl
④活泼金属跟水或酸的反应; 的反应;
⑤物质的缓慢氧化(钢铁腐蚀 、食物腐败); ⑥铝热反应
③以C、H2、CO为还原剂的氧化 还 原 反 应 , 如 C 与 H2O(g) 的 反 应 ,C与CO2的反应; ④NaHCO3 与 柠 檬 酸 、 盐 酸 的 反
应。
吸热反应、放热反应与反应条件无必然联系。
化学反应一定伴随能量变化,有能量变化的不一定是 化学反应。(如三态变化、浓硫酸稀释、强碱溶解)
《化学反应原理》复习知识清单1-4章
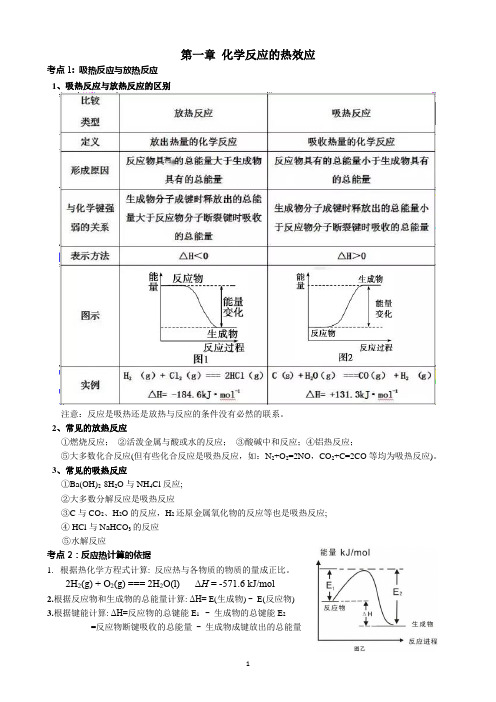
第一章化学反应的热效应考点1: 吸热反应与放热反应1、吸热反应与放热反应的区别注意:反应是吸热还是放热与反应的条件没有必然的联系。
2、常见的放热反应①燃烧反应;②活泼金属与酸或水的反应;③酸碱中和反应;④铝热反应;⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应①Ba(OH)2·8H2O与NH4Cl反应;②大多数分解反应是吸热反应③C与CO2、H2O的反应,H2还原金属氧化物的反应等也是吸热反应;④ HCl与NaHCO3的反应⑤水解反应考点2:反应热计算的依据1.根据热化学方程式计算: 反应热与各物质的物质的量成正比。
2H2(g) + O2(g) === 2H2O(l) ΔH = -571.6 kJ/mol2.根据反应物和生成物的总能量计算: ΔH= E(生成物) - E(反应物)3.根据键能计算:ΔH=反应物的总键能E1 - 生成物的总键能E2=反应物断键吸收的总能量- 生成物成键放出的总能量4.根据盖斯定律计算:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
如图:ΔH 1=ΔH 2+ΔH 3盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
5.根据物质燃烧热进行计算6.中和热测定实验原理:中和热ΔH =-第二章 化学反应速率与化学平衡考点1:化学反应速率 1、化学反应速率的表示方法其常用的单位是mol/(L·min) 或 mol/(L·s) 2、影响化学反应速率的因素1)内因(主要因素):反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)3、理论解释——有效碰撞理论 (1)活化分子、活化能、有效碰撞①活化分子:具有足够能量、能引发有效碰撞的分子。
②活化能:E 1为正反应的活化能,E 2为逆反应的活化能 E 3为使用催化剂时的活化能反应热ΔH =E 1-E 2。
《化学反应原理》第一章第一节化学反应的热效应

第一章第1节化学反应的热效应【基础知识梳理】1.写出298K时,下列反应的热化学方程式:(1)3molNO2(g)与1molH2O(l)反应生成HNO3(aq)和NO(g),放热138kJ。
(2)用CO(g)还原1molFe2O3(s),放热24.8 kJ。
(3)1molHgO(s)分解为液态汞和氧气,吸热90.7 kJ。
2.请解释下述热化学方程式表示的含义:4NH3 (g) + 5O2(g) == 4NO(g) + 6H2O(g) △H= -950 kJ·mol-1若将此化学方程式中各物质的系数均乘以2,应如何书写热化学方程式?3. 回答下列问题:(1)H2(g) + Cl2(g) == 2 HCl (aq) ①H2(g) + Cl2(g) == 2 HCl (g) ②在相同温度下,反应①比反应②释放的能量多,为什么?(2)CH2 = CH2 (g) + H2(g) == CH3 CH3(g) ③CH3CH2 = CH2 (g) + H2(g) == CH3CH2CH3(g) ④在相同条件下,反应③和反应④释放的能量几乎相等,从化学键的角度分析,原因是什么?【能力提升】问题1.已知C(S,石墨) + O2(g)==CO2(g),△H1=-393.5 kJ·mol-1CO (g) +1/2 O2(g) ==CO2(g),△H2=-283.0 kJ·mol-1试利用298K时上述反应焓变的实验数据,计算此温度下C(s, 石墨)+1/2 O2(g)==CO (g)的反应焓变。
问题2.已知C(S,石墨) + O2(g) ==CO2(g),△H1= -393.5 kJ·mol-12H2(g) + O2(g) ==H2O (l),△H2= -571.6 kJ·mol-12C2H2(g) + 5O2(g) == 4CO2(g)+2H2O (l),△H3= -2599kJ·mol -1试利用298K时上述反应焓变的实验数据,计算此温度下C(s, 石墨)和H2(g)生成1mol C2H2(g)的反应焓变。
鲁科版高中化学选修-化学反应原理:化学反应的热效应_课件1(2)

本
课 试回答下列问题:
时
栏 (1)大小烧杯间填满碎泡沫塑料的作用是______________。
目 开
(2)________(填“能”或“不能”)将环形玻璃搅拌棒改为
关
环形铜棒。其原因是
。
(3)大烧杯上如不盖泡沫塑料盖板,对求得反应热数值的影
响是________(填“偏高”、“偏低”或“无影响”)。
③硫酸与氢氧化钠溶液混合 ④燃烧煤炭取暖 ⑤钠与
本
水反应 ⑥胆矾受热失去结晶水,其中为吸热反应的是
课 时
②⑥ ,放热反应的是 ①③④⑤ 。
栏
目
开
关
学习·探究区
探究点一 化学反应的反应热
1.化学反应中存在两大变化,即 物质 变化和 能量 变化。由于
本 课
拆开不同的化学键 消耗 的能量 不同,形成不同的化学键
本 盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是
课
时 1 g·cm-3,反应后溶液的比热容 C=4.18 J·g-1·℃-1。该实验
栏
目 开
中盐酸和 NaOH 溶液反应放出的热量是 0.418(T2-T1)kJ ,
关 中和反应的反应热为 16.72(T2-T1)kJ·mol-1(或Q=
0.418T2 T1
本 课
(3)偏低
时 栏
(4)增加 反应消耗的酸、碱增多,放出热量增加
目
开
关
学习·探究区
本 课 时 栏 目 开 关
自我·检测区
1.下列说法不正确的是
(B)
A.化学反应除了生成新物质外,都伴随着能量的变化
本 课
B.放热反应不需要加热就可以发生
时 栏
C.反应条件是加热的反应不一定都是吸热反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
?
CO (g)+1/2 O2(g) C(s)+1/2O2(g)=CO(g) ΔH =-110.5 kJ/mol
应用了什么规律?
① C(s)+1/2O2(g)==CO(g) ② CO(g)+1/2O2(g)== CO2(g)
单位:kJ/mol
反应产物 焓
△H>0
反应物
反应吸热
焓
反应物
△H<0
反应产物
反应放热
反应中为什么会有能量的变化?
宏观:能量守恒作用
微观:断键,成键作用;
旧键断裂 新键生成
水由高处向低处流要释放能量 将水由低处抽向高处需提供能量 (电能转换为机械能,再转换为势能) (势能转换为动能)
反应物的总能量高
B、酸碱中和 C、二氧化硫与氧气反应生成三氧化硫 √D、焦炭与高温水蒸气反应
二、化学反应的焓变
物质所具有的能量是物质固有的性质 “焓”是用于描述物质所具有的能量的物理量, 符号:H 符号:△H
△H
能量
△H=H(反应产物)-H(反应物)
反应焓变:反应产物的总焓与反应物的总焓之差
>0,反应为吸热反应;△H<0,反应放热。
一、化学反应的反应热
1、什么是反应热? 2、反应热的符号是什么? 怎样表示反应吸、放热? 3、反应热的单位是什么 4、如何获得一个反应的反应热?
活动●探究
测定中和反应的反应热 1、仪器:
量热计、量筒(100mL)、温度计、烧杯(250mL)
2、药品:
1.0mol/L的盐酸 1.0mol/L的NaOH溶液 1.0mol/L的盐酸 1.0mol/L的KOH溶液 1.0mol/L的硝酸 1.0mol/L的NaOH溶液
生成物的总能量高
放 热 反 应
生成物的总能量低
吸 热 反 应
反应物的总能量低
反应物的总能量=生成物的总能量+放出的热量 生成物的总能量=反应物的总能量+吸收的热量
化学反应的过程,可以看成是能量的 “贮存”或“释放”的过程!
观察:
1、从该图你获得什么信息? 2、你能计算出该反应过程中能量的变化吗?
把1molH2拆开为2molH原子,吸热436kJ 把1molCl2拆开为2molCl原子,吸热243kJ
H2O(l) =H2O(g) H2(g)+
△H(298K)=
44 kJ· -1 mol -241.8 kJ· -1 mol
1 O (g)=H2O(g) 2 2
△H(298K)=
H2(g)+
1 O (g)=H2O(l) 2 2
△ H1=
-285.8 kJ· -1 mol -571.6 kJ· -1 mol
△H(298K)=
-184.6 kJ/mol
kJ/mol
kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H(298K)=-890.3
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
△H(298K)=-57.3
1mol
~ 285.8 kJ
H2(g)+ 2 O2(g)=H2O(l) 2H2(g)+ O2(g)=2H2O(l)
2H2(g)+O2(g)=2H2O(g)
D、 S(g)+O2(g)=SO2 (g) S(s)+O2(g)=SO2 (g)
△H= - Q2
△H= - Q1 △H= - Q2
练一练
1、在同温同压下,下列各组热化学方程式中,请比较△H1 △H2的大小
A、 H2(g)+Cl2(g)=2HCl(g)
1 2
△ H1
G.H.Germain Henri Hess (1802~1850)瑞士化学家。1802年8 月7日生于瑞士日内瓦,1850年12月12日卒于俄国圣彼得堡(现 为列宁格勒)。3岁随父侨居俄国,并在俄国受教育。1825年于多 尔帕特大学获医学专业证书,同时受到了化学和地质学的基础教 育。1826~1827年,在斯德哥尔摩J.J.贝采利乌斯的实验室工 作并从其学习化学。回俄国后在乌拉尔作地质勘探工作,后在伊 尔库茨克做医生并研究矿物。1830年当选为圣彼得堡科学院院 士,专门研究化学,任圣彼得堡工艺学院理论化学教授并在中央 师范学院和矿业学院讲授化学。1838年成为俄国科学院院士。 盖斯早期研究了巴库附近的矿物和天然气;发现了蔗糖氧化生成 糖二酸。他研究了炼铁中的热现象,作了大量的量热工作。 1836年发现,在任何一个化学反应过程中,不论该反应过程是一 步完成还是分成几步完成,反应所放出的总热量相同,并于1840 年以热的加和性守恒定律公诸于世,后被称为盖斯定律。此定律 为能量守恒定律的先驱。当一个反应不能直接发生时,应用此定 律可间接求得反应热。因此,盖斯也是热化学的先驱者。著有 《纯粹化学基础》(1834),曾用作俄国教科书达40年。
练习
下列说法正确的是 (
B )
A、物质发生反应时放出的热量来源于对反应的加热
B、化学反应除了生成新物质外,还发生能量变化。 C、化学反应中放出的热才是反应热
D、需要加热方能发生的反应一定是吸热反应
下列变化中,属于放热反应的是( ) A、Ba(OH)2· 2O与NH4Cl的反应 8H √B、点燃的镁条在二氧化碳中继续燃烧 C、灼热的碳与二氧化碳的反应 D、氯化铝的水解 下列变化中,属于吸热反应的是( A、氮气与氢气合成氨 )
O2(g)=H2O(g) D、2H2(g)+O2(g)=2H2O(g)
△H=-484 △H=+242 △H=+484
kJ· -1 mol
kJ· -1 mol kJ· -1 mol
3、已知在298K、101kPa下,1gC8H18(辛烷)燃烧生 成二氧化碳和液态水时放出48.40kJ 热量。表示 上述反应的热化学方程式正确的是( B ) 25 A、C8H18(l)+ 2 O2(g)=8CO2(g) +9H2O(g) △H= - 48.40 kJ· mol -1 B、C8H18(l)+ 25 O2(g)=8CO2 (g) +9H2O(l) 2 △H= - 5518 kJ· mol -1 C、C8H18(l)+ 25 O2(g)=8CO2(g) + 9H2O(l) 2 △H= + 5518 kJ· mol -1 D、C8H18(l)+ 25 O2(g)=8CO2 (g)+ 9H2O(l) 2 △H= - 48.40 kJ· mol -1
☆从微观角度去考虑:
反应物分子断键时吸收的能量
< >
生成物分子成键时释放的能量
放热反应
反应物分子断键时吸收的能量
生成物分子成键时释放的能量
吸热反应
☆热化学方程式:
1、概念:能够把一个化学反应中物质的变化和反应的 焓变同时表示出来的化学方程式叫做热化学方程式。
H2(g)+Cl2(g)=2HCl(g)
例题
25℃、101kPa时,使1.0 g钠与足量的氯气反应, 生成氯钠晶体并放出17.87 kJ的热量,求生成1 mol氯化钠的反应热。
写出该反应的热化学方程式
1 Na(s)+ Cl2(g)=NaCl(s) 2
△H=-411
kJ· -1 mol
三、反应焓变的计算
讨论: C(s)+1/2O2(g)==CO(g) ΔH1=?
1
△H(298K)=
-285.8 kJ· -1 mol -571.6 kJ· -1 mol
△H(298K)=
2mol
~ 571.6 kJ
2、书写热化学方程式应注意以下几点
教材第7页
固态
吸热
吸热
液态
吸热
气态
H2(g)+
1 O (g)=H2O(l) 2 2
△H(298K)=
-285.8 kJ· -1 mol
2H2(g)+ O2(g)=2H2O(l)
△ H2=
△ H2
= 2× △H1
△H的表示:
热化学方程式中的△H的“+”与“-”一定要注明, “+”代表吸热, “-”代表放热
无论热化学方程式中化学计量数为多少,△H的单位总是 KJ· -1,但△H的数值与反应式中的系数成比例 mol
3、热化学方程式表示的意义 质→量→能
△H1=? △H2=-283.0kJ/mol △H3=-393.5kJ/mol
③ C(s)+O2(g)==CO2(g)
①+②=③ 则 △H1 + △H2 =△H3
所以, △H1 =△H3- △H2
=-393.5kJ/mol-(- 283.0kJ/mol) =-110.5kJ/mol
不管化学反应是分一步完成 或分几步完成,其反应热是相同 的。 化学反应的反应热只与反应 体系的始态和终态有关,而与反 应的途径无关。
△ H2
△ H1 △ H2
2、已知在1×105Pa,298K条件下,2mol氢气 燃烧生成水蒸气放出484kJ热量,下列热化 学方程式+
C、H2(g)+
1 2
1 2
O2(g)
△H=+242
kJ· -1 mol
B、2H2(g)+O2(g)=2H2O(l)
( B )
1 2
A、 H2(g)+Cl2(g)=2HCl(g)
H2(g)+ B、C(s)+1/2O2(g)=CO (g) C(s)+O2(g)=CO2 (g) C、2H2(g)+O2(g)=2H2O(l)
