高中化学竞赛第三讲主族元素4
高中化学竞赛课程设计

高中化学竞赛 课程设计一、课程目标知识目标:1. 掌握高中化学竞赛的核心知识点,包括有机化学、无机化学、物理化学和结构化学等,能运用所学知识解决竞赛中的问题。
2. 熟悉并掌握化学实验的基本技能,能够独立完成竞赛所需的实验操作。
技能目标:1. 培养学生运用化学知识分析和解决问题的能力,提高逻辑思维和创新思维能力。
2. 提高学生化学实验操作的准确性和熟练度,培养实验观察能力和实验数据的处理能力。
情感态度价值观目标:1. 培养学生对化学学科的兴趣和热情,激发学生学习化学的内驱力。
2. 培养学生的团队合作意识,学会在竞赛中相互学习、共同进步。
3. 增强学生的科学素养,培养严谨、求实的科学态度,树立环保意识和可持续发展观念。
课程性质:本课程为高中化学竞赛辅导课程,旨在提高学生的化学学科素养,培养具备竞争力的化学人才。
学生特点:学生具备一定的化学基础,对化学学科有兴趣,具备一定的自主学习能力和探究精神。
教学要求:结合学生特点和课程性质,采用讲授、实验、讨论等多种教学方法,注重培养学生的实践能力和创新精神,提高学生在竞赛中的竞争力。
通过分解课程目标为具体学习成果,便于教学设计和评估。
二、教学内容根据课程目标,教学内容主要包括以下几部分:1. 有机化学:涵盖烃、卤代烃、醇、酚、醚、酮、羧酸、酯等有机化合物的结构与性质,反应机理,合成方法等。
2. 无机化学:包括主族元素、过渡元素、无机化合物、配位化合物等的性质、制备及反应。
3. 物理化学:侧重热力学、动力学、电化学、胶体化学等基本原理及其在化学中的应用。
4. 结构化学:介绍原子、分子、晶体结构的基本理论,包括量子力学基础、化学键理论、分子轨道理论等。
5. 化学实验:包括基本操作技能、实验方法、数据处理及实验设计。
详细教学大纲如下:第一周:有机化学基础及烃的性质第二周:卤代烃、醇、酚、醚、酮、羧酸、酯等有机化合物的性质第三周:有机反应机理及合成方法第四周:无机化学基础及主族元素性质第五周:过渡元素、无机化合物、配位化合物第六周:物理化学基本原理第七周:结构化学基本理论第八周:化学实验操作技能及实验方法第九周:实验数据处理及实验设计第十周:复习与竞赛模拟教学内容与课本紧密关联,按照教学大纲安排和进度进行授课,确保内容的科学性和系统性。
高中化学无机化学竞赛辅导课件.ppt
• d区元素的化合物
• 离子极化对ds区元素化合物性质的影响
•
颜色
•
溶解
•
HgF2 HgCl2 HgBr2 HgI2 水解性质
• Hg2+ 与卤素及拟卤离子形成的配合物 HgX42-
• HgNH2X
4) 常见配位化合物及配位数 Cu(I) Cu(NH3)2+ CuCl3- Cu(CN)43Cu(II) 配位数通常为4 CuCl42- Cu(NH3)42+ Cu(CN)42Ag(I) 配位数通常为2 Ag(NH3)2+ Ag(S2O3)23- Ag(CN)2Zn(II) 配位数为4和6 ZnCl42- Zn(NH3)42+ Zn(NH3)62+ Cd(II) 常见配位数为4 Hg(II) 配位数为4 与卤素和类卤离子
• 氢键
•
强弱次序:
F—H ···F > O—H ···O > O—H ···N &g ···Cl > O—H ···S
特点: 是特殊的分子间作用力
具有方向性和饱和性
晶体结构
1. 晶格和点阵、晶胞 晶系:立方 四方 正交 单斜 三斜 三方 六方
2. 金属晶体—堆积 非密置层的堆积:简单立方和体心立方 密堆积:立方密堆—面心立方 六方密堆—六方晶胞 空间利用率及配位数
• 离子晶体 • CsCl 负离子成简单立方堆积,正离子占据立方体间隙。
NaCl 负离子成面心立方堆积,正离子占据八面体体间隙。
ZnS 负离子成面心立方堆积,正离子占据四面体间隙。
• 分子晶体
• 共价晶体
•
金刚石和石墨的结构
• 离子极化 • 离子的极化能力 • 离子的变形性 • 离子极化对键型和晶型的影响
高中化学竞赛辅导无机元素练习题

(1)确定A的结构简式。写出生成A的化学反应方程式。
(2)在室温或高于室温的条件下,A能定量地分解,产生B和C。已知B的阳离子的价电子总数比C的价电子总数少4。试确定B的结构简式,写出B中阴、阳离子各中心原子的杂化形态。
3为什么NF3常温不水解,而NCl3常温可以水解?写出水解产物。
九、回答下列关于磷的问题:
高中化学竞赛练习(无机化学主族元素)
第一章卤素
一、于酸性溶液中混合等物质的量的KBrO3和KI,生成哪些氧化还原产物,它们的物质量的比是多少?
(2)用漂白粉漂白物料时,常采用以下步骤:将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中;将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
(2)石硫合剂在空气中与H2O及CO2作用又生成具有杀虫作用的S,写出分步的反应方程式。
四.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。
1.氯化亚砜分子的几何构型是;中心原子采取杂方式,
是(等性、不等性)杂化。
2.写出亚硫酸钙和五氯化磷共热,制备氯化亚砜反应的化学方程式
3.氯化亚砜在有机化学中用作氯化剂,写出乙醇和氯化亚砜反应的化学方程式
1.写出N2O4在登月飞船的液体推进系统中所发生主要反应的方程式;
2.说明N2O4分子中N原子的杂化方式和成键情况;
3.画出偏二甲肼的构型。
4.写出我国长征系列火箭二元推进剂反应的化学方程式。
5.偏二甲肼可用二甲胺被亚硝酸氧化、再用锌还原来制备,写出各步反应方程式。
高中化学竞赛辅导全套课件

1.2.2 Cl2 1.2.2.1 制备
MnO2+4HCl=MnCl2+2H2O+Cl2↑ 2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑
电解:
2NaCl + 2H2O = 2NaOH+H2↑+Cl2↑
1.2.3 Br2和I2
(Ⅰ)海水→盐卤→Br2以空气吹出 Br-+BrO3- →Br2 10吨海水 0.14Kg Br2
质的只有HClO4 HIO3 HIO4 H5IO6
它们采取什么形式杂化,sp3 sp3d2
空间构型 Cl OH
O
O
Cl
O
OH
F
O
S
O
OH
1.5.2.1 次卤酸及其盐
XX´5
XX´7
Cl2+3F2=2ClF3 它们为分子晶体,熔沸点低,熔沸点随电负性差的增大而
增大,其中n和电负性差以及半径比有关
故XX´型有6种=C42 XX´7型有1种 IF7 XX´5型有3种 IF5 BrF5 ClF5 三种 XX´3型有5种IF3 BrF3 ClF3 ICl3 IBr3
高中化学竞赛辅导全套课件
按章节编排
成盐元素 ns2np5
F2的键能<Cl2
键能
F-F
kJ·mol-1 154.8
Cl-Cl 239.7
卤素
Br-Br I-I 192.9 151.2
§1-1 卤素的基本性质
成盐元素 ns2np5 1.电负性 I为2.66
说明I 的吸电子力不够,可有I+ I2+2Py(吡啶)=[IPy2]+ +1价 I2+O3+HClO4=I(ClO4) 32H2O +3价 测电导 2ICl=I++ICl2α=1%证明存在[I+]
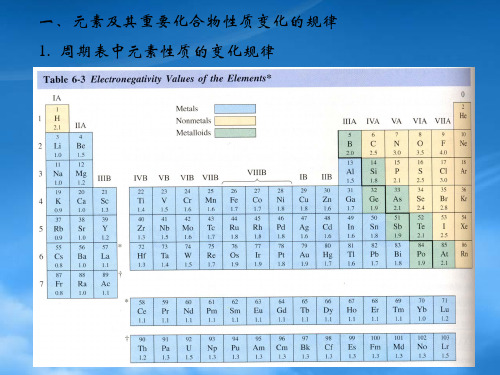
高中化学竞赛-元素周期表与元素周期律
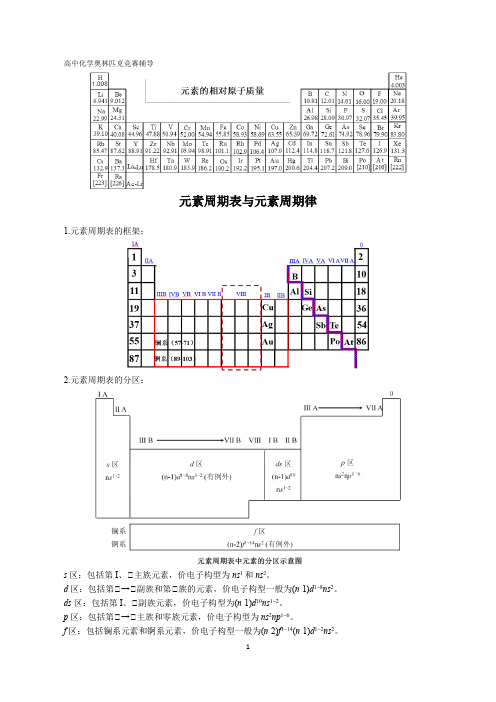
高中化学奥林匹克竞赛辅导元素周期表与元素周期律1.元素周期表的框架:2.元素周期表的分区:s区:包括第I、Ⅱ主族元素,价电子构型为ns1和ns2。
d区:包括第Ⅱ→Ⅱ副族和第Ⅱ族的元素,价电子构型一般为(n-1)d1~8ns2。
ds区:包括第I、Ⅱ副族元素,价电子构型为(n-1)d10ns1~2。
p区:包括第Ⅱ→Ⅱ主族和零族元素,价电子构型为ns2np1~6。
f区:包括镧系元素和锕系元素,价电子构型一般为(n-2)f1~14(n-1)d1~2ns2。
说明:(1)周期序数=原子的电子层数n。
第n周期含有元素的数目有以下规律:当n为偶数时,第n 周期含有元素的数目为(n+2)2/2;当n为奇数时,第n周期含有元素的数目为(n+1)2/2。
(2)主族元素的族序数=原子最外层电子数。
(3)对于d区元素,族序数=元素最高能级中的电子总数,如21Sc:[Ar]3d14s2是第Ⅱ B族,Mo:[Ar]3d64s2是第Ⅱ族。
26注意:如果元素最高能级组中的电子总数大于8,也属于第Ⅱ族,如Co、Ni等。
(4)对于ds区元素:族序数=原子最外层电子数,如29Cu:[Ar]3d104s1是第Ⅱ B族(5)d区和ds区元素均为副族元素,统称为过渡元素。
f区元素统称为内过渡元素。
3.元素周期律:原子半径、金属性、非金属性、电离能、电子亲合能、电负性。
4.原子半径:原子核的周围是电子云,它们是没有确定的边界的。
我们通常所说的原子半径是人为地规定的一种物理量。
原子半径可分为金属半径、共价半径、范德华半径三种。
共价半径是元素的两个原子以共价单键相连时,核间距离的一半。
稀有气体元素一般不能形成共价单键,所以用稀有气体分子晶体中两个原子距离的一半作为其半径,称为范德华半径。
范德华力不能像共价键一样将两个原子紧密结合,所以范德华半径大于共价半径,因此由于标准的不同,稀有气体的原子半径在同一周期的元素中半径是最大的。
金属单质的晶体中,相邻两金属原子核间距离的一半,称为该金属原子的金属半径。
高中化学竞赛第三讲主族元素4

他们的生成和pH值有关。 但并非pH越小越快,pH=6左右最快。
硅酸盐的结构特点:
总体,Si +4价,Si和O一定相连形成 SixOyn-的结构,它与阳离子形成离子键。 ⒈ SiO44-, 单个SiO4 Si:O = 1:4 ⒉ 两个SiO4以角氧相连
O Si O
O O
O Si O
O O
Si O OO
硼砂 Na2B4O7· 10H2O Na2[B4O5(OH)4]· 10H2O
OH O B- O HO B O BБайду номын сангаасOH O B- O OH
1. 动力学>>Ksp时,来不及选择,一起沉淀。 2. 热力学,Mg2(OH)2CO3的pH值为多少? [Mg2+][CO2-]=Ksp=1.8×10-11 [Mg2+][OH-]2 =Ksp=1×10-5
[OH ]2 6 1 . 8 10 2 [CO3 ]
而
[OH ] 1.8 106 2 2 [OH ] [CO3 ]
2-4 CO2 、H2CO3及盐
若 将 0.2mol/l Na2CO3 和 0.2mol/l CaCl2 混 合 , 是 生 成 Ca(OH)2 还是CaCO3 Ksp: 5.5×10-6 2.5×10-9 [Ca2+][CO32-] = 0.1×0.1 = 10-2 > 2.5×10-9 [Ca2+][OH-]2 = 0.1×(4.5×10-3)2 = 2×10-6 < 5.5×10-6 不沉 淀 若将 0.2mol/l MgCl2和 0.2mol/l Na2CO3 混和呢? 生成Mg(OH)2 和MgCO3? Ksp 1.8×10-11 1×10-5 而[Mg2+][CO2-]=10-2>>Ksp [Mg2+][OH-]2 =2×10-6>>Ksp 生成碱式盐Mg(OH)2CO3 有兴趣的同学可以讨论一下,什么时候生成碱式盐。
全国高中生化学竞赛试题3 配位化合物(答案)
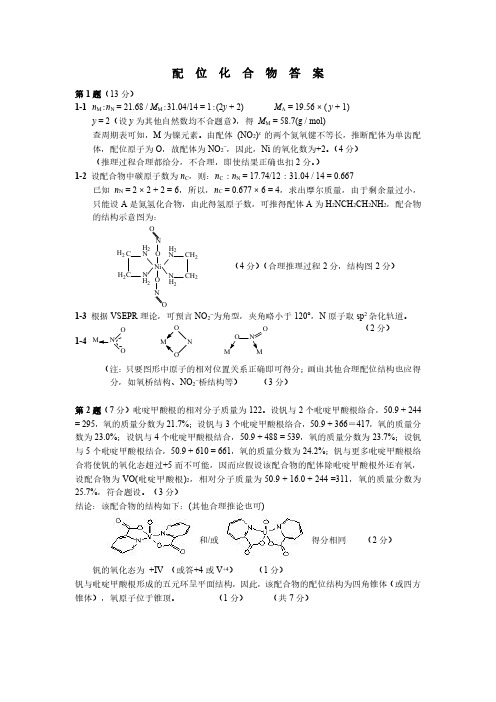
配位化合物答案第1题(13分)1-1n M :n N =21.68/M M :31.04/14=1:(2y +2)M A =19.56×(y +1)y =2(设y 为其他自然数均不合题意),得M M =58.7(g /mol)查周期表可知,M 为镍元素。
由配体(NO 2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O ,故配体为NO 2-,因此,Ni 的氧化数为+2。
(4分)(推理过程合理都给分,不合理,即使结果正确也扣2分。
)1-2设配合物中碳原子数为n C ,则:n C :n N =17.74/12:31.04/14=0.667已知n N =2×2+2=6,所以,n C =0.677×6=4,求出摩尔质量,由于剩余量过小,只能设A 是氮氢化合物,由此得氢原子数,可推得配体A 为H 2NCH 2CH 2NH 2,配合物的结构示意图为:N C CN NC C N H 2H 2H 2H 2H 2H 2H 2H 2Ni NNOO OO(4分)(合理推理过程2分,结构图2分)1-3根据VSEPR 理论,可预言NO 2-为角型,夹角略小于120°,N 原子取sp 2杂化轨道。
1-4O NONOOON O (2分)(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也应得分,如氧桥结构、NO 2-桥结构等)(3分)第2题(7分)吡啶甲酸根的相对分子质量为122。
设钒与2个吡啶甲酸根络合,50.9+244=295,氧的质量分数为21.7%;设钒与3个吡啶甲酸根络合,50.9+366=417,氧的质量分数为23.0%;设钒与4个吡啶甲酸根结合,50.9+488=539,氧的质量分数为23.7%;设钒与5个吡啶甲酸根结合,50.9+610=661,氧的质量分数为24.2%;钒与更多吡啶甲酸根络合将使钒的氧化态超过+5而不可能,因而应假设该配合物的配体除吡啶甲酸根外还有氧,设配合物为VO(吡啶甲酸根)2,相对分子质量为50.9+16.0+244=311,氧的质量分数为25.7%,符合题设。
高中化学竞赛辅导—元素及其化合物

〔一〕主族元素及其化合物一、氢和稀有气体〔一〕氢氢位于周期表的第一周期IA族,具有最简单的原子结构。
氢在化学反响中有以下几种成键情况:1、氢原子失去1个电子成为H+。
但是除了气态的质子外,H+总是与其它的原子或分子相结合。
2、氢原子得到1个电子形成H-离子,主要存在于氢和IA、IIA中〔除Be外〕的金属所形成的离子型氢化物的晶体中。
3、氢原子和其它电负性不大的非金属原子通过共用电子对结合,形成共价型氢化物。
此外,与电负性极强的元素相结合的氢原子易与电负性极强的其它原子形成氢键。
〔二〕稀有气体1、稀有气体的存在、性质和制备〔1〕存在:稀有气体的价电子结构称为饱和电子层结构,因此稀有气体不易失去电子、不易得到电子,不易形成化学键,以单质形式存在。
〔2〕物性:稀有气体均为单原子分子,He是所有单质中沸点最低的气体。
〔3〕制备:①空气的液化②稀有气体的别离2、稀有气体化合物〔1〕氟化物①制备:氙和氟在密闭的镍反响器中加热就可得到氙氟化物F2 + Xe〔过量〕→ XeF2 F2 + Xe〔少量〕→ XeF4 F2 + Xe〔少量〕→ XeF6②性质:〔a〕强氧化性:氧化能力按XeF2——XeF4——XeF6顺序递增。
一般情况被复原为单质。
NaBrO3 + XeF2 + H2O → NaBrO4 + 2HF + Xe二、区元素〔一〕通性1、它们的价电子构型为ns1~2,内层为稀有气体稳定电子层结构。
价电子很易失去呈+1、+2氧化态。
都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。
2、有较大的原子半径。
因为每一周期是从碱金属开始建立新的电子层。
原子半径变化的规律:同周期从IA到IIA减小,同族中从上到下增大。
3、电离势和电负性均较小,其变化规律为同周期从IA到IIA增大,同族中从上到下顺序减小。
〔二〕单质1、存在:由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。
如盐〔X-、CO-23、SiO-23、SO-24等〕;氧化物〔Li2O、BeO等〕2、性质:〔1〕物性:单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,其它均较软。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节 引言 问题:既然以C作为原子量的标度,为什么C 的原子量是12.011而不是12? 本章:注意结构以及与之相关的性质 / 合成。 第二节 碳 14C 的半衰期为 5730 年,可以测定古生物年 代。(500-5万年) 问题:14C在自然界中是如何平衡的?
2-1 石墨插入化合物
大家知道,石墨为一种层状结构,如 果将这种层状结构加以利用,加入一些物 质,即作为内表面, 插入化合物使石墨膨 了。 这在表面与催化方面有特殊的应用。 类似的还有γ-Al2O3 金红石(rutile) TiO2
2-2 活性碳的吸附性
例如 金刚石 活性碳: 主要是内表面,外表面很小 吸 附: 和催化特性极为相关 物理吸附(physical adsorption) 化学吸附(chemical adsorption)作用 大,热效应大
2-3 CO是否为甲酸酐
CO + NaOH HCOONa HCOOH 脱水得 CO 1. 检验: CO+ PdCl2 + H2O Pd + CO2 +2HCl 2.Fe2O3 + 3CO(g) 2Fe(s) + 3CO2(g) ΔH=-26.8kJ· mol-1 Fe(s)+5CO(g)=Fe(CO)5 ΔH=-233.5 kJ· mol-1
4-3 硼烷,乙硼烷的分子结构
一、无BH3而有BF3,why?
F Cl
B
B F
Cl Cl
F
6 4
而BH3无此键。
2. 硼烷
B 2H 6 B4H10 乙硼烷, 丁硼烷 [BnHn]2BnHn+4
BnHn+6
4-4 硼酸、硼酸盐
一、硼酸以氢键相连成片状
HO B OH OH
为什么H3BO3的溶解度很小?而加热又迅速上升? H3BO3以氢键连成层状结构后,同一层内氢键达到饱 和,使它不与水缔合,而加热则破坏了这种缔合。
3-3 Si的卤化物和氟硅酸盐
一、 SiO2的结构 原子晶体。Si为面心立方,而O占据1/4 的位置。
Si O Si Si Si O Si O Si O
Si O O Si Si
Si
Si Si
O O Si
Si
熔沸点高。
二、硅酸(xSiO2· yH2O)
x 偏 二 三 二偏硅酸 H2SiO3 H6Si2O7 H4Si3O8 H2Si2O5 1 2 3 2 y 1 3 2 1
6. 空间结构
• 由于是层状,片状结构,易从链间(石棉)、层 间(云母)一条条、一片片撕开。 • Al、P都可以形成AlO4、PO4,他们都可以部分 代替SiO4形成硅铝酸盐、磷铝酸盐。 • 沸石和分子筛。
第四节 B
B化学是近30年来取得最大进展的领域之一, 硼砂Na2B4O7· 10H2O 硼镁矿Mg2B2O5· H2O 问题:如何由硼砂制备B并提纯?
硼砂 Na2B4O7· 10H2O Na2[B4O5(OH)4]· 10H2O
OH O B- O HO B O B OH O B- O OH
2-4 CO2 、H2CO3及盐
若 将 0.2mol/l Na2CO3 和 0.2mol/l CaCl2 混 合 , 是 生 成 Ca(OH)2 还是CaCO3 Ksp: 5.5×10-6 2.5×10-9 [Ca2+][CO32-] = 0.1×0.1 = 10-2 > 2.5×10-9 [Ca2+][OH-]2 = 0.1×(4.5×10-3)2 = 2×10-6 < 5.5×10-6 不沉 淀 若将 0.2mol/l MgCl2和 0.2mol/l Na2CO3 混和呢? 生成Mg(OH)2 和MgCO3? Ksp 1.8×10-11 1×10-5 而[Mg2+][CO2-]=10-2>>Ksp [Mg2+][OH-]2 =2×10-6>>Ksp 生成碱式盐Mg(OH)2CO3 有兴趣的同学可以讨论一下,什么时候生成碱式盐。
二、
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
Si+ 2NaOH + H2O = 2H2 + Na2SiO3 Si+HNO3 不反应 ,无HF时不反应。 而Si + HF = SiF4 +2H2常温下也不反应。
3-2 硅烷 n=15
一、硅烷为什么没有碳烷多 Si-Si 键 < C-C 键 二、实验室是用SiO2+Mg条制Si的,但是有人制得的Si后加 HCl洗时突然起火,why? SiO2+Mg==Mg2Si +MgO Mg2Si + 4HCl == SiH4 +MgCl2 SiH4 + O2 == 自燃 三、反应 SiH4 + 2KMnO4 H2 + K2SiO3 +2MnO2↓ + H2O
Na2B4O7· 10H2O+H+ B2O3
Al Δ
H3BO3 BCl3
H2
Bபைடு நூலகம்
Cl2
B
B的特点:缺电子原子,易形成多中心键。
4-2 单质硼的结构和性质
B12 与B12之间是3c-2e键,层与层之间σ键 C60的构型为截角20面体。 ( 1984 年 , 质 谱 证 实 存 在 , 1990 年 , Kratchmer用He气氛下电弧法宏观制备C60)
[OH-]=9×10-7 pOH=6.04, pH=8
但是,Mg2(OH)2CO3为一纯净物,有它自己的稳定性,故 在pH=6左右很大的区间内生成Mg2(OH)2CO3
第二节 硅
重点为硅酸盐 3-1 单质硅 一、SiO2 + 2C Si + 2CO↑ H2 提纯,Si+Cl2 SiCl4 Si+HCl 高纯硅(用于半导体),区域熔融法。可达 7个9(Hyperpure silicon)
他们的生成和pH值有关。 但并非pH越小越快,pH=6左右最快。
硅酸盐的结构特点:
总体,Si +4价,Si和O一定相连形成 SixOyn-的结构,它与阳离子形成离子键。 ⒈ SiO44-, 单个SiO4 Si:O = 1:4 ⒉ 两个SiO4以角氧相连
O Si O
O O
O Si O
O O
Si O OO
1. 动力学>>Ksp时,来不及选择,一起沉淀。 2. 热力学,Mg2(OH)2CO3的pH值为多少? [Mg2+][CO2-]=Ksp=1.8×10-11 [Mg2+][OH-]2 =Ksp=1×10-5
[OH ]2 6 1 . 8 10 2 [CO3 ]
而
[OH ] 1.8 106 2 2 [OH ] [CO3 ]
