几何构型和空间构型
空间构型

孤对电子-孤对电子 > 孤对电子-成键电子 > 成键电子-成键电子
b. 在ABn中,若A与B之间通过双键或叁键结合时,则按单键处理。
实验内容
1.根据杂化轨道理论判断分子或者基团的空间构型
种 类 BeCl2 BCl3 [Zn(NH3)4 ]2+, CCl4 NH3 H2O [FeF6]3-
杂 化 类 型 键角
sp
180° 直线
sp2
120° 平面三 角
sp3
109°28 ′ 正四面体
不等性sp3 不等性sp3
107°18 ′ 三角锥 104°30 ′ 角(V)形
sp3d2
90° 正八面体
分子的几何 构型
2.价电子对数与理想几何构型关系
价层电子对数 2 3 平面三角形 4 120° 价层电子对的理想几何排 排 布 型 式 布 :-A-: 直 线 形 角 度 180°
价电子对数=(5+1×4-1)/2=4); 如果是阴离子,价层电子总数应加上阴离子的电荷数,例如,PO43-, 价电子对数=(5+0+3)/2=4。
b. 如果是阳离子,价层电子总数应减去阳离子的电荷数,例如,NH4+,
(3) 价电子对数与理想几何构型关系
理想几何构型: 中心原子的价层电子对全是成键电子对。
空间结构的画法,以a为例
Cl
a
最后,判断空间构型
找出不同类型电子对之间排斥作用数(选90°) (a)(b)(c) 90°孤对电子对—孤对电子对排斥作用数 90°孤对电子对—成键电子对排斥作用数 90°成键电子对—成键电子对排斥作用数 0 6 6 1 3 2 0 4 2
最后,判断空间构型
排斥作用数越多排斥越大,此结构就越不稳定,在上述
分子或离子空间构型的判断方法

分子或离子空间构型的判断方法
1.空间构型的可解析法:根据分子或离子的几何构型和化学键的长度、角度以及存在的非共面情况,可以通过几何推算来判断其空间构型。
例如
在VSEPR理论中,根据中心原子周围键的种类和数量以及孤对电子的影响,可以预测分子的空间构型。
2.实验技术法:通过实验手段来确定分子或离子的空间构型。
例如,
X射线晶体学可以通过测定晶体中原子的位置来确定其空间构型。
3.分子模拟法:借助于计算机模拟和量子化学计算的手段,可以通过
分子力场、量子力学计算等方法来预测分子或离子的空间构型。
这种方法
可以考虑更多的因素,如电荷分布和随机热运动的影响,从而更准确地判
断空间构型。
4.光谱技术法:在分子或离子存在谐振,激发或振动的情况下,通过
观察其产生的光谱特性,如红外光谱、拉曼光谱等,可以得出分子或离子
的空间构型信息。
以上是几种常用的判断分子或离子空间构型的方法,不同的方法在实
际应用中有其适用范围和局限性。
对于一些简单的分子和离子,几何推算
方法通常可以给出较为准确的空间构型信息。
而对于复杂的大分子和离子,分子模拟和实验技术往往是更可靠和准确的方法。
通过综合运用这些方法,可以对分子和离子的空间构型进行全面的判断和研究。
第6章 分子的结构与性质

键长和键角是描述分子几何结构的两个要素。
分子或晶体中相邻原子(或离子)间强烈的相互 吸引作用称为化学键。
共价键—Ch6 离子键—Ch7 金属键—Ch7 配位键—Ch8
6.2 价键理论
6.2.1 共价键
2. 化学键:分子或晶体内部,原子(或离子)之间存 在着较强烈的相互作用力。化学上把分子或晶体中相 邻原子(或离子)间强烈的相互吸引作用称为化学键。
§6.1 化学键参数 §6.2 价键理论 §6.3 分子的几何构型 杂化轨道理论 *价层电子对互斥理论 §6.4 分子轨道理论 §6.5 分子间力和氢键
6.1键参数 凡能表征化学键性质的物理量统称为键参数。
化学键的强度: 键级 (B.O.) 键能 (E)
分子的空间构型: 键长 键角
化学键的极性: 键距 (键的偶极距 u = q l )
6.1.1 键能 E°
在标准条件下将1摩尔的气态AB分子中的化学键断 开,使每个AB分子离解成两个中性气态原子A + B时 所需的能量或者所释放的能量。
当两个自旋方向相反的电子相互靠近时,两个1s原 子轨道发生重叠(波函数相加),核间形成一个电子概 率密度较大的区域, 两个H原于核都被电子概率密 度大的电子云吸引,系统能量降低,当核间距达到 平衡距离R0(74pm)时,系统能量达到最低点----基态。 如果两个H原子核再接近,原子核间斥力增大.使 系统的能量迅速升高,排斥作用又将H原子推回平 衡位置。
ns-np杂化,ns-np-nd杂化,(n-1)d-ns-np杂化 ② 杂化轨道成键能力大于未杂化轨道。
+
+–
判断分子空间几何构型的简单方法
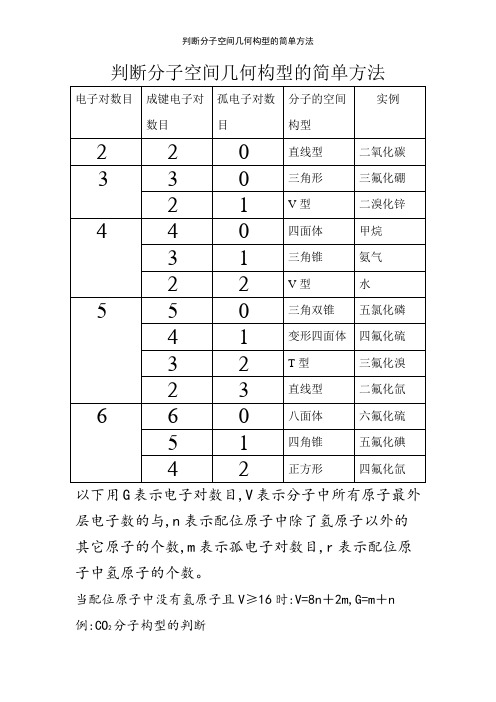
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的与,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0, ∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V为奇数时,只需将V与G瞧成比它们大1的偶数即可!。
分子结构与构象

分子结构与构象
分子结构和构象是有机化学中非常重要的概念,它们直接影响分子的性质和反应行为。
本文将从分子结构和构象两方面进行探讨。
一、分子结构
分子结构指的是分子中原子间的连接方式和原子之间的空间排布关系。
分子结构的特点包括:
1. 原子之间的连接方式:分子中的原子按照一定规律通过化学键连接在一起,常见的化学键包括共价键、离子键、金属键等。
2. 原子的空间排布:分子中的原子在三维空间中的排布方式决定了分子的几何构型,常见的几何构型包括线形、角形、平面四边形、三角锥形等。
3. 分子中原子的排列顺序:不同的原子在分子中的排列顺序会影响分子的性质,例如同分异构体就是由于原子排列顺序不同而导致性质差异。
二、构象
构象指的是分子在空间中不同的旋转构型,由于分子的单键和双键可以自由旋转,因此同一分子可以存在多种不同的构象。
构象的特点包括:
1. 可旋转的单键和不可旋转的双键:单键是可以自由旋转的,而双键是不可旋转的,这导致分子在双键处会出现不同的构象。
2. 构象的转换:分子的构象可以在化学反应中发生改变,例如烷烃的卤代反应中,由于取代基的作用,分子的构象会发生改变。
3. 构象的影响:分子的构象会影响分子的性质和反应活性,例如立体异构体之间在化学反应中可能会表现出不同的反应活性。
综上所述,分子结构和构象是有机化学中非常重要的概念,它们直接影响分子的性质和反应行为。
科学家们通过对分子结构和构象的研究,不断拓展着有机化学的知识体系,为人类社会的发展做出了重要贡献。
判断分子空间几何构型的简单方法
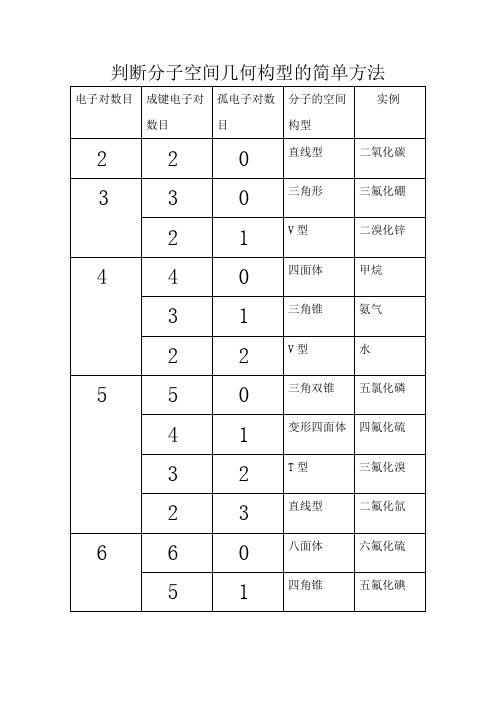
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的和,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0,∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V 为奇数时,只需将V和G看成比它们大1的偶数即可!(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
h2o的空间几何构型

h2o的空间几何构型
H2O的空间构型为V形。
因为水是sp3杂化,所以是正四面体结构,但由于O原子有两对孤对电子,所以结构为V型或角型。
O周围有4对电子,分别是2对孤对电子和2对O-H键共用电子对。
四对电子之间有较显著的斥力,要让它们稳定,显然应排成四面体结构。
但孤对电子的斥力更大,所以优先让孤对电子远离,使得两对成键电子相距较近(角度小于正四面体的109°28′)。
水的物理性质
水通常是无色、无味的液体。
在标准大气压下,纯水的沸点为100℃,凝固点为0℃,三相点是0.01℃。
水的密度在3.98℃时最大,为1.0×103kg/m3,温度高于3.98℃时(也可以忽略为4℃),水的密度随温度升高而减小,在0~3.98℃时,水热缩冷胀,密度随温度的升高而增加。
判断分子空间几何构型的简单方法
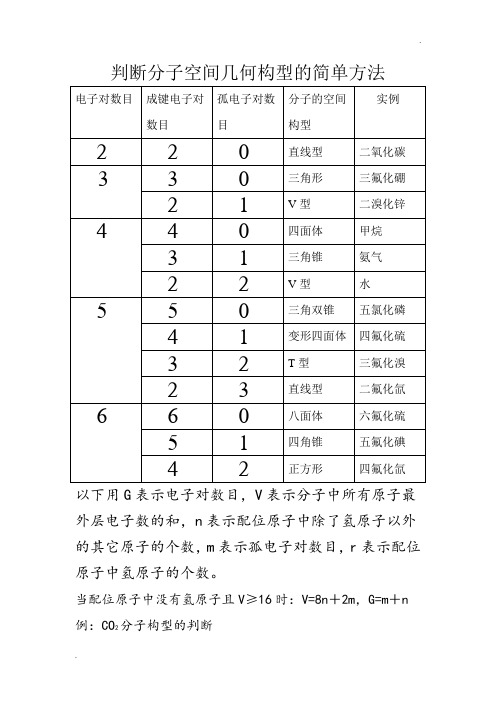
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的和,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0,∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V 为奇数时,只需将V和G看成比它们大1的偶数即可!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
几何构型和空间构型
几何构型和空间构型是数学中重要的概念,它们在几何学和拓扑学中有着广泛的应用。
几何构型是指由一组点、线、面等基本元素组成的形状或结构,而空间构型则是指在三维空间中的构型。
在几何构型中,最基本的构型是点。
点是没有大小和形状的,它只有位置。
几何学中的点可以用坐标表示,例如二维平面中的点可以用二维坐标(x, y)来表示。
通过点,我们可以构建出线段、直线、射线等构型。
线段是由两个点确定的有限线段,直线是由无数个点确定的无限线段,而射线则是由一个起点和一个方向确定的半直线。
这些构型都有着特定的性质和定义,例如线段有长度,直线是无限延伸的。
除了点、线段、直线和射线,几何构型还包括了多边形、圆等形状。
多边形是由一组线段连接而成的封闭图形,其中最常见的是三角形、四边形和多边形。
圆是由一组与圆心距离相等的点构成的,其中包括了半径、直径和周长等属性。
在空间构型中,除了点、线段、直线和射线,还包括了三维图形,例如立方体、球体和圆柱体等。
立方体是由六个正方形面组成的,它有着六个面、十二个边和八个顶点。
球体是由所有与球心距离相等的点构成的,它有着曲面、半径和体积等属性。
圆柱体是由一个圆和一个平行于圆的矩形面组成的,它有着底面积、高度和体积等
属性。
几何构型和空间构型不仅仅是数学中的抽象概念,它们在现实生活中有着广泛的应用。
在建筑设计中,几何构型可以用来描述建筑物的形状和结构,例如建筑物的平面布局、立面设计和空间分布等。
在工程设计中,空间构型可以用来描述机械零件的形状和结构,例如汽车的车身、飞机的机翼和船舶的船体等。
在计算机图形学中,几何构型和空间构型可以用来描述三维模型的形状和结构,例如计算机游戏中的角色和场景等。
几何构型和空间构型是数学中重要的概念,它们在几何学和拓扑学中有着广泛的应用。
几何构型包括了点、线段、直线、射线、多边形和圆等构型,而空间构型则包括了立方体、球体和圆柱体等构型。
它们不仅仅是数学中的抽象概念,还有着广泛的应用价值,可以用来描述和分析现实生活中的形状和结构。
通过研究和理解几何构型和空间构型,我们可以更好地理解和应用数学知识。
