缓冲溶液及其作用机制的教案
《专题一 第一节 缓冲溶液》教学设计

《缓冲溶液》教学设计方案(第一课时)一、教学目标1. 理解缓冲溶液的观点和作用原理。
2. 掌握缓冲溶液的组成和计算。
3. 了解影响缓冲溶液的因素。
4. 学会建立缓冲溶液在实际应用中的观念。
二、教学重难点1. 重点:缓冲溶液的作用原理和组成。
2. 难点:理解缓冲溶液的组成和计算,以及影响缓冲溶液的因素。
三、教学准备1. 准备教学PPT,包含相关图片、视频和案例。
2. 准备实验器械,进行缓冲溶液的制备和性质实验。
3. 准备相关参考资料和网络资源,方便学生课后学习。
4. 提前与学生沟通,了解学生的学习基础和兴趣点,适当调整教学内容和方式。
四、教学过程:(一)引入缓冲溶液观点1. 介绍缓冲溶液在生活中的应用,如血液中的缓冲溶液能够维持血液的pH稳定,防止酸中毒或碱中毒。
2. 展示缓冲溶液在化工、医疗、环保等领域的应用图片或视频,引导学生了解缓冲溶液的重要性。
3. 提出观点:为什么有的溶液能够抵抗外来物质的变化,保持溶液的稳定?引导学生思考缓冲溶液的观点和作用原理。
(二)实验探究缓冲溶液的性质1. 设计实验:让学生自己动手配置一些弱酸弱碱缓冲溶液,并观察其pH值的变化。
通过实验,学生能够直观地感受到缓冲溶液对pH值的影响。
2. 实验探究:让学生观察不同浓度的缓冲溶液对pH值的影响,探究缓冲溶液的浓度与缓冲能力之间的干系。
3. 实验讨论:引导学生讨论缓冲溶液的组成和性质,并尝试诠释实验现象。
(三)深入学习缓冲溶液的原理1. 介绍缓冲对:讲解缓冲对的观点和组成,让学生了解什么是共轭酸碱对。
2. 酸碱质子理论:介绍酸碱质子理论,让学生了解酸碱反应的本质。
3. 缓冲原理:通过动画或视频,帮助学生理解缓冲溶液的原理,即共轭酸碱对的缓冲作用。
4. 实例分析:通过分析实际生产中的缓冲溶液案例,帮助学生加深对缓冲原理的理解。
(四)教室总结与延伸1. 教室总结:回顾本节课所学内容,帮助学生梳理缓冲溶液的观点、性质和原理。
2. 知识应用:引导学生思考如何将所学知识应用于实际生产生活中,如设计一种新型的缓冲溶液。
大学缓冲溶液的教案

课时:2课时教学目标:1. 了解缓冲溶液的概念、组成和作用。
2. 掌握缓冲溶液的制备方法、pH值计算和缓冲能力的判断。
3. 理解缓冲溶液在生活中的应用。
教学重点:1. 缓冲溶液的组成和作用。
2. 缓冲溶液的制备方法、pH值计算和缓冲能力的判断。
教学难点:1. 缓冲溶液的制备方法。
2. 缓冲溶液的pH值计算和缓冲能力的判断。
教学准备:1. 多媒体课件2. 实验器材:烧杯、玻璃棒、pH试纸、缓冲溶液试剂等教学过程:第一课时一、导入1. 提问:什么是溶液?什么是酸碱溶液?2. 引入缓冲溶液的概念,让学生思考缓冲溶液的特点。
二、新课讲授1. 缓冲溶液的组成:弱酸及其盐或弱碱及其盐。
2. 缓冲溶液的作用:保持溶液的pH值稳定。
3. 缓冲溶液的制备方法:a. 混合酸碱:将弱酸与其盐或弱碱与其盐混合。
b. 添加缓冲溶液:在溶液中加入一定量的缓冲溶液。
4. 缓冲溶液的pH值计算:a. 使用酸碱指示剂。
b. 使用pH试纸。
5. 缓冲溶液的缓冲能力判断:a. 通过实验观察溶液的pH值变化。
b. 计算缓冲溶液的pH缓冲范围。
三、课堂小结1. 总结缓冲溶液的组成、作用、制备方法、pH值计算和缓冲能力的判断。
2. 强调缓冲溶液在生活中的应用。
第二课时一、复习导入1. 复习缓冲溶液的概念、组成、作用和制备方法。
2. 引导学生思考缓冲溶液在生活中的应用。
二、实验演示1. 实验一:制备缓冲溶液。
a. 实验步骤:取一定量的弱酸或弱碱,加入适量的盐,搅拌均匀。
b. 实验观察:溶液的pH值变化。
2. 实验二:缓冲溶液的pH值计算。
a. 实验步骤:使用酸碱指示剂或pH试纸测量溶液的pH值。
b. 实验观察:溶液的pH值。
3. 实验三:缓冲溶液的缓冲能力判断。
a. 实验步骤:向溶液中加入酸或碱,观察溶液的pH值变化。
b. 实验观察:溶液的pH值变化。
三、课堂小结1. 总结实验结果,加深对缓冲溶液的理解。
2. 强调缓冲溶液在生活中的应用。
四、作业布置1. 课后复习缓冲溶液的相关知识。
《专题二 第一节 缓冲作用》教学设计教学反思

《缓冲作用》教学设计方案(第一课时)一、教学目标1. 知识目标:学生能够理解缓冲溶液的定义,掌握缓冲作用及其原理。
2. 能力目标:学生能够通过实验操作,观察和理解缓冲溶液的缓冲作用。
3. 情感目标:通过本课程的学习,培养学生的科学态度和探索精神,提高学生对化学科学的兴趣。
二、教学重难点1. 教学重点:缓冲溶液的原理及其在生活和工业中的应用。
2. 教学难点:缓冲溶液的pH值变化及其对化学反应的影响。
三、教学准备1. 准备教学用具:PPT课件,缓冲溶液实验器械,试管、滴定管、试纸等。
2. 准备实验材料:选择合适的缓冲溶液,确保其安全无害。
3. 准备教学材料:PPT上展示缓冲溶液的原理和应用,帮助学生理解。
4. 提醒学生注意安全:在进行实验操作时,要峻厉按照实验规程进行,确保安全。
四、教学过程:(一)引入1. 讲述缓冲溶液在生活中的应用,如血液中的缓冲系统,避免血液因外部刺激而产生过大的pH变化。
2. 提问:缓冲作用是什么?如何诠释缓冲作用?(二)新知探究1. 观看缓冲溶液的实验视频,让学生直观感受缓冲作用。
2. 阅读教材,了解缓冲溶液的组成,理解缓冲物质中加入弱酸的原理。
3. 分组讨论:如何制备缓冲溶液?如何判断已制备的溶液是否合格?(三)互动交流1. 提问:在平时生活和工业生产中,还有哪些地方用到了缓冲作用?2. 分享个人或身边的实例,引导学生发现更多缓冲作用的应用。
3. 讨论:缓冲溶液对生命活动有何意义?对化学实验有何影响?(四)稳固提高1. 完成课后练习题,检查学生对缓冲作用的理解水平。
2. 安置拓展作业:自行设计一份简单的缓冲溶液,并诠释其原理。
3. 教室小结:回顾本节课的重点内容,强调缓冲作用的意义和应用。
(五)安置任务请同砚们课后自行观看相关视频,了解缓冲溶液在生物、医学等领域的应用,并撰写一份报告,下节课与大家分享。
教学设计方案(第二课时)一、教学目标1. 理解缓冲溶液的作用原理。
2. 掌握缓冲溶液的组成及计算。
缓冲溶液教案
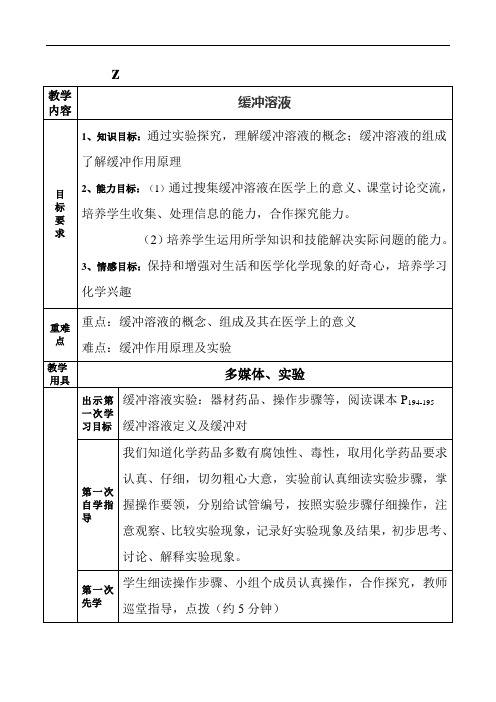
出示第二次学习目标
醋酸钠和醋酸缓冲溶液为什么能对抗外来少量酸或碱,保持溶液pH几乎不变呢?
第二次自学指导
醋酸是强还是弱电解质?醋酸钠呢?它们如何电离?
1、HAc?
2、NaAc=?
溶液中各粒子浓度有什么特点?加入少量酸或碱是哪个成分能反应它们?各粒子浓度会发生变化吗?
其他同学倾听、思考、补充。
为什么在醋酸钠和醋酸混合溶液中加入酸或碱PH几乎不变,蒸馏水加入酸或碱PH变化那么大(约4个单位)?哪位同学可以解释?其他学生思考、补充、教师纠正、完善。
缓冲溶液没有碱,为什么加入酸PH也几乎不变?
教师引导、点拨:醋酸钠属于哪类盐?它的水溶液酸碱性怎样?师生合作、探究、归纳形成新知识
加入少量碱时,溶液中的HAc电离出的H+和外来的OH-结合生成水,HAc的电离平衡向右移动,[HAc]较大,足够补充因中和OH-所消耗的H+,HAc建立新的电离平衡时,溶液里的[HAc]略有减小,[Ac-]略有增加,而[H+]几乎不变,PH值几乎不变。
学生板演:抗碱的离子方程
HAc + OH-=Ac-+H2O
z
教学内容
缓冲溶液
目
标
要
求
1、知识目标:通过实验探究,理解缓冲溶液的概念;缓冲溶液的组成
了解缓冲作用原理
2、能力目标:(1)通过搜集缓冲溶液在医学上的意义、课堂讨论交流,培养学生收集、处理信息的能力,合作探究能力。
(2)培养学生运用所学知识和技能解决实际问题的能力。
3、情感目标:保持和增强对生活和医学化学现象的好奇心,培养学习化学兴趣
一、缓冲溶液及缓冲溶液的组成
《专题一第一节缓冲溶液》教学设计教学反思-2023-2024学年中职化学高教版21农林牧渔类

《缓冲溶液》教学设计方案(第一课时)一、教学目标1. 知识目标:学生能够理解缓冲溶液的概念,掌握缓冲对和缓冲容量等基本知识。
2. 能力目标:学生能够通过实验分析缓冲溶液的性质和应用,提高实验操作和数据分析能力。
3. 情感目标:通过本课程的学习,培养学生的科学态度和团队合作精神。
二、教学重难点1. 教学重点:缓冲溶液的性质和应用,缓冲对和缓冲容量的理解。
2. 教学难点:如何通过实验数据分析和理解缓冲溶液的缓冲作用,以及其在生活和工业中的应用。
三、教学准备1. 准备教学用具:PPT课件,缓冲溶液实验器材,试管、滴定管、试纸等。
2. 准备实验材料:提前配置好各种缓冲溶液,以及相应的试剂和试纸。
3. 安排教学内容:提前为学生讲解缓冲溶液的相关知识,做好课前预习。
4. 安排课堂活动:在课程中引导学生进行实验操作和数据分析,组织学生讨论缓冲溶液的应用。
四、教学过程:(一)引入缓冲溶液的概念1. 介绍缓冲溶液在生活中的应用,如血液中的缓冲物质,防止血液因酸碱变化而改变pH。
2. 提出问题:为什么缓冲溶液能够抵抗外来酸碱的影响?其内部机制是什么?(二)介绍缓冲对的组成及性质1. 介绍缓冲对的概念,如NaHCO3/Na2CO3对、NH3·H2O/NH4Cl对等。
2. 通过实验演示,观察缓冲对中两种物质在水溶液中的颜色变化,以理解缓冲对的性质。
(三)讲解缓冲溶液的组成和计算1. 讲解缓冲溶液的组成,即由一种或多种缓冲对组成。
2. 讲解缓冲容量B的计算,以及缓冲范围(pH±一个缓冲单位的范围)的确定。
(四)讲解缓冲溶液的配制方法1. 根据实际情况,介绍不同种类缓冲溶液的配制方法。
2. 强调配制过程中的注意事项,如避免引入其他杂质离子等。
(五)探究实验:自制缓冲溶液1. 学生分组,按照提供的试剂和仪器,自行设计一份缓冲溶液配方并进行配制。
2. 对自制缓冲溶液进行初步检测,了解其pH值、缓冲容量等基本性质。
大学教材缓冲溶液教案

课时:2课时教学目标:1. 理解缓冲溶液的概念和作用。
2. 掌握缓冲溶液的制备方法和条件。
3. 学会分析缓冲溶液的pH值变化。
4. 培养学生运用所学知识解决实际问题的能力。
教学重点:1. 缓冲溶液的概念和作用。
2. 缓冲溶液的制备方法和条件。
3. 缓冲溶液的pH值变化。
教学难点:1. 缓冲溶液的制备方法和条件。
2. 缓冲溶液的pH值变化。
教学过程:第一课时一、导入1. 提问:什么是溶液?溶液有哪些性质?2. 引出缓冲溶液的概念,让学生了解缓冲溶液的特点。
二、新课讲解1. 缓冲溶液的概念:缓冲溶液是一种含有弱酸及其共轭碱或弱碱及其共轭酸的溶液,它具有抵抗外界加入的少量酸、碱或水而使溶液pH值变化的能力。
2. 缓冲溶液的作用:缓冲溶液可以维持溶液的pH值稳定,广泛应用于医药、化工、食品等领域。
3. 缓冲溶液的制备方法和条件:a. 选择合适的弱酸或弱碱及其共轭酸碱对。
b. 按照一定的比例混合弱酸及其共轭碱或弱碱及其共轭酸。
c. 调整溶液的浓度,使缓冲溶液的pH值达到所需范围。
4. 缓冲溶液的pH值变化:a. 当加入少量酸时,缓冲溶液中的共轭碱会与酸反应,消耗掉部分酸,使溶液pH值基本保持不变。
b. 当加入少量碱时,缓冲溶液中的共轭酸会与碱反应,消耗掉部分碱,使溶液pH值基本保持不变。
三、课堂练习1. 分析以下溶液是否为缓冲溶液,并说明理由。
a. 0.1mol/L的NaOH溶液b. 0.1mol/L的CH3COOH溶液c. 0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液2. 设计一个实验方案,验证缓冲溶液的制备方法和条件。
第二课时一、复习导入1. 回顾缓冲溶液的概念、作用、制备方法和条件。
2. 引出缓冲溶液的pH值变化。
二、新课讲解1. 缓冲溶液的pH值变化:a. 当加入少量酸时,缓冲溶液的pH值下降,但下降幅度较小。
b. 当加入少量碱时,缓冲溶液的pH值上升,但上升幅度较小。
课程设计第四章缓冲溶液

中医学院《医用化学》课程设计(首页)课程名称:医用化学任课教师:职称:所在系部:医学技术系教研室:化学教研室授课对象:医学影像授课时间:课程类型:必修基础课授课章节:第四章缓冲溶液基本教材:祖期主编《基础化学》第八版, 人民卫生,2013年3月。
自学资源:1、《无机化学》许善锦主编,人民卫生.2、《基础化学》第五版.祖期主编,人民卫生.3、《基础化学》徐春祥主编,高等教育.4、《现代化学基础》朱裕贞主编,化学工业.5、《现代化学基础》胡忠鲠主编,高等教育.教学目标:(一)知识目标:1. 掌握缓冲溶液的概念、组成和作用机制;影响缓冲溶液pH的因素、Henderson-Hasselbalch方程式及应用;缓冲容量的概念、影响因素及有关计算。
2. 熟悉缓冲溶液的配制原则、方法和步骤;血液中的主要缓冲系及其在稳定血液pH过程中的作用。
3. 了解医学上常用的缓冲溶液的配方和标准缓冲溶液的组成。
(二)能力目标:通过本章节的学习,使学生初步掌握缓冲溶液的组成、缓冲溶液的缓冲机理、缓冲溶液的配制方法、缓冲溶液PH值的计算、缓冲围、影响缓冲容量的因素以及缓冲溶液在医学上的应用等等,培养学生独立的分析问题和解决问题能力。
(三)情感目标通过缓冲溶液的学习,学生特点分析:本课程针对临床专业大一学生开设,学生在中学阶段选修课程部分容不讲解,知识结构不系统,在讲解时要精讲,并结合临床专业的实例,调动学生的积极性,培养他们学习化学课程的兴趣。
教学重点:1.缓冲溶液的概念、组成和缓冲作用的机理;影响缓冲溶液pH的因素及缓冲溶液pH的计算;缓冲溶液的配制原则、方法和步骤;缓冲容量的概念及缓冲容量的有关计算。
教学难点:1.缓冲容量的概念及缓冲容量的有关计算。
2.缓冲对的选择。
解决方法和处理措施:1. 通过实验教学设置相关的实验容,让学生首先了解缓冲容量的概念和影响缓冲容量的因素,然后通过结合实验结果讲述这些因素对缓冲容量的影响情况,并且引出如何计算缓冲容量。
《缓冲溶液》教案

《缓冲溶液》教案教案标题:缓冲溶液教案目标:1.理解缓冲溶液的概念和作用。
2.学习如何制备和调节缓冲溶液。
3.掌握缓冲溶液的pH值计算和调节方法。
教学重点:1.缓冲溶液的定义和作用。
2.缓冲溶液的制备方法。
3.缓冲溶液的pH值计算和调节方法。
教学难点:1.缓冲溶液的pH值计算和调节方法。
2.学生对缓冲溶液的理解和应用能力。
教学准备:1.学生用品:笔、纸、计算器。
2.教师用品:课件、实验仪器设备。
教学过程:一、导入(15分钟)1.教师简要介绍缓冲溶液的概念和作用,并向学生提问:你们对缓冲溶液了解多少?它有什么作用?2.学生回答后,教师对其回答进行点评和补充,并引导学生思考缓冲溶液的重要性。
二、缓冲溶液的定义和作用(15分钟)1.教师通过投影课件,详细讲解缓冲溶液的定义和作用,并强调其在生物和化学领域的重要性。
2.教师通过具体例子和实验现象,解释缓冲溶液能够稳定溶液的pH 值,并避免溶液中pH值的剧烈变化。
三、缓冲溶液的制备方法(20分钟)1.教师介绍常用的制备缓冲溶液的方法,如添加弱酸和其盐或弱碱和其盐等。
2.教师进行实验演示,展示如何制备缓冲溶液,包括实验装置和步骤。
3.学生根据所学内容和实验演示,讨论并总结缓冲溶液的制备方法,并与教师进行互动。
四、缓冲溶液的pH值计算和调节方法(30分钟)1.教师简要介绍缓冲溶液的pH值计算方法,包括弱酸和弱碱的离解常数的计算,并通过例题进行演示。
2.学生进行小组讨论,共同解决几道缓冲溶液的pH值计算题目,并与教师进行互动。
3.教师介绍如何调节缓冲溶液的pH值,包括添加弱酸或弱碱,以及调节其浓度等方法。
五、拓展练习(10分钟)1.学生进行个人练习,完成教师提供的缓冲溶液计算题目,并检查答案。
2.学生互相交流讨论,对有疑问的问题进行解答和讨论。
六、总结和归纳(10分钟)1.教师对本节课的内容进行总结和归纳,强调重要知识点。
2.学生进行自我总结并提出问题,教师进行解答和指导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
缓冲溶液及其作用机制(教学教案)
授课人:张瑞林
授课时间:20分钟
【教学目标】:
通过缓冲溶液的定义、作用、组成及作用机制的介绍,使学生对缓冲体系有一个基本的了解,为以后学习人体缓冲体系打下理论基础。
【教学方式】:多媒体结合板书进行讲解式教学
【教学内容】:
1、缓冲溶液的定义
2、缓冲溶液的作用
3、缓冲溶液的组成
4、缓冲溶液的作用机制
【教学重点及难点】:缓冲溶液的组成、缓冲溶液的作用机制
【教学过程】:
引言:
通过医学常识我们知道正常人的血液pH范围为7.35 ~ 7.45,pH值不因代谢过程中产生酸、碱性物质而变化。
为什么血液的pH的范围能保持在7.35 ~ 7.45?
知识准备:
1.弱电解质的电离平衡
2.盐类水解
一、缓冲溶液的概念(由实验引出)
缓冲溶液:能抵抗外加少量强酸或强碱,而维持pH基本不发生变化的溶液。
缓冲作用:缓冲溶液所具有的抵抗外加少量强酸或强碱的作用。
【提问】:1.缓冲溶液的组成是怎样的?
2.缓冲溶液为什么能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的?
二、缓冲溶液的组成和作用机制
1.缓冲溶液的组成
根据缓冲对不同,缓冲溶液分为三种:
弱酸及其盐
弱碱及其盐
多元弱酸的酸式盐与其次级盐
2.缓冲溶液的作用机制
以HAc — NaAc为例 HAc、NaAc足量HAc + H2O H3O+ + Ac-
+
左移 H3O+抗酸成分 +
抗碱成分右移 OH-
2H2O
共轭酸—抗碱成分共轭碱—抗酸成分
三、讨论:
NH3—NH4Cl的缓冲原理
四、练习:
五、小结:
概念:缓冲溶液
缓冲溶液组成和缓冲作用
缓冲原理
六、作业:
搜集资料:
缓冲溶液在日常生活中的应用。
