实验十-传出神经系统药物对离体家兔肠管平滑肌
药物对兔离体回肠平滑肌的作用

药物对兔离体回肠平滑肌的作用实验目的1•学习离体平滑肌器官的试验方法。
2•观察药物对兔离体回肠平滑肌的作用,并初步分析其机制。
实验原理多种动物的离体肠管在适宜的环境中,可以较长时间保持其自动节律性运动功能。
根据受体在肠平滑肌中的分布的特点,可观察药物的作用,并借助工具分析其作用机制。
实验器材和药品1. 实验动物家兔,体重2~3kg,雌雄不拘。
2. 实验器材木锤,小剪刀,小镊子,培养皿,HE-400S恒温平滑肌槽,张力传感器,电脑及记录装置。
3. 实验药品和试剂台式(Tyrode's )液,0.01%氯化乙酰胆碱,0.1% 硫酸阿托品,1%氯化钡。
实验步骤和方法1. 取家兔1只,以木槌击其枕骨部处死,迅速剖开腹腔,找到回盲部,剪取回肠,置盛有冷台式液的培养皿中,沿肠壁分离并减去肠系膜,将肠管剪成数段,轻轻压出场内容物,用冷台式液冲洗肠管,再换冷台式液,最后将肠管剪成若干2~3cm的小段置于4C台式液中备用。
2. HW-400S恒温平滑肌槽的操作方法①将恒温平滑肌槽右侧面的排液口和排水口均置于关闭状态。
②在恒温平滑肌槽内添加足够量的清水,水量达到建议水平线。
在预热筒内加入适量营养液。
③确保电源已经连接良好。
④打开机器电源。
⑤此时数码管和加热指示灯快速闪烁,表明系统还没有处于加热状态,当确认水浴槽内加水后,轻按温度设定旋钮,系统进入加热状态。
⑥设定实验温度(38士0.5 )C。
⑦营养液先在预热筒中预热,然后通过按下自动加液按钮让其自动流到实验药筒。
⑧温度达到试验温度后加入实验样本。
试验样本通过随机配件中的实验片固定在试验药筒中,用滴管向实验药筒中滴入药液来进行实验。
用过的营养液可通过打开设备侧板的放液阀向外排放,排放后请用预热筒中营养液将其冲洗数遍,实验效果更佳。
⑨调节气量调节阀。
⑩实验时将随机标配的支架杆固定座上,将张力传感器固定在支架杆上,然后将实验样本一端吊在张力传感器上,一端固定在实验钩上,将实验钩牢挂在试验药筒边沿即可开始试验。
药物对家兔离体肠管的作用

药物可以通过激活或抑制信号传导通路来调节肠管的生理功能。例如,
某些药物可以激活腺苷酸环化酶,从而促进肠管收缩,而另一些药物则
可以抑制该酶的活性,从而抑制肠管收缩。
03
ห้องสมุดไป่ตู้
信号传导通路与药物作用关系
药物对信号传导通路的影响可以解释其对肠管生理功能的调节作用。例
如,某些药物可以通过影响信号传导通路中的关键酶或受体的活性来调
药物剂量与效应关系的研究有助于确定药物的最佳使用剂 量和范围,避免药物过量或不足对实验结果的影响。同时 ,也有助于深入了解药物的作用机制和靶点,为药物的优 化设计和临床应用提供理论依据。
06
实验结果讨论与结论
实验结果讨论
药物对家兔离体肠管张力的影响
实验结果显示,不同药物对家兔离体肠管张力的影响不同。有些药物能够显著增加肠管张 力,有些药物则对肠管张力没有明显影响。这表明药物对家兔离体肠管的作用具有多样性 。
实验方法与步骤
离体肠管制备
实验装置
将家兔处死后,迅速取出肠管,置于冰冷 的Krebs液中,去除肠系膜和脂肪组织,剪 成2-3cm长的肠段备用。
将离体肠管置于恒温浴槽中,一端连接张 力换能器,另一端固定于浴槽底部,通过 生物信号采集系统记录肠管张力变化。
药物处理
数据处理与分析
向浴槽中加入不同浓度的药物溶液,观察 并记录药物对离体肠管张力的影响。同时 设立对照组,加入等体积的生理盐水。
恢复运动节律
另一些药物如普鲁卡因等,能降低肠管平滑肌的兴奋性,使 因各种原因引起的肠管运动节律失常得以恢复。
04
药物作用机制探讨
药物与受体结合情况分析
药物与肠管受体结合的特 性
药物与家兔离体肠管上的受体结合具有特异 性、饱和性、可逆性和敏感性的特点。
离体小肠平滑肌的生理特性及药物作用观察实验报告.doc
离体小肠平滑肌的生理特性及药物作用观察一、实验目的: ①进一步熟悉BL-410/420多媒体生物信号记录分析系统;②学习离体肠肌的实验装置和使用方法;③观察并记录传出神经系统药物以及酸碱对离体小肠平滑肌收缩的影响二、实验对象:家兔离体小肠肠管。
三、实验原理:消化道平滑肌具有自动节律性运动的特性,其产生机理源于其肌肉细胞本身的自发缓慢放电并受中枢神经系统及体液因素的调节,所以可以取离体的小肠肠管并放置于人工创造的正常生理环境下,利用BL-410/420多媒体生物信号记录分析系统和换能器系统分别研究传出神经系统药物以及酸碱对小肠平滑肌收缩的影响。
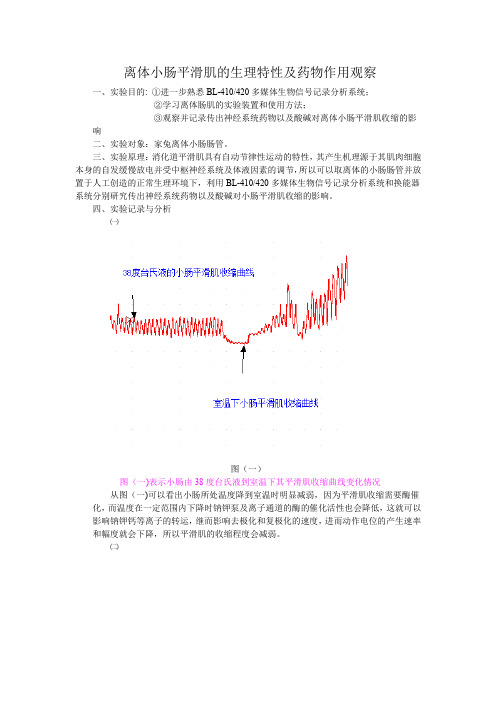
四、实验记录与分析㈠图(一)图(一)表示小肠由38度台氏液到室温下其平滑肌收缩曲线变化情况从图(一)可以看出小肠所处温度降到室温时明显减弱,因为平滑肌收缩需要酶催化,而温度在一定范围内下降时钠钾泵及离子通道的酶的催化活性也会降低,这就可以影响钠钾钙等离子的转运,继而影响去极化和复极化的速度,进而动作电位的产生速率和幅度就会下降,所以平滑肌的收缩程度会减弱。
㈡图(二)图(二)表示在38度台氏液加入肾上腺素后小肠平滑肌收缩曲线的变化情况由图(二)可知加入肾上腺素后小肠平滑肌收缩明显减弱,这是因为肾上腺素与小肠平滑肌肌膜上的β肾上腺素能受体结合,可导致使膜超极化,从而使膜去极化达到阈电位的幅度增加,所以其动作电位的产生频率下降,所以小肠平滑肌的收缩幅度减弱。
㈢图(三)图(三)表示在正常38度台氏液里滴加乙酰胆碱的小肠平滑肌收缩曲线变化情况由图(三)可知在正常38度台氏液里滴加乙酰胆碱后小肠平滑肌收缩明显增强,这是应为乙酰胆碱与小肠平滑肌肌膜上的M受体结合后,可以在膜去极化未达到一定的电位时提前激活更多的慢钙通道,使大量的钙离子内流,进而使动作电位产生的频率增加,所以小肠的平滑肌收缩增强。
㈣图(四)图(四)表示在正常38度台氏液先滴加阿托品,三十秒后再加乙酰胆碱的小肠收缩变化情况由图(四)可知小肠平滑肌的收缩无明显的变化,这是因为阿托品作为平滑肌肌膜上M受体抗结剂与M受体结合了,在滴加阿托品三十秒后再滴加乙酰胆碱,乙酰胆碱不能与小肠平滑肌肌膜上的M受体结合,就不能引起小肠平滑肌的兴奋性效应,所以其收缩没什么明显改变。
离体小肠平滑肌的生理特性及药物作用观察实验报告

离体小肠平滑肌的生理特性及药物作用观察一、实验目的: ①进一步熟悉BL-410/420多媒体生物信号记录分析系统;②学习离体肠肌的实验装置和使用方法;③观察并记录传出神经系统药物以及酸碱对离体小肠平滑肌收缩的影响二、实验对象:家兔离体小肠肠管。
三、实验原理:消化道平滑肌具有自动节律性运动的特性,其产生机理源于其肌肉细胞本身的自发缓慢放电并受中枢神经系统及体液因素的调节,所以可以取离体的小肠肠管并放置于人工创造的正常生理环境下,利用BL-410/420多媒体生物信号记录分析系统和换能器系统分别研究传出神经系统药物以及酸碱对小肠平滑肌收缩的影响。
四、实验记录与分析㈠图(一)图(一)表示小肠由38度台氏液到室温下其平滑肌收缩曲线变化情况从图(一)可以看出小肠所处温度降到室温时明显减弱,因为平滑肌收缩需要酶催化,而温度在一定范围内下降时钠钾泵及离子通道的酶的催化活性也会降低,这就可以影响钠钾钙等离子的转运,继而影响去极化和复极化的速度,进而动作电位的产生速率和幅度就会下降,所以平滑肌的收缩程度会减弱。
㈡图(二)图(二)表示在38度台氏液加入肾上腺素后小肠平滑肌收缩曲线的变化情况由图(二)可知加入肾上腺素后小肠平滑肌收缩明显减弱,这是因为肾上腺素与小肠平滑肌肌膜上的β肾上腺素能受体结合,可导致使膜超极化,从而使膜去极化达到阈电位的幅度增加,所以其动作电位的产生频率下降,所以小肠平滑肌的收缩幅度减弱。
㈢图(三)图(三)表示在正常38度台氏液里滴加乙酰胆碱的小肠平滑肌收缩曲线变化情况由图(三)可知在正常38度台氏液里滴加乙酰胆碱后小肠平滑肌收缩明显增强,这是应为乙酰胆碱与小肠平滑肌肌膜上的M受体结合后,可以在膜去极化未达到一定的电位时提前激活更多的慢钙通道,使大量的钙离子内流,进而使动作电位产生的频率增加,所以小肠的平滑肌收缩增强。
㈣图(四)图(四)表示在正常38度台氏液先滴加阿托品,三十秒后再加乙酰胆碱的小肠收缩变化情况由图(四)可知小肠平滑肌的收缩无明显的变化,这是因为阿托品作为平滑肌肌膜上M受体抗结剂与M受体结合了,在滴加阿托品三十秒后再滴加乙酰胆碱,乙酰胆碱不能与小肠平滑肌肌膜上的M受体结合,就不能引起小肠平滑肌的兴奋性效应,所以其收缩没什么明显改变。
离体小肠平滑肌的生理特性及药物作用观察实验报告
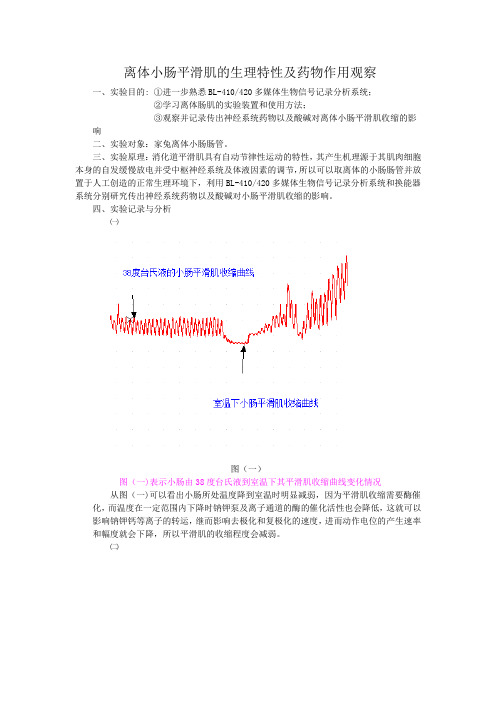
图(五)
图(五)为在正常38度台氏液里滴加盐酸几秒后再滴加氢氧化钠的小肠收缩曲线变化情况
由图(五)可知在滴加盐酸后小肠平滑肌收缩明显减弱,这是因为加入盐酸后,小肠所处环境的氢离子浓度升高,氢离子可以影响慢钙通道的开放,是钙离子内流减少,进而影响动作电位产生的频率;另外氢离子能与钙离子竞争钙调蛋白结合的位点,使肌凝蛋白ATP酶活性下降、肌纤蛋白对钙离子的敏感性下降,肌质网释放钙离子的量减少,能干扰肌肉的代谢和肌丝滑行的生化过程,所以小肠的平滑肌收缩显著减弱。当过几秒后加入氢氧化钠后中和了氢离子,使小肠所处的环境恢复正常,所以其收缩慢慢趋于正常。
离体小肠平滑肌的生理特性及药物作用观察
1、实验目的:①进一步熟悉BL-410/420多媒体生物信号记录分析系统;
②学习离体肠肌的实验装置和使用方法;
③观察并记录传出神经系统药物以及酸碱对离体小肠平滑肌收缩的影响
2、实验对象:家兔离体小肠肠管。
3、实验原理:消化道平滑肌具有自动节律性运动的特性,其产生机理源于其肌肉细胞本身的自发缓慢放电并受中枢神经系统及体液因素的调节,所以可以取离体的小肠肠管并放置于人工创造的正常生理环境下,利用BL-410/420多媒体生物信号记录分析系统和换能器系统分别研究传出神经系统药物以及酸碱对小肠平滑肌收缩的影响。
4、实验记录与分析
㈠
图(一)
图(一)表示小肠由38度台氏液到室温下其平滑收缩曲线变化情况
从图(一)可以看出小肠所处温度降到室温时明显减弱,因为平滑肌收缩需要酶催化,而温度在一定范围内下降时钠钾泵及离子通道的酶的催化活性也会降低,这就可以影响钠钾钙等离子的转运,继而影响去极化和复极化的速度,进而动作电位的产生速率和幅度就会下降,所以平滑肌的收缩程度会减弱。
离体家兔肠肌运动

家兔离体肠肌活动的影响实验【摘要】目的研究乙酰胆碱〔Ach〕、肾上腺素〔E〕、HCl、NaOH溶液25℃台氏液及缺氧复氧等条件对家兔离体肠肌运动的影响。
方法制备家兔离体小肠平滑肌标本,放置于灌流浴槽中,生物信号采集处理系统记录在不同因素作用下张力曲线。
结果滴加乙酰胆碱〔Ach〕、NaOH溶液后,肠肌运动张力和频率都增大;滴加肾上腺素〔E〕、HCl、肠肌运动张力和频率迅速降低;25℃台氏液刺激离体肠肌时,肠肌运动张力和频率先迅速下降后逐渐增大;停止通氧后,肠肌运动张力和频率逐渐降低,复氧后肠肌运动张力和频率恢复。
结论乙酰胆碱〔Ach〕、NaOH溶液刺激能促进肠肌运动,肾上腺素〔E〕、HCl能抑制肠肌运动,短时低温能使肠肌运动稍降后又加强直至正常,缺氧使肠肌运动减弱。
关键词:HCl、NaOH、离体肠肌、乙酰胆碱、肾上腺素、氧气消化道平滑肌与骨骼肌、心肌一样具有肌肉组织共有的特性。
但消化道平滑肌兴奋性较低,收缩缓慢,富有伸展性,具有紧张性、自动节律性,对化学、温度和机械张力刺激较为敏感。
给予离体肠肌以接近在体情况的适宜环境,消化道平滑肌可保持良好的生理特性。
1 实验材料与方法1.1实验材料1.1.1实验动物:家兔,雌雄不限,浙江中医药大学动物实验中心提供1.1.2实验材料与器械:麦氏浴槽、超级恒温器、张力换能器、铁支架、电脑、、木锤、止血钳、手术刀、20ml注射器、手术剪、持针器、手术圆针、缝线、烧杯、手术盘、搪瓷碗等。
蒂罗德液〔即台氏液〕:0.8%NaCl、0.02%KCl、0.026%MgSO477H2O、0.0065%NaH2PO4、0.02%CaCl2、0.1%NaHCO3、0.1%葡萄糖溶液。
肾上腺素、乙酰胆碱、HCl、NaOH溶液。
1.2实验方法1.2.1将台氏液快速充满空气小泡后,分成两份,一份置于25℃恒温水浴中,使其温度保持在25℃;另一份放放入恒温水泵中的不锈钢槽内预热至37 ~38 ℃。
离体小肠平滑肌的生理特性及药物作用观察实验报告
离体小肠平滑肌的生理特性及药物作用观察一、实验目的:①进一步熟悉BL-410/420多媒体生物信号记录分析系统;②学习离体肠肌的实验装置和使用方法;③观察并记录传出神经系统药物以及酸碱对离体小肠平滑肌收缩的影响二、实验对彖:家兔离体小肠肠管。
三、实验原理:消化道平滑肌具有自动节律性运动的特性,其产生机理源于其肌肉细胞本身的自发缓慢放电并受中枢神经系统及体液因素的调节,所以可以取离体的小肠肠管并放置于人工创造的正常生理环境卞,利用BL-410/420多媒体生物信号记录分析系统和换能器系统分别研究传出神经系统药物以及酸碱对小肠平滑肌收缩的影响。
四、实验记录与分析㈠室溫下小肠平渭肌收缩曲线图(一)图(一)表示小肠由38度台氏液到室温卞其平滑肌收缩曲线变化情况从图(一)可以看出小肠所处温度降到室温时明显减弱,因为平滑肌收缩需要酶催化,而温度在一定范閑内下降时钠钾泵及离子通道的酶的催化活性也会降低,这就可以影响钠钾钙等离子的转运,继而影响去极化和复极化的速度,进而动作电位的产生速率和幅度就会下降,所以平滑肌的收缩程度会减弱。
㈡图(二)图(二)表示在38度台氏液加入肾上腺素后小肠平滑肌收缩曲线的变化情况由图(二)可知加入肾上腺素后小肠平滑肌收缩明显减弱,这是因为肾上腺素与小肠平滑肌肌膜上的卩肾上腺素能受体结合,可导致使膜超极化,从而使膜去极化达到阈电位的幅度增加,所以其动作电位的产生频率卞降,所以小肠平滑肌的收缩幅度减弱。
㈢图(三)图(三)表示在正常38度台氏液里滴加乙酰胆碱的小肠平滑肌收缩曲线变化情况由图(三)可知在正常38度台氏液里滴加乙酰胆碱后小肠平滑肌收缩明显增强,这是应为乙酰胆碱与小肠平滑肌肌膜上的M受体结合后,可以在膜去极化未达到一定的电位时提前激活更多的慢钙通道,使大量的钙离子内流,进而使动作电位产生的频率增加,所以小肠的平滑肌收缩增强。
㈣第度台氏波小肠平滑肌收缩曲线图(四)图(四)表示在正常38度台氏液先滴加阿托品,三十秒后再加乙酰胆碱的小肠收缩变化情况由图(四)可知小肠平滑肌的收缩无明显的变化,这是因为阿托品作为平滑肌肌膜上M受体抗结剂与M受体结合了,在滴加阿托品三十秒后再滴加乙酰胆碱,乙酰胆碱不能与小肠平滑肌肌膜上的M受体结合,就不能引起小肠平滑肌的兴奋性效应,所以其收缩没什么明显改变。
离体小肠平滑肌的生理特性及药物作用观察实验报告.doc
离体小肠平滑肌的生理特性及药物作用观察一、实验目的: ①进一步熟悉BL-410/420多媒体生物信号记录分析系统;②学习离体肠肌的实验装置和使用方法;③观察并记录传出神经系统药物以及酸碱对离体小肠平滑肌收缩的影响二、实验对象:家兔离体小肠肠管。
三、实验原理:消化道平滑肌具有自动节律性运动的特性,其产生机理源于其肌肉细胞本身的自发缓慢放电并受中枢神经系统及体液因素的调节,所以可以取离体的小肠肠管并放置于人工创造的正常生理环境下,利用BL-410/420多媒体生物信号记录分析系统和换能器系统分别研究传出神经系统药物以及酸碱对小肠平滑肌收缩的影响。
四、实验记录与分析㈠图(一)图(一)表示小肠由38度台氏液到室温下其平滑肌收缩曲线变化情况从图(一)可以看出小肠所处温度降到室温时明显减弱,因为平滑肌收缩需要酶催化,而温度在一定范围内下降时钠钾泵及离子通道的酶的催化活性也会降低,这就可以影响钠钾钙等离子的转运,继而影响去极化和复极化的速度,进而动作电位的产生速率和幅度就会下降,所以平滑肌的收缩程度会减弱。
㈡图(二)图(二)表示在38度台氏液加入肾上腺素后小肠平滑肌收缩曲线的变化情况由图(二)可知加入肾上腺素后小肠平滑肌收缩明显减弱,这是因为肾上腺素与小肠平滑肌肌膜上的β肾上腺素能受体结合,可导致使膜超极化,从而使膜去极化达到阈电位的幅度增加,所以其动作电位的产生频率下降,所以小肠平滑肌的收缩幅度减弱。
㈢图(三)图(三)表示在正常38度台氏液里滴加乙酰胆碱的小肠平滑肌收缩曲线变化情况由图(三)可知在正常38度台氏液里滴加乙酰胆碱后小肠平滑肌收缩明显增强,这是应为乙酰胆碱与小肠平滑肌肌膜上的M受体结合后,可以在膜去极化未达到一定的电位时提前激活更多的慢钙通道,使大量的钙离子内流,进而使动作电位产生的频率增加,所以小肠的平滑肌收缩增强。
㈣图(四)图(四)表示在正常38度台氏液先滴加阿托品,三十秒后再加乙酰胆碱的小肠收缩变化情况由图(四)可知小肠平滑肌的收缩无明显的变化,这是因为阿托品作为平滑肌肌膜上M受体抗结剂与M受体结合了,在滴加阿托品三十秒后再滴加乙酰胆碱,乙酰胆碱不能与小肠平滑肌肌膜上的M受体结合,就不能引起小肠平滑肌的兴奋性效应,所以其收缩没什么明显改变。
整合实验:家兔胃肠运动
【实验对象】
家兔,2.5-3.0公斤, 来自沈阳医学院实验动物中心
【药品和器材】
药品:肾上腺素(1mg/1ml)、去甲肾上腺(2mg/1ml)、 妥拉苏林(25mg/1ml)、普萘洛尔(1×10-4); 乙酰胆碱(1×10-4mol/L),阿托品(1mg/2ml), 普鲁卡因(40mg/2ml),2.5%复方氯化铵溶液, 25%精氨酸,营养液:台氏液。 器材:体重秤,兔手术台1个,哺乳动物手术器械1套, 棉绳,注射器(0.25ml、5ml、20ml), 吸管(0.1ml、0.5ml、5ml),Magnus实验装置一套 (麦氏浴槽、麦氏浴管、恒温装置),供氧装置, 张力换能器,铁支架,双凹夹,计算机。
观察家兔呼吸、肌张力变化,直至痉挛 发作(出现扑翼样震颤)为止。并记录 所用复方氯化铵溶液总量及从给药开始 至肝性脑病出现的时间。 3. 立即耳缘静脉缓慢注射25%精氨酸 (5ml/kg,10min内注完)进行抢救,观 察并记录治疗后症状有无缓解。
(三)药物对离体肠管平滑肌的作用 1.标本制备: 倒提家兔,用木棒猛击其枕后部使其 猝死,然后立即剖开腹腔,轻轻剪取 十二指肠,并将其剪成2-3cm长的肠 段,用冷台氏液洗净后,装入盛有冷 台氏液的烧杯中,备各组实验用。
肾上腺素(0.2ml)→妥拉苏林(0.2ml)→ 普萘洛尔(0.2ml)→肾上腺素(0.2ml) → 台氏液冲洗(3次)→正常曲线→ 乙酰胆碱(0.1ml)→阿托品(0.1ml)→ 乙酰胆碱(0.1ml)
1.保存:停止实验→保存实验结果 (自己命名并记住) 2.编辑:文件 →打开 →编辑实验结果 (将需要的曲线拖黑,点击数据辑)→ 停止→重新命名保存 3.打印:文件 →打开 →打印编辑后的 实验结果。
【实验结果】
药理学实验教学中心开设的各门实验课的内容
实验十二:家兔有机磷中毒与解救
8 综合性实验
实验十三:传出神经系统药物对家兔血压的影响 4 综合性实验
实验十四:中枢神经系统药物辨别
4 设计性实验
实验一:心肌和脑组织的病理切片的观看
4 验证性实验
病理学与病 理生理学实 临床药学 验
实验二:肝脏和肾脏病理切片观看 实验三:病理切片观看 实验四:几种类型的缺氧
实验二:敌百虫的半数致死量的测定 实验三:戊巴比妥钠的抗惊厥作用 实验四:氢化可的松的抗炎作用及机制探讨
4 综合性实验 3 综合性实验 4 验证性实验 4 验证性实验 8 综合性实验
实验五:传出神经系统药物对离体家兔肠管平滑肌 4
的影响
综合性实验
基础药学基地
实验六:传出神经系统药物辨别
3 设计性实验
3
综合性实验 综合性实验
实验二:敌百虫的半数致死量的测定 实验三:戊巴比妥钠的抗惊厥作用
4 验证性实验 4 验证性实验
实验四:氢化可的松的抗炎作用及机制探讨
8 综合性实验
药学 临床药学
实验五:传出神经系统药物对离体家兔肠管平滑肌 4 综合性实验
必修
100
的影响
实验六:传出神经系统药物辨别
3 设计性实验
4 验证性实验
Байду номын сангаас
制药工程 中药学 食品药学 应用化学
实验四:氢化可的松的抗炎作用及机制探讨
8 综合性实验
实验五:传出神经系统药物对离体家兔肠管平滑肌 4
的影响
实验六:传出神经系统药物辨别
3
综合性实验 设计性实验
实验七:利尿药对麻醉家兔尿量及尿中 Na+、K+、 6
Cl-含量的影响
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
传出神经系统药物对家兔离体肠管平滑肌的影响
实验目的
1、掌握离体平滑肌的实验方法。
2、观察传出神经系统药物对离体家兔小肠平滑肌的作用
教学时数2学时
实验原理
一、离体实验
1、所用组织:心脏、膀胱、子宫、气管、肺、肠等均可用于离体实验
2、特点:实验条件易于控制、操作简便、结果准确、节省时间,可进行大量
药物的筛选。
3、要求:离体实验需在一定生理环境下进行,模拟体内环境。
(1)温度:38±0.5℃
(2)通氧气:1-2气泡/s
(3)营养液:含有一定离子和葡萄糖的溶液,不同的组织所选用的营养液不同。
二、离体肠管实验
1、肠管的选择:根据实验目的的不同进行选择
(1)小肠:十二指肠、空肠、回肠
(2)自律性:频率较慢,起博点位于十二指肠,自律性自上而下渐弱。
(3)空肠多做定性实验,回肠多做定量实验
2、肠内受体及作用原理
(1)受体:家兔小肠平滑肌上存在α、β、M受体。
(2)作用:α、β受体兴奋可使小肠平滑肌抑制而舒张;M受体兴奋可使小肠平滑肌兴奋而收缩。
(3)药品对受体的作用:
1、氯化乙酰胆碱(Ach):M受体激动剂,乙酰胆碱可兴奋M受体,使小肠收缩幅度
增加,蠕动加强。
2、阿托品(Atro):M受体阻断药,为竞争性拮抗剂,单独用药对肠管无作用,可阻断
M受体,对抗乙酰胆碱的M样作用,使肠管收缩幅度降低。
3、肾上腺素(Ad):α、β受体激动剂,可激活α、β受体(主要是β2受体),α、β
受体激动可产生与M受体激动相反的效应,表现为肠管舒张,小肠蠕动减弱。
4、氯化钙(Bacl2):①Ba2+进入细胞与钙调蛋白结合,使平滑肌收缩,②Ba2+可使细
胞膜发生去极化。
所以加入Bacl2肠管会发生强直性收缩,Bacl2并非作用于受体,所以阿托品不能对抗这一作用。
实验材料
1.动物:家兔
2.药品①5X10-4氯化乙酰胆碱
②0.5%硫酸阿托品
③0.1%盐酸肾上腺素
④20%BaCL2
3、器材:RM6240多媒体化生物信号记录分析系统、PC80586计算机、张
力传感器、保温式麦氏浴槽、超级恒温水浴、“L”型通气钩、高位吊瓶、量
筒、烧杯、培养器、氧气瓶、外科剪刀、眼科剪刀、眼科镊子、缝衣针、棉线、注射器、台式营养器。
实验方法
一、首先调试RM6240系统,使进入肌张力测定状态.
1.在主菜单中用鼠标选择<实验>中的<消化>,选择系统显示<平滑肌生理特性>。
2.在界面右侧控制参数区选择<张力>,〈选择3g〉,扫描速度1.0s/div,确定信号输入,选择〈通道2〉,在工具菜单选择快速归零(空载时钩上无任何东西)。
3.在主菜单中选择〈示波〉,进入示波状态。
4.在主菜单中工具栏选择〈网格切换〉对背景网格进行切换为细格,并在选项中选择波形颜色红色。
此时肌张力测试调试完毕。
二、调节仪器:
将超级恒温水浴温度调至38.5±0.5℃,向麦氏浴槽中加30ml台氏液,通
入氧气(1~2个气泡/秒)并制备家兔肠管标本。
三、正式试验:
将肠管标本两端用缝针各穿一线,一端打一空结(约lcm小套),另一端穿
上长线打结,用眼科镊钳住空结固定于通气钩上,放入麦氏浴槽中,将另端长
线的尽端打一空结,挂在张力换能器的小钩上,调节换能器高度,使前负荷为1
g,稳定标本20分钟。
在主菜单下按键选择〈记录状态〉,先描记一段正常曲线,然后按下列顺序给药。
①向麦氏浴槽内加入5X10-4MAch0.2ml同时用标记框在屏幕上作给药标记,观察肠段反应。
当反应最明显时,用暂停键,将计算机转入“示波状态”。
用台氏液冲洗肠管3遍,稳定标本15分钟,加入下列药物。
②将系统重新转入“记录状态”,描记一段正常曲线后,向麦氏浴槽中加
0.5%阿托品0.2ml并作标记,观察曲线变化,1分钟后加5X10-4MAch0.2ml
并标记,观察肠段反应。
将计算机转入“示波状态“后,用台氏液冲洗肠管3
遍。
稳定标本15分钟
③将系统重新转入“记录状态”,描记一段正常曲线后向麦氏浴槽中加0.01
%Adr0.1ml并作标记,观察曲线变化。
将计算机转入“示波状态”下冲洗肠管,稳定标本,加下列药物。
④将系统重新转入“记录状态”,描记一段正常曲线后,向麦氏浴槽中加
20%BaCl2 0.2ml并作标记,观察曲线变化。
在主菜单下选择“结束实验”,激活工具栏,系统进入分析状态。
实验结果处理
在主菜单下分析项可选择区域测量、标记查询、开始反演、鼠标捕捉,测量后按工具栏中取消标志线,测出正常曲线,加Ach后,加阿托品回复后,加Adr 后加BaCl2后肠管的收缩张力,分别求出加Ach、Adr、BaCl2所引起的张力变化值及Atro对Ach拮抗的张力回缩值,以全班数据进行统计,作t检验,并判断各药的作用是否显著。
在主菜单下打印项进行打印模式设置,可倒入测量信息、学生实验、实验信息后,预览、打印。
注意事项
1、操作时应避免牵拉肠管,造成肠管活性不好。
2、肠管两端穿线采用十字交叉法,肠管不易扭曲,便于营养液的流通。
3、每次给药前均应冲洗肠管3次,中间间隔1分钟。
4、BaCl2可使肠管产生强直性收缩,不能恢复,所以最后加BaCl2。
5、给药时将药液直接加入药液,不要碰线,也不要碰壁。
