6(上)《有机化学》(第四版)高鸿宾,华南理工大学课件(共十四章)
《有机化学》(第四版)华南理工大学课件(共十四章)

H3C
CH3
CC
H
H
C H 3 C H C H C H 3 顺–2–丁烯
2–丁烯
H3C C
H C
H
CH3
反–2–丁烯
反–2–丁烯
顺–2–丁烯 图 3.11 2–丁烯顺反异构体的模型
3.3 烯烃和炔烃的命名
3.3.1 烯基与炔基
C H 2C H
乙烯基 (vinyl)
C H 2C H C H 2 烯丙基(aallllyyllic或group)
一个C-Cσ键和4个C-Hσ键共处同一平面。
构成分子中2个碳4个氢共在一个平面 ,成平面形
分子。
H
H
CC
H H 0.134 nm
H C 。
121
H
。H
118
C H
H
H
C
H
H
图3.4 乙烯的结构
C-Cπ键的形成:垂直于sp2 杂化轨道 所在平面且相互平行的2个p 轨道进行侧面 交盖构成π键。
在π键中,电子云分布在两个C原子 所处平面的上方和下方。
不饱和烃
烯烃 炔烃
含有碳碳重键 的化合物
H H
C
C
H H
H C C H
乙烯
环己烯 乙炔
烯烃的通式:CnH2n 炔烃的通式:CnH2n-2
官能团
CC CC
3.1 烯烃和炔烃的结构
3.1.1 烯烃碳碳双键的组成
基态
激发态
sp2杂化态
2p
2p
2p
电子
跃迁
杂化 sp2
2s
2s
1s
1s
1s
图 3.1 sp2 杂化轨道形成过程示意图
8《有机化学》(第四版)高鸿宾_华南理工大学课件(共十四章)

δ δC H 面外(SP ) δN O
3
( C H 面外 SP 2、 ) SP
同碳多甲基结构有双尖峰, 吸收峰强度加强。
低频指纹区反映化合物的微小差异变化 十分灵敏。 例如:
δCH3 δ CH(CH )
3
1380cm-1处为单峰(m)
电磁波照射频率/Hz 60 200 300
B0
图8.12 核磁共振谱示意图
NMR谱图给出的结构信息: 化学位移——说明氢周围电子状况。 自旋裂分——则峰的分裂,说明相邻氢的个数. 偶合常数——自旋裂分所产生谱线的间距。 峰面积(积分线)—— 说明相同化学环境的氢 的个数的。
图8.13 乙醇的1H–NMR谱和它的三种不同质子积分曲线
8.2.2 有机化合物基团的特征频率 相同的基团或价键在特定的位置区域出 现相同的吸收峰 ——基团的特征吸收峰(特 征峰)。 影响化学键振动频率的因素: ▲ 成键原子质量越小,其化学键的振动频率 越高。 化学键 伸缩振动频率范围/cm-1
C―H 2850~2950 O―H 3200~3600 N―H 3350~3500 比C―C、C―N、C―O键的1600-1300cm-1频率高。
T/%
高频区
指纹区
图8.3 正辛烷的红外光谱图
T/%
图8.4 2–甲基庚烷的红外光谱图
表8.2 常见有机化合物基团的伸缩振动特征频率
化学键类型 频率cm-1
化学键类型
频率cm-1
单键
O H(醇、酚) O H(羧酸) N H C H C H C H C O 3200~3600 2500~3600 3350~3500 3310~3320 3000~3100 2850~2950 1025~1200
13《有机化学》(第四版)高鸿宾,华南理工大学课件(共十四章)

N
O C
Cl
苯甲酰氯
O 2 (CH3CO)2O + HO
O OH OH O O + CH3COCCH3
OH
O CH3C O + 2 CH3COOH
O
O O CCH3
吡啶
OH + CH3COO OCCH3
水杨酸
阿司匹林
O
酯
醇
O
酯
酯交换反应
H+, 94%
CH2 CH C
OCH3 + CH3CH2CH2CH2OH
本章小结: 1、羧酸衍生物的命名──酰卤和酰胺以所含酰基 结构命名;酸酐、酯是根据来源的酸和醇命 名。 2、羧酸衍生物酰基上的亲核取代反应活性由快到 慢是: 水解 > 醇解 > 氨解 酰卤 > 酸酐 > 酯 > 酰胺 3、酰胺与Br2 / NaOH(或NaOBr)作用发生 Hofmann降解反应,用于合成伯胺。
第十三章 羧酸衍生物(待改写)
13.1 羧酸衍生物的命名 13.2 羧酸衍生物的物理性质 13.3 羧酸衍生物的波谱性质 13.4 羧酸衍生物的化学性质 13.4.1 酰基上的亲核取代反应 (1)水解 (2) 醇解 (3) 氨解 13.4.2 酰基上的亲核取代反应机理 13.4.3 羧酸衍生物的相对反应活性
CH3(CH2)7CH CH(CH2)7COOC2H5
Na,C 2H5OH 50%
油酸乙酯
CH3(CH2)7CH CH(CH2)7CH2OH
油醇
工业上制备不饱和醇的唯一途径 (3) Rosenmund 还原 酰氯 H2 催化剂:Pd–BaSO4 醛
COCl
H2,Pd-BaSO4, 150℃,79% -S N
《有机化学》高鸿宾第四版课本习题答案第十四章
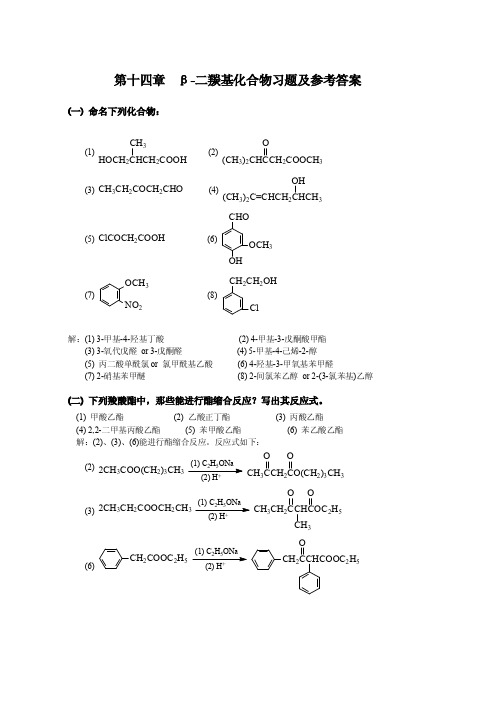
第十四章β-二羰基化合物习题及参考答案(一)命名下列化合物:(1)HOCH 2CHCH 2COOHCH 3(2)(CH 3)2CHCCH 2COOCH 3O(3)CH 3CH 2COCH 2CHO(4)(CH 3)2C=CHCH 2CHCH 3OH(5)ClCOCH 2COOH(6)CHOOCH 3OH(7)OCH 3NO 2(8)CH 2CH 2OHCl解:(1)3-甲基-4-羟基丁酸(2)4-甲基-3-戊酮酸甲酯(3)3-氧代戊醛or 3-戊酮醛(4)5-甲基-4-己烯-2-醇(5)丙二酸单酰氯or 氯甲酰基乙酸(6)4-羟基-3-甲氧基苯甲醛(7)2-硝基苯甲醚(8)2-间氯苯乙醇or 2-(3-氯苯基)乙醇(二)下列羧酸酯中,那些能进行酯缩合反应?写出其反应式。
(1)甲酸乙酯(2)乙酸正丁酯(3)丙酸乙酯(4)2,2-二甲基丙酸乙酯(5)苯甲酸乙酯(6)苯乙酸乙酯解:(2)、(3)、(6)能进行酯缩合反应。
反应式如下:(2)2CH 3COO(CH 2)3CH 3CH 3CCH 2CO(CH 2)3CH 3O O25+(3)2CH 3CH 2COOCH 2CH 3CH 3CH 2CCHCOC 2H 5OO CH 325(6)25CH 2COOC 2H 5CH 2CCHCOOC 2H 5O(三)下列各对化合物,那些是互变异构体?那些是共振杂化体?(1)CH 3C CH C CH 3OH OCH 3CCH CH 3COH O(2)CH 3C O -OH 3C C O -O(3)CH 2=CH CH=CH 2CH 2CH=CH CH 2(4)OOH解:(1)、(4)两对有氢原子核相对位置的移动,是互变异构体,(2)、(3)两对中只存在电子对的转移,而没有原子核相对位置的移动,是共振杂化体。
(四)写出下列化合物分别与乙酰乙酸乙酯钠衍生物作用后的产物。
(1)烯丙基溴(2)溴乙酸甲酯(3)溴丙酮(4)丙酰氯(5)1,2-二溴乙烷(6)α-溴代丁二酸二甲酯解:(1)CH 3CCH C OC 2H 5OO CH 2CH=CH 2(2)CH 3CCH C OC 2H 5OO CH 2COOCH 3(3)CH 3CCH C OC 2H 5OO CH 2COCH 3(4)CH 3CCH C OC 2H 5OO COC 2H 5(5)CH 3CCH C OC 2H 5O O H 2C CH 2CH 3CCHC OC 2H 5OO (6)CH 3C CH C OC 2H 5OO CHCH 2COOCH 3COOCH 3(五)以甲醇、乙醇及无机试剂为原料,经乙酰乙酸乙酯合成下列化合物。
9《有机化学》(第四版)高鸿宾_华南理工大学课件(共十四章)
(3) 羰基合成
钴催化剂 CH3CH CH2 + CO + H2 130~175℃ ~25 MPa
CH3CH2CH2CHO + CH3CHCHO
CH3
H2, Ni 或 Cu △,~5 MPa
CH3CH2CH2CH2OH + CH3CHCH2OH CH3
(4) 发酵法 乙醇的制备: 淀粉
淀粉酶
麦芽糖 麦芽糖酶 葡萄糖
OH OH HO OH OH
叔醇
酚:按分子中所含羟基的数目分类:
OH
一元酚
二元酚
三元酚
9.1.2 醇和酚的命名
(1) 醇的命名 (a) 普通命名法:——用于简单的醇。 烃基的名称 + ―醇”
CH3 CH3 CHCH2OH
CH2 CHCH2 OH
CH2OH
异丁醇
烯丙醇
苯甲醇 苄醇
CH2=CHCH2OH
R2SO4 + H2O 2 ROH + H2SO4 △ O O + H ROH + R-C-OH △ R-C-OR + H2O
ROH + CH3 ( TsCl)
δ+
SO2Cl
N
△
O RO-S CH3 + O ( ROTs)
N
. HCl
ROO2S
二甲亚砜
CH3 KCN RCN + CH3 SO3K ( TsK) NaBr RBr + TsONa
弱酸 H2CO3 PKa值 6. 38
9. 89 15.5
弱酸
PKa值
15 .74 15.9 18.0 25.0
OH CH3OH
H2O CH3CH2OH (CH3)3COH HC≡CH
醇和酚的相对酸性: 碳酸>苯酚>水>乙醇
《有机化学》(第四版)高鸿宾,华南理工大学课件

CH3 CH3 CH2 C CH CH3
CH3 CH3
二甲基乙基异丙基甲烷
(3) 系统命名法
International Union of Pure and Applied Chemistry,缩写作IUPAC
系统命名是由三部分构成:
取代基
的
母体
位次与名称
化合物 的
名称
碳原子的个数
直链烷烃的命名与普通命名法相同。
1
2
3
4 CH2CH2CH3
CH3 CH2 CH2 CH C5H C6H2 C7H2 C8H2 C9 H3
CH CH3
CH3
4-isopropyl-5-propylnonane
(5–丙基–4 –异丙基壬烷)
• 当两个或更多的相同取代基出现时,使用 前缀di-, tri-, tetra-等:
CH3
CH3
98
CH3CH2
CH3 CH2CH3
CH3
CH
7
C6 H2
C5 H2
CH CH
43
C2H2C1H3
(I)
1
2
CH3CH2
CH3 CH2CH3
CH3 C3 H
C4 H2
C5 H2
CH CH
67
C8 H2C9 H3
( II )
(c) 确定化合物的名称 • 将取代基的名称写在母体名称的前面,在
取代基名称的前面加上它的位次号,并用 半个汉字长的横线“–”将两者连接。 • 当含有几个不同的取代基时,按照“次序 规则”,将“优先”的基团列在后面,各取 代基 之间用半个汉字长的横线“–”连接。
上“环”字,称“环某烷”。环上有支链时,支 链作为取代基。
有机化学 高鸿宾 第四版 答案 第十四章 二羰基

第十四章 β-二羰基化合物(一) 命名下列化合物:(1)HOCH 2CHCH 2COOHCH 3(2)(CH 3)2CHCCH 2COOCH 3O(3) CH 3CH 2COCH 2CHO (4)(CH 3)2C=CHCH 23OH(5) ClCOCH 2COOH (6)CHOOCH 3(7)OCH 3NO 2(8)CH 2CH 2OHCl解:(1) 3-甲基-4-羟基丁酸 (2) 4-甲基-3-戊酮酸甲酯(3) 3-氧代戊醛 or 3-戊酮醛 (4) 5-甲基-4-己烯-2-醇 (5) 丙二酸单酰氯or 氯甲酰基乙酸 (6) 4-羟基-3-甲氧基苯甲醛(7) 2-硝基苯甲醚 (8) 2-间氯苯乙醇 or 2-(3-氯苯基)乙醇(二) 下列羧酸酯中,那些能进行酯缩合反应?写出其反应式。
(1) 甲酸乙酯 (2) 乙酸正丁酯 (3) 丙酸乙酯(4) 2,2-二甲基丙酸乙酯 (5) 苯甲酸乙酯 (6) 苯乙酸乙酯 解:(2)、(3)、(6)能进行酯缩合反应。
反应式如下: (2) 2CH 3COO(CH 2)3CH 3CH 3CCH 2CO(CH 2)3CH 3O O25(3) 2CH 3CH 2COOCH 2CH 3CH 3CH 2CCHCOC 2H 5OO325(6)25CH 2COOC 2H 5CH 2CCHCOOC 2H 5O(三) 下列各对化合物,那些是互变异构体?那些是共振杂化体?(1)CH 3CH CH 3OH OCH 3C CH H 3C OH O 和(2) CH 3C O -H 3C CO-O和(3) 和CH 2=CH CH=CH 2CH 2CH=CH CH 2(4)和OOH解:(1)、(4)两对有氢原子核相对位置的移动,是互变异构体,(2)、(3)两对中只存在电子对的转移,而没有原子核相对位置的移动,是共振杂化体。
(四) 写出下列化合物分别与乙酰乙酸乙酯钠衍生物作用后的产物。
(1) 烯丙基溴 (2) 溴乙酸甲酯 (3) 溴丙酮(4) 丙酰氯 (5) 1,2-二溴乙烷 (6)α-溴代丁二酸二甲酯解:(1) CH 3CCH OC 2H 5OO 2CH=CH 2(2) CH 3C CH C OC 2H 5O O 2COOCH 3(3) CH 3CCH OC 2H 5OO CH 2COCH 3(4) CH 3C CH OC 2H 5OO COC 2H 5(5)CH 3CCH OC 2H 5O O H 2C CH 2CH 3CCHC OC 2H 5OO (6)CH 3C CH OC 2H 5OOCHCH 2COOCH 3COOCH 3(五) 以甲醇、乙醇及无机试剂为原料,经乙酰乙酸乙酯合成下列化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Br H C CH3 C H 2C H 3 CH3
Br C H
C H 2C H 3
两个分子为实物和镜像的关系:彼此 不能重合,如同人的左、右手一样。
图 6.1 2–溴丁烷分子模型示意图
手(征)性: 分子与它的镜像不能重合的性质。 手性分子——不能与自身镜像重合的分子。
非手性分子——能够与自身镜像重合的分子。
6.1 异构体的分类
构造异构
异 构 体 ──具有相同 的分子式,原 子成键的顺序 不同。
碳架异构
官能团位次 异构 官能团异构 互变异构 构象异构 对映异构
──具有相同 构型异构 的构造,原子 非对映异构 或基团在空间 的排布不同。
立体异构
构象异构体——分子的构造相同,分子的 构型相同,由于C-C的旋转,原子 或基团在空间的排布不同。 构型异构体——分子的构造相同,分子的 构型不同 例如:顺反异构体、非对映异构体。
(±)–乳酸
葡萄糖发酵得到
从肌肉中得到
互为镜像关系的两个对映体,分子式相 同,构造式相同,物理性质相同,化学性质 相同,对偏振光振动平面的旋转(旋光)度数 也相同。 但原子或基团在空间排列的顺序不同, 在有手性条件下化学反应活性不相同,旋光 方向相反。比旋光度不一样。
对映异构体的异同点: 相同点 1、分子式、构造式都相同。 2、物理性质相同。 3、化学性质相同。 4、旋光度数相同。 不同点 1、构型不同。(原子或基团在空间排列的 顺序不同) 2、化学活性不相同。 3、比旋光度不相同。 4、旋光方向不相同。
等量的对映体的混合物——外消旋体(±) 例如:2–丁醇的两个对映体
(–)–2–丁醇,
(+)–2–丁醇
外消旋体 :(±)–2–丁醇
图 6.10 2–丁醇对映体的示意图
乳酸:
H 3C
H *C O C OH OH HO O C HO
H C* CH3
∣
图 6.11 乳酸对映体 的示意图 15 (–)–乳酸[α]D15 –3.82° [α]D = + 3.82°(+)–乳酸 =
图6.9 旋光仪示意图
比旋光度: [α] λ
α:旋光度; ρB: 质量浓度(g/ml); l: 样品管长度(dm);
t=
α
ρB × l t:温度;λ:波长, 钠光:D, 589nm
旋光物的旋光度α是右旋还是左旋(旋光 方向)要以两次不同浓度测定才能确定。 比旋光度的数值要标明测定时的条件。 例: 20 .8。水 果糖水溶液的 比旋光度 [α ] D = 92 ( )
第六章 立体化学
6.1 异构体的分类 6.2手性和对称性 6.2.1 分子的手性 对映异构 对映 (异构) 体 6.2.2 对称因素 6.3 手性分子的性质——光学活性 6.3.1 旋光性 6.3.2 旋光仪和比旋光度 6.4 具有一个手性中心的对映体 分子的构型 6.4.1 对映体和外消旋体的性质 6.4.2 构型的表示法 6.4.3 构型的标记法
6.2.2 对称因素
(1) 对称面 (σ) 能把分子分割成互为镜像两半部分的平 面,称为对称面。 例如:2–氯丙烷
Cl C H 3C H CH3
图6.5 分子中的对称面的示意图 (I)
(E)–1,2–二氯乙烯
Cl C =C H
H Cl
图6.6 分子中的对称面的示意图 (II)
(2) 对称中心(i) ——经分子的中心点作任意直线,在直线的 反向等距离上都有相同原子或基团时, 这中心点就称为分子的对称中心。 例如: 反–1,3–二氟–反–2,4–二氯环丁烷
Cl H F H
H F
.H
Cl
分子中的对称中心
有对称面或对称中心的分子都是非手性 分子——这是因为它们是对称分子,分子与 其镜像能够重合,没有对映异构体。 含一个手性碳的化合物一定没有对称因 素,没有对称因素的化合物一定不能与其镜 象重合,所以有一对对映体,是 手性分子。 例如 乳酸有一对对映体:
6.5 具有两个手性中心的对映异构 6.5.1 具有两个不同手性碳原子的对映异构 6.5.2 具有两个相同手性碳原子的对映异构 6.6 手性中心的产生 6.6.1 第一个手性中心的产生 6.6.2 第二个手性中心的产生 6.7 手性合成 6.8 外消旋体的拆分 旋光纯度 6.9 脂环化合物的立体异构 6.10 构象对映体和构象非对映体 6.11 不含手性中心化合物的对映异构 6.11.1 丙二烯型化合物 6.11.2 联苯型化合物 6.12 对映异构在研究反应机理中的应用
H HO C CH3 COOH
H C HOOC OH CH3
C H CH3
O CH2 H 2C
O C H CH3
(+)–乳酸
(-)–乳酸
1,2–环氧丙烷
6.3 手性分子的性质—光学活性
6.3.1 旋光性(optical activity)
图6.8 普通光和平面偏振光示意图
通过Nicol 棱镜的光线为平面偏振光。 当平面偏振光通过手性分子时,偏振光 振动的平面发生旋转。 能使偏振光振动平面旋转的物质,称为 旋光性物质或光学活性物质或手性物质。
手性分子的两个对映体使偏振光振动 平面旋转的角度相同,而方向相反。 能使偏振光振动平面向右旋的为右旋物 质,用“+”或“d”表示右旋。 能使偏振光振动平面向左旋的为左旋物 质,用“−”或“l”表示右旋。
用“±”或“dl”表示外消旋体
外消旋体——右旋物质与左旋物质各占50% 的混合物。
6.3.2 旋光仪和比旋光度 旋光仪——检测偏振光平面旋转的仪器
手性分子是不对称分子;非 手性分子 是对称分子。 手性分子具有两种构型。 对映异构体: 具有相同的分子构造,但构型不同,互 为镜像不能重合的两个分子。
1–氟–1–氯甲烷为非手性分子
图 6.2 1–氟–1–氯甲烷分子模型示意图
CH3 H C OH C H 2C H 3
H 3C H 2C
CH3 C H OH
左旋物质与右旋物质在应用上通常有不 同应用效果。例如 : 左旋氯霉素有抗菌作用,右旋的无抗菌 作用。 左旋谷氨酸能治疗肝昏迷症,右旋的无 这作用。 右旋葡萄糖在医药上用作营养剂,起到 强心、利尿、解毒作用,能被人体吸收代谢。 左旋的不能被吸收。
对映异构现象在生物、 食品、医药等领 域的应用和研究都有重要意义。
6.2 手性和对称性
6.2.1 分子的手性 对映异构 对映(异构)体
手性——两个分子互相成为左右手镜像关系 但又不能重叠的现象,称为手性。 手性碳——连接四个不同原子或基团的碳。
含一个手性碳原子(不对称碳原子)的化合 物一定有另一个互为镜像关系的对映异构体 (旋光异构体)。 也就是:
当一个碳原子与四个不同的原子或基团 相连时,分子在空间一定有两种不同的排列 方式。 例如: 2–溴丁烷
( )
2
丁醇
(+) H
2
丁醇
CH3 HO H C H 2C H 3 [α ]
20
CH3 OH C H 2C H 3
D
=
.2 5 。 13
[α ]
20
D
.2 5。 = + 13
6.4 具有一个手性中心的对映异构 分子构型 6.4.1 对映体和外消旋体的性质 手性中心(不对称中心): ——与四个不同原子或基团相连的碳原子
对映体 对映体的特点: ▲ 两者的关系为:实物与镜像 关系。 ▲ 没有对称因素。 ▲ 不能相互重叠。 ▲ 分子的构造式相同, 但原子或基团在空间排 列的顺序不同。 ▲ 都有旋光性质。
2–丁醇:
H H 3C C C H 2C H 3 OH H 3C H 2C HO H C CH3
镜面
图6.3 2–丁醇的对映异构体
CH3 C H 3C H 2 C H Br
CH3
COOH H HO C CH3
6 5 1 2
*
3
H 4 C
ቤተ መጻሕፍቲ ባይዱ
CH2
2–溴丁烷
(–)–乳酸
CH 3
柠檬油精
含一个手性中心的分子具有一对对映体
CH3 D H C
CH3
H 2C O
C CH3
*
H
*
Cl Cl
*C
D H
1,2–环氧丙烷
使偏振光光波振动平面反时针旋转的对映体 ——左旋体(–), 使偏振光光波振动平面顺时针旋转的对映体 ——右旋体(+)。
