《探究二氧化硫化学性质》微型实验设计
SO2制取与性质一体化微型实验

SO2制取与性质一体化微型实验
SO2的制取方法有多种,包括焦化炉废气中的SO2气体分离、硫矿的燃烧以及二氧化硫晶体的升华等。
下面将介绍一种SO2制取与性质一体化的微型实验。
实验原理:
SO2是一种无色、刺激性气味的气体,可以由硫矿的燃烧反应得到。
硫矿是一种富含硫的矿石,将其在适当条件下进行燃烧,可以释放出SO2气体。
SO2气体与空气中的湿气反应,生成亚硫酸氢钠(NaHSO3),这是SO2的一个重要性质。
实验材料:
1. 硫矿颗粒
2. 实验装置:导管、集气瓶、蓄水瓶等
3. 水和氢氧化钠(NaOH)溶液
实验步骤:
1. 将硫矿放入一个实验装置中,加热使其燃烧。
2. 在装置的出口处接上一个导管,导管的另一端进入一个蓄水瓶内,用于收集产生的SO2气体。
3. 在蓄水瓶中添加一些水,以使SO2气体与水发生反应。
4. 将蓄水瓶中的混合液体倒入一个试管中,加入少量的NaOH溶液。
5. 观察试管中液体的变化。
实验结果:
在与NaOH溶液反应后,试管中的液体应变为红色。
这是因为SO2气体与水反应生成的NaHSO3亚硫酸氢钠可以与NaOH反应生成苏打灰(Na2CO3)和亚硫酸钠(Na2SO3)。
亚硫酸钠具有还原性,可以还原Na2CO3中的Na+离子,使其显红。
所以实验结果显示为红色。
这个微型实验可以帮助我们更好地理解SO2的制取和性质,同时也展示了化学反应产生的颜色变化现象。
SO2制取与性质一体化微型实验

SO2制取与性质一体化微型实验二氧化硫是一种无色、有刺激性气味的气体,它是一种重要的化工原料,广泛用于制造二硫化碳、硫酸等化学品。
本实验主要介绍了一种简单的制取二氧化硫的方法,并通过一系列的实验探究了二氧化硫的性质。
实验材料:1. 草酸二钠片2. 粗糖3. 硫酸4. 水5. 烧杯6. 平底瓶7. 气球8. 磁力搅拌器9. 密封胶皮栓10. 火柴实验步骤:1. 取一小块草酸二钠片放入烧杯中,加入适量的水搅拌,直至草酸二钠完全溶解。
2. 将溶解的草酸二钠液倒入平底瓶中。
3. 加入适量的硫酸,搅拌均匀。
4. 取一小块粗糖点燃,放入平底瓶中。
5. 迅速将橡皮栓盖在平底瓶口,让二氧化硫气体充满瓶子。
6. 取一个气球,将其拉伸一下,然后迅速将气球套在平底瓶口,使气体进入气球。
实验现象:点燃粗糖后,它燃烧产生的热能使草酸与硫酸反应,生成二氧化硫气体。
二氧化硫气体充满平底瓶后,迅速将气球套在瓶口,气球开始膨胀。
实验原理:草酸与硫酸反应生成二氧化硫的化学方程式如下:(Na2C2O4 + H2SO4 -> Na2SO4 + H2C2O4)H2C2O4 + 2H2SO4 -> CO2↑ + SO2↑ + 2H2O通过添加草酸二钠和硫酸,我们可以制备二氧化硫气体。
点燃粗糖后,它作为草酸和硫酸反应的燃料,提供了燃料的热能。
二氧化硫的性质:1. 二氧化硫是无色气体,有刺激性的气味。
2. 二氧化硫具有较高的溶解度,可溶于水形成亚硫酸。
3. 二氧化硫是一种还原剂,在强氧化剂存在下可以被氧化为硫酸。
4. 二氧化硫具有一定的毒性,高浓度的二氧化硫会对人体呼吸系统造成刺激和损伤。
二氧化硫性质的微型化学实验设计

二氧化硫性质的微型化学实验设计常德市鼎城区第一中学邓旭立一、实验目的SO2是高中化学的重点内容之一,同时,它也是我们所熟知的一种大气污染物。
教材上SO2的演示实验存在两点不足:1. 实验中使用的二氧化硫的水溶液浓度很低,品红褪色现象不明显;2. 分解的产生SO2未经处理,直接排放到空气中会对环境造成污染。
通过本次实验改进,节约了上课时间,避免了实验过程中SO2气体对环境的污染,增强了学生的环保意识,提高了学生观察问题,分析问题的能力。
二、实验仪器及试剂Na2SO3粉末,浓硫酸,NaOH溶液,饱和硫化钠溶液,酸性高锰酸钾溶液、品红溶液,紫色石蕊溶液,100 mm表面皿,105 mm、125 mm培养皿各一个,棉花,橡皮泥。
三、实验仪器装置图及仪器的组装说明如图(a)、(b),将100 mm表面皿用橡皮泥固定在125 mm培养皿中央,然后,在表面皿上放3小团棉花,并在棉花上分别滴加三滴酸性高锰酸钾溶液、品红溶液,紫色石蕊溶液,向105 mm培养皿中滴几滴饱和硫化钠溶液,旋转、摇匀。
四、实验操作向Na2SO3粉末中滴几滴浓硫酸,迅速盖好105 mm的培养皿,有大量气泡产生。
几分钟后,高锰酸钾褪色,说明SO2有还原性;品红褪色,说明SO2有漂白性;105 mm培养皿内壁上有淡黄色固体生成,说明SO2有氧化性;紫色石蕊变红说明SO2的水溶液呈酸性。
最后,向125 mm培养皿中加入适量NaOH溶液,并适当上提105 mm培养皿,使NaOH溶液顺利进入反应装置中,从而除去装置中剩余的SO2。
五、改进的意义本实验改进后的优点主要体现在以下几个方面:1. 对比教材必修(一)中的演示实验,本实验新增了SO2的氧化性,还原性实验,并且将SO2的几个性质实验整合在一起,节约药品,节省时间。
2. 实验装置封闭,反应完毕用NaOH溶液吸收剩余的SO2,减少了对的环境造成污染,体现了绿色化学的概念。
3. 实验内容简单,适合学生做分组实验。
二氧化硫制备及性质微型实验创新设计
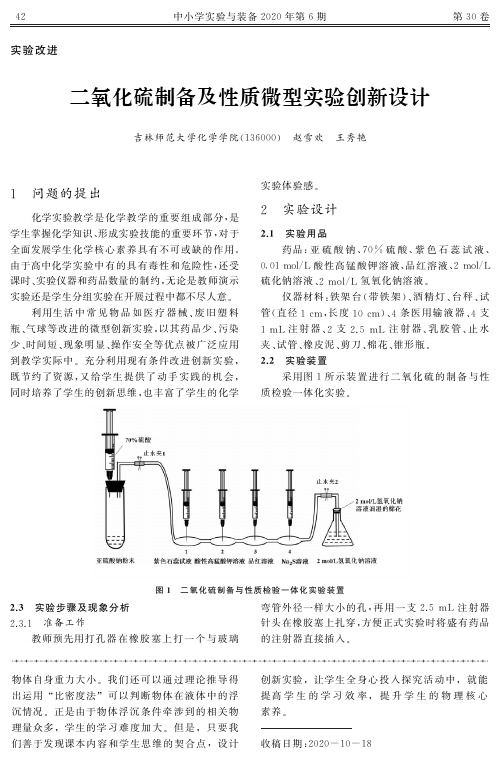
5 可反复操作,直至完全反应
4 个输液器滴壶中的反应速率很快,现象鲜明
但转瞬即逝,学生操作时可以通过两处止水夹的开
3.
2 实验药品微量化,实验现象明显化
随着实验装置的微型化,实验药品也相应实现
关控制反应的即时停止和发生,继续推动注射器内
了微量化,进一步降低了实验成本.输液器滴壶无
观察 4 个滴 壶 中 颜 色 的 变 化.微 型 微 量 化 的 设 计
5 mL 待
检验的紫色石 蕊 试 液、酸 性 高 锰 酸 钾 溶 液、品 红 溶
氢氧化钠溶液,加入右侧锥形瓶中至其容积的1/3,
NaOH 溶液浸湿 的 棉 花 团 来 密 封.其 他 药 品 暂 不
加入,
2.
5 mL 注射器在橡胶塞上不拔出,暂 时 用 来
密封小孔.按图 1 所示连接好实验装置,试管用铁
4 mL70% 硫 酸 注 入 试 管
中,启动系列实验反应.
2.
3.
4 观察现象,分析结果
依次观察编号 1、
2、
3、
4滴壶中试液颜色的变
化,填好实验记录表(见表 1).
表 1 二氧化硫性质实验现象与结论
滴壶的编号
实验现象
实验结论
1
紫色石蕊试液变红
SO2 与水反应生成亚硫酸
2
酸性高锰酸钾溶液褪色
4
既节约了资源,又 给 学 生 提 供 了 动 手 实 践 的 机 会,
同时培养了学生的创新思维,也丰富了学生的化学
2 实验设计
2.
1 实验用品
药品:亚 硫 酸 钠、
70% 硫 酸、紫 色 石 蕊 试 液、
/L 酸 性 高 锰 酸 钾 溶 液、品 红 溶 液、
二氧化硫性质的微型化学实验设计

l、
实验操作厦现象说明 实骋开始前安装好实验装置(如图),检查鼗置的气密性,打开必r t,芙闭夹子2。 实验操作开始时,将注射器l中的浓硫酸注入装有驱航睦钠的集气瓶qI.产生的部 分‘£体将发生装置殛所连接的导管t1I的空气捧尽。
2、
3、
约15 S后,打开夹子2,关闭夹子l,气体进入集气瓶2。可观察到粘贴在试管壁 上润湿的蓝色石蕊试纸变红,证明二氧化硫是一种酸性气体。
二氧化硫性质的微型化学实验设计
作中学,云南瑞丽,678600
本文链接:/Conference_7714339.aspx
3、让教师演示此实验时,现象更清楚,实验效果更好:
4、让学生自己在家也能动手做这个实验:让想做1+1不等于2实验的人,都能做这个实验; 5、让连量筒也没有的学校也能做这个实验: 二、实验仪器及试剂 一次性输液器3套(或10 IllL人肚移液管一只)、电子天平(感量0 lg)、数字测温温 度仪、烧杯(100 lⅡL、200皿L各两个)泡沫塑料一块、量筒(10 mE)卜2只、胶头滴管 2只、橡皮筋2-3根:蒸馏水、95%的酒精(或无水酒精) 实验仪器装置圈
五、
1、
改进的意义 该微型实验将二氧化硫的制取和二氧化硫三个性质的验证集中在一套装置中进行+ 变教材分散实验为综合一体实验。
2、
教材实验在验证二氧化硫的性质之前,需用试管收集满二氧化硫,在操作中气体会 溢出试管。改进后的实验在几乎封闭的体系中完成,避免了气体溢出对环境、对人 体造成的危害。
3、
4、
该微型实验与教材实验相比,药品用量明显减少,节约了药品。 教材中将收集满二氧化硫的试管倒扣于水槽中,我们将此操作改进为用一根球形玻 璃导管(废旧移液管改造)收集满气体,玻璃导管F端插^水中(如图,收集满时 夹子1关闭)。这样实验操作更简洁、方便,并且实现了废物的再利用。
二氧化硫性质实验的微型化设计

造性融为一 体,培 养 学 生 的 节 约 意 识、环 保 意 识、
验及 学 生 分 组 实 验 中,让 实 验 到 教 学 实 现 了 从
安全意识和创新意识.
合一体化,使 实 验 操 作 更 加 简 约;其 次,让 零 碎 的
收稿日期:
2019-10-16
“零”到 “整”的 转 化. 首 先,让 零 散 的 实 验 仪 器 整
KMnO4 溶液、
2 mo
l
2.
2 实验装置
该装置主要包括气体制备、性质检验及尾气处
理 3 个部分,如图 1 所示.气体制备部分是采用微
型锥形瓶 (盛 放 Na2SO3 固 体 )和 5 mL 的 注 射 器
第 29 卷
中小学实验与装备 2019 年第 6 期
(盛放 70% 的 H2SO4 溶液)结合完成 SO2 的制取;
性质检验部分是在 Y 型管内一次性完成 SO2 的漂
白性、氧化性、酸 性、还 原 性 等 其 诸 多 性 质 的 验 证;
由于实验所用的药 品 较 少,产 生 的 SO2 气 体 很 少,
1 实验用品
仪器材料:铁 架 台 (带 铁 夹)、微 型 Y 型 管、注
分组实验; ② 二氧化硫的性质不能一次得到验证,
杯、滤纸、剪刀、止水夹、镊子、橡胶圈、透明胶带.
耗时较长; ③ 实 验 中 二 氧 化 硫 易 逸 散, 既 危 害 教
师和学生的 身 体 健 康, 又 污 染 环 境, 而 且 实 验 效
5cm左 右,用 胶 头 滴 管 分 别 滴 加
紫色石 蕊 试 液 和 Na2S 溶 液 于 滤 纸 环 上. 在 Y 型
管 3 处 加 入 1 mL 品 红 溶 液,在 Y 型 管 4 处 加 入
二氧化硫化学性质实验探究设计

二氧化硫化学性质实验探究设计
一、实验目的
1.了解二氧化硫的化学性质;
2.探究二氧化硫的反应性;
3.探讨二氧化硫在实际应用中的作用。
二、实验原理
二氧化硫是一种重要的气体,是有机物燃烧产生的主要有害物质之一、它是一种半导体,在空气中存在一定量,具有强烈的气味和特殊的化学性质。
根据既定实验条件,可以使用实验方法观察它的化学性质,从而探究
它的反应性,并了解它在实际应用中的作用。
三、实验准备
1.化学药品:盐酸、硫酸铵、硫酸钠、氢氧化钠、硫酸铵水溶液等;
2.实验器材:1000毫升大孔杯、0-14浓度质量移液管、100毫升烧杯、洗涤瓶、恒温水浴、烧瓶、水槽、烧瓶夹等;
3.耗材:实验用玻璃管、塞芯等。
四、实验步骤
1.将1000毫升大孔杯内的空气抽空,用实验用玻璃管把硫酸铵水溶
液3毫升加入到不含空气的大孔杯中,然后用洗涤瓶把大孔杯充满气体空气,稳定0.05毫米沿四周。
2.在水槽中加入适量的盐酸和硫酸钠溶液,将恒温水浴放入水槽中,调节恒温水浴的温度,使水槽中的液体温度稳定在50℃。
3.将100毫升烧杯放入恒温水浴中,然后用通过硫酸铵在烧杯中加入氢氧化钠50毫升,安装烧瓶夹。
二氧化硫微型实验设计

二氧化硫微型实验设计何燕君(咸祥中学宁波市鄞州区 325141)摘要:为了克服传统二氧化硫性质实验药品浪费,耗时长,污染大,操作繁琐,难以组织学生实验等不足之处,笔者对该实验作了改进设计,利用青霉素药瓶,一次性针筒,导管,药用玻璃管等仪器,设计了在全封闭微型装置中,完成二氧化硫的还原性,酸性,漂白性的检验,结果表明,实验现象和效果俱佳,同时能有效开展学生分组实验。
关键词:二氧化硫的性质;全封闭微型装置;实验改进1 问题提出《普通高中化学课程标准(实验)》实施建议指出:要鼓励教师和实验管理人员开发实验仪器,研究低成本、少污染的化学实验。
同时也应鼓励学生和教师充分利用生活中的常见用品和废弃物,设计富有特色的实验和实践活动[1]。
现行苏教版普通高中课程标准实验教科书﹒化学1(必修)[2] 专题四第一单元中二氧化硫的性质实验是一个传统的的经典实验,尽管实验目的明确,但却存在诸多不尽如人意的地方。
其一,书本中实验都是将二氧化硫溶于水配成溶液检验二氧化硫的相关性质,如果作为课堂演示实验,一般该溶液是事先配制好,有可能不能达到预期效果。
其二,制取二氧化硫水溶液时,由于二氧化硫溶解度不大,导致配制时逸散比较严重;而且二氧化硫的漂白性是在一个敞开的环境中进行,以上两点均不符合绿色化学观念。
其三,教材中的实验每次只能检验一个二氧化硫的性质,过程繁琐,浪费时间,耗时长,且没有二氧化硫能使酸性高锰酸钾褪色的实验,不利于节约课堂时间和提高课堂效率。
针对以上不足之处,笔者设计了能一次性检验二氧化硫酸性、还原性、漂白性的一套微型改进装置,恰好弥补了现行教材中的实验局限性,能激发学生的学习兴趣,培养学生的动手能力,对促进教师教学质量和提高学生素养有着积极的作用。
2 实验原理2.1 二氧化硫的制取实验室制备二氧化硫的原理:Na2SO3 + H2SO4(浓) = Na2SO4 + SO2↑+ H2O2.2 二氧化硫性质的检验2.2.1 二氧化硫的还原性BaCl2 + H2O2 + SO2 = BaSO4↓ + 2HCl2KMnO4 + 5SO2 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO42.2.2 二氧化硫溶于水后显酸性SO2 + H2O = H2SO3 H+ + HSO3-2.2.3 二氧化硫和品红能生成不稳定的无色物质,加热无色物质分解又恢复原色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《探究二氧化硫化学性质》微型实验设计
一.实验目的
二氧化硫是高一教材元素化合物体系中的一种重要的物质,其典型性质成为许多题目的载体。
然而它又是一种有毒大气污染物,危害人体健康。
现行高中教材有关于二氧化硫性质的演示实验多为试管实验,操作繁琐,耗时较长,药品使用量较大,且现象不太明显,同时实验过程污染性较大。
基于这些缺点,并加深学生对二氧化硫性质的理解,现对二氧化硫性质实验进行改进,设计一套节约、环保、微量、简便易行的实验装置。
二.实验仪器及试剂
药品:浓硫酸、亚硫酸钠固体、蓝色石蕊试纸、高锰酸钾溶液、品红溶液、H2S 溶液、氢氧化钠溶液、棉花;
仪器:具支玻璃瓶(自己设计)、注射器、玻璃管、橡胶管、止水夹、破裂的试管、小气球、橡胶塞、酒精灯。
三.实验仪器示意图及组装说明
组装说明:图中A为自己设计的具支玻璃瓶,带有四个支管口;a、b、c、d分别为四个止水夹,当产生气体较多时可以将a、b、c个止水夹同时打开,如气流较小时,可
逐个打开止水夹;判断气流的大小可根据气球鼓起的速率;当反应结束时,可打开d 止水夹,用蘸有氢氧化钠溶液的棉花吸收多余的二氧化硫或者关闭d止水夹,将二氧化硫收集在气球中。
四.实验操作
连接好装置,检查装置气密性。
取一定量的亚硫酸钠于玻璃瓶中,并用注射器注入适量浓硫酸。
观察实验现象:加入浓硫酸后立即有大量气泡产生,润湿的蓝色石蕊试纸变红;打开a止水夹,高锰酸钾溶液逐渐褪色,证明二氧化硫具有还原性;打开b 止水夹,品红溶液逐渐褪色(用酒精灯加热后,颜色恢复),证明二氧化硫具有漂白性,且该漂白性具有可逆性;打开c止水夹,盛有H2S溶液的玻璃管中有点黄色固体生成,证明二氧化硫具有氧化性;气球逐渐鼓起。
五.改进的意义
首先,该装置能较好的展示二氧化硫的主要化学性质,是用于课堂教学和学生分组实验;其次,该装置操作简单,现象明显,所需实验时间短,效率高;再次,实验所需药品少,是微型实验,符合“绿色化学”的要求,且可对多余的二氧化硫的进行充分处理,防止二氧化硫外泄污染环境;最后,该装置具有一定的普适性,也可以用于其它气体性质的探究实验,如氯气、乙炔等气体。
