第三章气体分子热运动速率和能量的统计分布律02419
热学-第三章气体分子热运动速率和能量分布

物理意义: 速率在 v 附近,单位速率区间的分子数占总分子数
的概率,或概率密度。
dN f (v)dv N
dN = f (v )dv N v1
v2
表示速率分布在v→v+dv内的 分子数占总分子数的概率 表示速率分布在v1→v2内的分 子数占总分子数的概率
N
0
dN f v dv 1 N 0
dω= 4πv2dv
麦克斯韦速率分布律
将dω=dvxdvydvz代入
dN m e N 2 kT
x y
3 2 2 2 m ( v v v 2 x y z) 2 2 kT
v dv dv dv x y z
麦克斯韦 速率分布 分布律
2 2 2 2 且: v v v v z
3 2
麦克斯韦 速率分布函数 f(v)
m 4 f v e kT 2
3 2 mv 2 2 kT 2
v
f(vP)
m——分子的质量 T——热力学温度 k——玻耳兹曼常量 面积= dN/N 曲线下面宽度为 dv 的小窄条面积等于 分布在此速率区间 内的分子数占总分 子数的概率dN/N 。. v
第三章 气体分子热运动速率和能量分布
§3.1气体分子的速率分布律
§3.2用分子射线实验验证麦克斯韦速度分布 §3.3珀尔兹曼分布率 重力场中微粒按高度的分 布 §3.4能量按自由度均分定理
3-1 麦克斯韦气体速率分布律
第一章我们引入了平衡态和温度的概念,但在热力学范围内不 能得到深刻的认识。第二章以分子运动论为基础,认识了压强 和温度的微观本质,对平衡态下分子热运动的规律有了初步认 识,我们有一个基本的统计公理(假设)。这个公理只解决了 分子热运动速度方向的几率问题,并没有涉及分子热运动速率 大小取值的概率,无法作进一步的定量分析。分子热运动情况 是分子物理的重要研究对象,我们必须讨论速率大小取值的概 率问题。由于分子数目如此巨大,速率的取值从0到∞,这个 取值区间非常大,分子在任何一个微小速率范围内的取值其概 率都不会大,但到底有多小却不易判断。所以,这是一个大数 量偶然微观运动的集体效应的问题,既统计的问题,对应的规 律就是一个统计规律。一般地研究这个问题比较复杂,我们以 理想气体为基础来开展讨论。
热学第三章气体分子速率和能量统计分布律

v0 2v0 3v0 4v0 5v0 v
i
1 9
v0 2
2 9
3v0 2
3 9
5v0 2
2 9
7v0 2
1 9v0 92
5v0 2
2021/4/24
15
例4:讨论下列各式的物理意义
1. f (v)dv
平衡态下,分子速率分布在v → v+dv区间内的分子数 占总分子数的比率。
2. Nf (v)dv
求:1) 速率在 vp ~ v 间的分子数;2)速率在 vp ~
间所有分子动能之和 . 3)速率在 1 ~ 2 区间的分子
平均速率。
解: 速率在 v v dv 间的分子数 dN Nf (v)dv
1)
v v Nf ( )dv
vp
2)
vp
1 2
mv2 Nf
(v)dv
3)
2 Nf ()d
1~2
f (v) 4π(
m
)3
2
mv 2
e 2kT
v2
2πkT
dN 4π(
m
)3
2
mv 2
e 2kT
v2dv
N
2πkT
反映理想气体在热动平衡
波尔兹曼常量
f (v) dN Ndv
f (v)
条件下,气体分子按速率
分布的规律 .
o
v
三 三种统计速率
1)最概然速率 v p
f (v)
f max
df (v) 0 dv vvp
v1
v1
平衡态下,分子速率分布在v1 → v2区间内的分子数。
例 5已知f v为 N 个(N 很大)分子组成的系统的速率分
第三章气体分子热运动速率和能量的统计分布律

麦克斯韦大约于1855年开始研究电磁学,在潜心研究了法拉第 关于电磁学方面的新理论和思想之后,坚信法拉第的新理论包含着 真理。于是他抱着给法拉第的理论“提供数学方法基础”的愿望, 决心把法拉第的天才思想以清晰准确的数学形式表示出来。他在前 人成就的基础上,对整个电磁现象作了系统、全面的研究,
dNNf(v)dv
v
速率位于 v1v2 区间的分子数
N v2 Nf (v)dv v1
速率位于 v1v2 区间的分子数占总数的百分比
S N (v N 1 v2)v v 1 2f(v)dv
二、麦克斯韦速率分布函数
麦氏分布函数
f(v)4π(2πm kT)32em 2kvT 2v2
dN4π( m )32em 2kvT2v2dv N 2πkT
§1. 气体分子的速率分布律
一、速率分布函数
分子速率分布图
N/(Nv分)子速率分布图
N :分子总数
S
o
vvv v
N 为速率在 v vv 区间的分子数.
S NN
表示速率在 v vv区间的分
子数占总数的百分比 .
分布函数 f(v )li m N 1li m N 1d N v 0 N vN v 0 vN d v
麦克斯韦(James Clerk
Maxwell 1831-1879)
凭借他高深的数学造诣和丰富的想象力接连发表了电磁场理论的三篇论文: 《论法拉第的力线》(1855年12 月至1856年2月);《论物理的力线》 (1861至1862年);《电磁场的动力学理论》(1864年12月8日)。对 前人和他自己的工作进行了综合概括,将电磁场理论用简洁、对称、完美 数学形式表示出来,经后人整理和改写,成为经典电动力学主要基础的麦 克斯韦方程组。据此,1865年他预言了电磁波的存在,电磁波只可能是 横波,并计算了电磁波的传播速度等于光速,同时得出结论:光是电磁波 的一种形式,揭示了光现象和电磁现象之间的联系。1888年德国物理学 家赫兹用实验验证了电磁波的存在。麦克斯韦于1873年出版了科学名著 《电磁理论》。系统、全面、完美地阐述了电磁场理论。这一理论成为经 典物理学的重要支柱之一。在热力学与统计物理学方面麦克斯韦也作出了 重要贡献,他是气体动理论的创始人之一。1859年他首次用统计规律— 麦克斯韦速度分布律,从而找到了由微观两求统计平均值的更确切的途径。 1866年他给出了分子按速度的分布函数的新推导方法,这种方法是以分 析正向和反向碰撞为基础的。
第 三 章 气体分子热运动速率和能量的统计分布律

第 三 章 气体分子热运动速率和能量的统计分布律3-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V (3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=ii i N V N V(m/s)3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:s m RTV P /395103230031.8223=⨯⨯⨯==-μs m RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμs m RTV/483103230031.83332=⨯⨯⨯==-μ3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P 2=代入数据则分别为:T=100K 时 s m V P /1028.22⨯= T=1000K 时 s m V P /1021.72⨯= T=10000K 时 s m V P /1028.23⨯=3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RT V =由题意得:μRT3πμ28RT =∴T 2/T 1=83π3-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律:△ N=V V e KTmN V KTm ∆⋅⋅⋅-22232)2(4ππ∵ V p2=2KTm,代入上式 △N=VV V pP peV V V N ∆--⋅⋅222214π因500到501相差很小,故在该速率区间取分子速率V =500m/s ,又s m V P /402102827331.823≅⨯⨯⨯=- △V=1m/s(vv p =1.24)代入计算得:△N=1.86×10-3N 个3-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。
第三章气体分子热运动速率

第三章气体分子热运动速率和能量的统计分布⏹3.1气体分子的速率分布律⏹3.2用分子射线实验验证麦克斯韦速度分布律⏹3.3玻尔兹曼分布律重力场中微粒按高度的分布⏹3.4能量按自由度均分定理3.1气体分子的速率分布律统计规律性:分子运动论从物质微观结构出发,研究大量分子组成的系统的热性质。
其中个别分子的运动(在动力学支配下)是无规则的,存在着极大的偶然性。
但是,总体上却存在着确定的规律性。
(例:理想气体压强)人们把这种支配大量粒子综合性质和集体行为的规律性称为统计规律性。
气体中个别分子的速度具有怎样的数值和方向完全是偶然的,但就大量分子的整体来看,在一定的条件下,气体分子的速度分布也遵从一定的统计规律。
为研究气体分子速度分布的定量规律,有必要介绍分布函数的概念。
例1:统计某城市中每个商店里职工的分布情况,可用下列方法。
分布函数和平均值偶然事件:大量出现不可预测的事件。
多次重复观察同样的事件,可获得该偶然事件的分布,从而得到其统计规律。
表示该城市中的商店总数表示该城市中有个职工的商店数,称分布数。
i N i ∑=i N N 名职工的商店的百分数表示有i N N f i i 归一化的分布数,,=条件归一化,1)(==∑∑N N f i i例:我们以人的身高为例,来引入分布函数的概念。
设N 为总人数,d N (h )为身高在h--h+d h 间的人数。
显然⎰=Nh N )(d 令f (h )=d N (h )/N d h ,则⎰=1d )(h h f 我们把f (h )称为归一化分布函数。
f (h )表征在单位高度内,身高为h 的人数占总人数的比率。
f(h)dh :高度在h 与h+dh 之间的概率N 个人的平均身高为hf(h)h h+dhof(h)为归一化分布函数分布曲线高度在h与h+dh之间的人数:dhhNfhdN)()(=⎰=⎰=⎰=hhhfhNhhhNfNhNhd)(d)()(d推广至任一变量(物理量)x ,由分布函数f(x)求平均值,有:⎰⎰⎰===xxxfNxxNxfNNxx d)(d)(d对具有统计性的系统来讲,总存在着确定的分布函数f(x),因此,写出分布函数f(x)是研究一个系统的关键之处,具有普遍的意义。
热学-统计物理3 第3章 气体分子热运动速率和能量的统计分布律
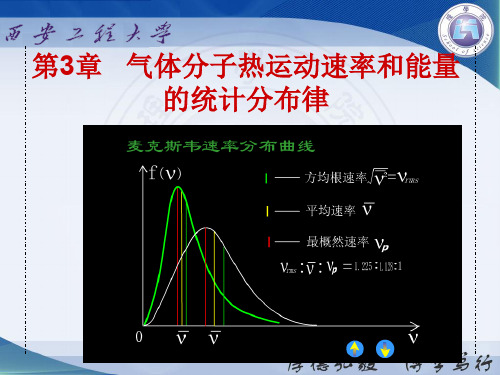
v v pv v 2
讨论
麦克斯韦速率分布中最概然速率 vp 的概念
下面哪种表述正确?
(A) vp 是气体分子中大部分分子所具有的速率. (B) vp 是速率最大的速度值. (C) vp 是麦克斯韦速率分布函数的最大值.
(D) 速率大小与最概然速率相近的气体分子的比 率最大.
例1 计算在 27 C 时,氢气和氧气分子的方均
M
3.方均根速率 v2
v2
N
0
v2dN N
0
v2Nf N
(v)dv
o
v
v2 v2 f (v)dv 4 ( m )3 2 e mv2 2kT v4dv
0
2 kT
0
v4ev2 dv 3
0
8 5
v2 3kT m
v2 3kT 3RT
2kT
v
麦克斯韦速率分布函数的物理意义: f (v) dNv
Nd v
既反映理想气体在热动平衡条件下,分布在速率 v 附近单
位速率区间内的分子数占总分子数的百分比,又表示任意
一分子的速率出现在 v附近单位速率区间内的概率。
如果以速率为横坐标轴,速率分布函数为纵坐标轴,画 出的一条表示f(v) —v之间关系的曲线,称为气体分子的麦 克斯韦速率分布曲线。 ,它形象地描绘出气体分子按速率 分布的情况。
大量分子的速率的算术平均值叫做分子的平均速率.
v
vNf (v)dv
0
vf (v)dv
v 4 (
m
)3 e2 mv2 2kT v2dv
N
0
0
工学气体分子热运动速率和能量的统计分布律

第三章 气体分子热运动速率和能量的统计分布律
(2)概率相乘法则:
同时或依次发生的,互不相关(或相互统计独立) 的事件发生的概率等于各个事件概率之乘积,简称概 率相乘法则。
• 把一个骰子连续掷两次,掷第二次出现的概率与第一 次掷过否,第一次出现的哪一面向上都无关,则连续两 次掷骰子是统计独立的。
2. 等概率性
等概率性——在没有理由说明哪一事件出现概率更 大些(或更小些)情况下,每一事件出现的概率都 应相等。
3. 概率的基本性质 (1)概率相加法则:
n 个互相排斥事件发生的总概率是每个事件
发生概率之和,简称概率相加法则。
• 所谓n个互相排斥(简称互斥)的事件是指,出现事 件1,就不可能同时出现事件2,3…n,同样对2,3…n
N : N
表示速率在 v v v 区间的分
子数占总数的百分比 .
N : N V
表示单位速率区间的分子数占总数的 百分比 .
分布函数 f (v) lim N 1 lim N 1 dN v0 Nv N v0 v N dv
dN f (v)dv N
第三章 气体分子热运动速率和能量的统计分布律
第三章 气体分子热运动速率和能量的统计分布律
3-0 概率论的基本知识
第三章 气体分子热运动速率和能量的统计分布律
一 实验
小球在伽尔顿 板中的分布规律 .
每个小球落入哪个槽是 偶然的 少量小球按狭槽分布有 明显偶然性 大量小球按狭槽分布呈 现规律性
............ ........... ............ ........... ............ ........... ............
它仅是分子质量及气体温度的函数,
热学[李椿 章立源 钱尚武]习题解答_第三章气体分子热运动速率与能量的统计分布律
![热学[李椿 章立源 钱尚武]习题解答_第三章气体分子热运动速率与能量的统计分布律](https://img.taocdn.com/s3/m/581192a543323968001c927e.png)
第 三 章 气体分子热运动速率和能量的统计分布律3-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V (3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=ii i N V N V(m/s)3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:s m RTV P /395103230031.8223=⨯⨯⨯==-μs m RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμs m RTV/483103230031.83332=⨯⨯⨯==-μ3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P 2=代入数据则分别为:T=100K 时 s m V P /1028.22⨯= T=1000K 时 s m V P /1021.72⨯= T=10000K 时 s m V P /1028.23⨯=3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RT V =由题意得:μRT3πμ28RT =∴T 2/T 1=83π3-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律:△ N=V V e KTm N V KTm∆⋅⋅⋅-22232)2(4ππ ∵ V p2= 2KTm ,代入上式 △N=VV V ppe V V VN∆--⋅⋅222214ρπ因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又s m V P /402102827331.823≅⨯⨯⨯=- △V=1m/s (vv p=)代入计算得:△N=×10-3N 个3-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 三 章3-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V (3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=ii i N V N V(m/s)3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:s m RTV P /395103230031.8223=⨯⨯⨯==-μs m RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμs m RTV/483103230031.83332=⨯⨯⨯==-μ3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P 2=代入数据则分别为:T=100K 时 s m V P /1028.22⨯= T=1000K 时 s m V P /1021.72⨯= T=10000K 时 s m V P /1028.23⨯=3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RT V =由题意得:μRT3πμ28RT =∴T 2/T 1=83π3-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律:△ N=V V e KTm N V KTm∆⋅⋅⋅-22232)2(4ππ∵ V p2=2KTm,代入上式 △N=VV V ppe V V VN∆--⋅⋅222214ρπ因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又s m V P /402102827331.823≅⨯⨯⨯=-△V=1m/s(vv p=1.24)代入计算得:△N=1.86×10-3N 个 3-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。
解: 取分子速率为V 1=3000m/s V 2=1500m/s, △V 1=△V 2=10m/s 由5题计算过程可得: △V 1=1212214V V V p ppe V V VN∆--⋅⋅π△N 2=2222214V V V pppe V V VN∆--⋅⋅π∴△N/△N 2=2121)(21)(21)()(ppp V V V V p e V V e V V --⋅其中V P =331018.210257331.82⨯=⨯⨯⨯-m/s v 1v p =1.375,v 2v p=0.687 ∴969.0687.0375.122687.02375.1221≅⨯⨯=∆∆--ee N N 解法2:若考虑△V 1=△V 2=10m/s 比较大,可不用近似法,用积分法求△N 1,△N 2dN=dVV V V p PeV N22234--⋅π△N 1=⎰⎰⎰-=1221V V V V dN dN dN△N 2=⎰⎰⎰-=3443V V V V dN dN dN令X i =v iv pi=1、2、3、4利用16题结果:22)([0i ix i i V e x x erf N dN --=⎰π∴△N 1=]2)([]2)([2122112x x i ex x erf N ex x erf N -----ππ(1)△N 2=]2)([]2)([23243344x x e x x erf N e x x erf N -----ππ(2)其中V P =s m RT/10182.223⨯=μ375.111==P V V x 379.122==PV Vx687.033==P V V x 6722.044==PV Vx 查误差函数表得:erf(x 1)=0.9482 erf(x 2)=0.9489 erf(x 3)=0.6687 erf(x 4)=0.6722将数字代入(1)、(2)计算,再求得:703.021=∆∆N N 3-7 试就下列几种情况,求气体分子数占总分子数的比率: (1) 速率在区间v p ~1.0v p 1内 (2) 速度分量v x 在区间v p ~1.0v p 1内(3) 速度分量v p 、v p 、v p 同时在区间v p ~1.0v p 1内解:设气体分子总数为N ,在三种情况下的分子数分别为△N 1、△N 2、△N 3 (1) 由麦氏速率分布律: △ N=⎰⎰⎰-=1221V V V V dN dN dN令v 2=1.01v p ,v i =v p ,p i i v v x =,则111==p v v x ,01.122==pv vx ,利用16题结果可得;2122112212)(2)(x x e x x erf e x x erf N N --+--=∆ππ 查误差函数表:erf (x 1)=0.8427 erf (x 2)=0.8468 ∴008.01=∆NN (2) 由麦氏速率分布律:x v v p x dv ev NdN px21--=π∴x v v v px v v v pdv evNdv evNN px px 2122)(1)(012----⎰⎰-=∆ππ)(])(exp[1)(])(exp[12020212px p x v v p x p x v v v v d v v v v d v v N N p p ⎰⎰---=∆ππ令p x v v x =, 111==p v v x ,01.122==pv vx ∴dx edx eN N x x x x ⋅-=∆--⎰⎰2122211ππ利用误差函数:dx x xp e x erf x)(2)(20-=⎰π%21.0]8427.08468.0[21)()([21122=-=-=∆x erf x erf N N (3)令pxv v x =,由麦氏速度分布律得: z y x v v v v p dv dv dv e v N dN pzy x ⋅=++--222331ππ833230033108.0)002.0()(][)1(211222---⨯==∆=-=∆⎰⎰NN dx e dx e N N x x x x π3-8根据麦克斯韦速率分布函数,计算足够多的点,以dN/dv 为纵坐标,v 为横坐标,作1摩尔氧气在100K 和400K 时的分子速率分布曲线。
解:由麦氏速率分布律得:22232)2(4v e KTm N dv dN v KTm-=ππ 将π=3.14,N=N A =6.02×1023T=100K m=32×10-3代入上式得到常数:A=e KT mN A 23)2(4ππKT m B 2=∴22V Ae dvdN BV ⋅=- (1) 为了避免麻烦和突出分析问题方法,我们只做如下讨论:由麦氏速率分布律我们知道,单位速率区间分布的分子数随速率的变化,必然在最可几速率处取极大值,极大值为: 令22V Ae dvdNy BV ⋅==-则 0)]2(2[222=-⋅+⋅=--BV e V V e A dvdyBV BV 得BV V P 1== 又在V=0时,y=0,V →∞时,y →0 又mKT B V P 11121==mKT B V P 22221== ∵T 1=100K <T 2=400K ∴1P V <2P V 由此作出草图3-9根据麦克斯韦速率分布律,求速率倒数的平均值v1。
解:VKT m e mKTKT m V KTmd Ve m KT KT m VdVe KTm dv V f Vv KTmV KT mKTmv ππππππππ42)()2(4)2()()2(4)2(4)(1102232202230223022==⋅-⋅=-⋅⋅-===∞-∞-∞-∞⎰⎰⎰3-10一容器的器壁上开有一直径为0.20mm 的小圆孔,容器贮有100℃的水银,容器外被抽成真空,已知水银在此温度下的蒸汽压为0.28mmHg 。
(1) 求容器内水银蒸汽分子的平均速率。
(2) 每小时有多少克水银从小孔逸出?解:(1))/(1098.11020114.337331.88823s m RTV ⨯=⨯⨯⨯⨯==-πμ(2)逸出分子数就是与小孔处应相碰的分子数,所以每小时从小孔逸出的分子数为:t s V n N ⋅⋅=41其中KTVP V n ⋅=4141是每秒和器壁单位面积碰撞的分子数,2)2(d s π=是小孔面积,t=3600s ,故t s V KTPN ⋅⋅⋅=41,代入数据得: N=4.05×1019(个) ∴)(1035.11005.41002.610201219233g N N m N M A--⨯=⨯⨯⨯⨯===μ3-11如图3-11,一容器被一隔板分成两部分,其中气体的压强,分子数密度分别为p 1、n 1、p 2、n 2。
两部分气体的温度相同,都等于T 。
摩尔质量也相同,均为μ。
试证明:如隔板上有一面积为A 的小孔,则每秒通过小孔的气体质量为:)(221P P A RTM -=πμ证明:设p 1>p 2,通过小孔的分子数相当于和面积为A 的器壁碰撞的分子数。
从1跑到2的分子数:t A V n N ⋅⋅=11141从2跑到1的分子数:t A n N ⋅⋅=22241实际通过小孔的分子数:(从1转移到2))221121(41V n V n At N N N -=-=∆因t=1秒,KTPn =,πμRTV 8=T 1=T 2=T∴)(2)(841)(841212121P P A RTP P RTRTA KT P KT PRT Am n m M -=-=-==∆=πμπμμπμ若P 2>P 1,则M <0,表示分子实际是从2向1转移。
3-12 有N 个粒子,其速率分布函数为)0()(0〉〉==v v C NdvdNv f)(0)(0v v v f 〈=(1)作速率分布曲线。
(2)由N 和v 0求常数C 。
(3)求粒子的平均速率。
解:(1) )0()(0〉〉=v v C v f)(0)(0v v v f 〈=得速率分布曲线如图示(2)∵1)(0=⎰∞dv v f∴10)(0==⎰⎰∞v cdv dv v f即10=cv 01v c =(3)02002121)(v cv dv v vf v ===⎰∞3-13 N 个假想的气体分子,其速率分布如图3-13所示(当v >v 0时,粒子数为零)。
(1)由N 和V 0求a 。
