详细键长表
碳,氮两元素比较

三比较攻克碳族元素之一(碳与硅的比较)在碳族元素的学习中,有三个重要的知识点需要同学们额外的重视。
展开来就是碳与硅的性质(比较)、一氧化碳与二氧化碳的性质(比较)以及(二氧化碳与)二氧化硅的性质(比较)。
碳元素及其重要化合物的性质相信大家都比较熟悉,在学习硅的过程中我们就是要利用同族元素性质的相似性,在对碳熟悉的层次上运用比较、辨析的方法快速掌握硅元素的性质。
我们将用三个专题来系统地介绍碳族元素的学习,在陆续的三个专题中同学们可以体会到比较法应用到学习中的优厚之处。
大思路通过碳来学习硅,这是整体思路。
总的说来,像碳一样硅原子最外层有四个电子,但是由于硅原子比碳原子多一个电子层,半径比较大。
硅元素的非金属性比碳元素弱。
常温下,硅的化学性质比较稳定,但能与氟气、氢氟酸反应。
在一定条件下能够与氢氧化钠、氯气、氧气反应。
硅的工业制法:用焦炭在高温下还原SiO2可制得含有少量杂质的粗硅:SiO2 + 2C Si + 2CO↑有趣的是,尽管单质硅的性质比较稳定,但是自然界中的硅元素并不以游离态的硅存在,只以化合态存在。
因此,科学家认为在地球形成时代温度很高,硅与其他元素形成化合物,这些化合物又十分稳定。
所以硅在自然界中以化合态存在。
下面的表格我们了运用比较的方法,把碳和硅从原子半径、成键特征、化学性质、用途等方面进行了详细比较,这样有利于同学们把前后知识联系起来。
希望同学们能仔细阅读思考一下。
体验1下列关于碳族元素的说法正确的是 [ ]A.单质都是无色晶体B.单质中硅单质熔点最高C.碳族元素形成的化合物种类最多D.在化合物中最稳定的化合价都是+4价体验思路:对选项A:在碳族元素所形成的单质中,只有金刚石为无色晶体,故A是错的。
对选项B:在碳族元素形成的单质中,金刚石、晶体硅为原子晶体,金刚石的熔点比晶体硅高。
本族单质的熔点与卤族元素单质熔点递变趋势不同,卤族单质熔点从F2→I2依次升高,碳族元素单质由C→Pb熔点呈降低趋势,故B项是错误的。
元素周期表 键能 键长 半径

1 H 氢Hydrogen2 He 氦Helium3 Li 锂Lithium4 Be 铍Beryllium5 B 硼Boron6 C 碳Carbon7 N 氮Nitrogen8 O 氧Oxygen9 F 氟Fluorine10 Ne 氖Neon11 Na 钠Sodium12 Mg 镁Magnesium13 Al 铝Aluminum14 Si 硅Silicon15 P 磷Phosphorus16 S 硫Sulphur17 Cl 氯Chlorine18 Ar 氩Argon19 K 钾Potassium20 Ca 钙Calcium21 Sc 钪Scandium22 Ti 钛Titanium23 V 钒Vanadium24 Cr 铬Chromium25 Mn 锰Manganese26 Fe 铁Iron27 Co 钴Cobalt28 Ni 镍Nickel29 Cu 铜Copper30 Zn 锌Zinc31 Ga 镓Gallium32 Ge 锗Germanium33 As 砷Arsenic34 Se 硒Selenium35 Br 溴Bromine36 Kr 氪Krypton37 Rb 铷Rubidium38 Sr 锶Strontium39 Y 钇Yttrium40 Zr 锆Zirconium41 Nb 铌Niobium42 Mo 钼Molybdenum43 Tc 锝Technetium44 Ru 钌Ruthenium45 Rh 铑Rhodium46 Pd 钯Palladium47 Ag 银Silver48 Cd 镉Cadmium49 In 铟Indium50 Sn 锡Tin51 Sb 锑Antimony52 Te 碲Tellurium53 I 碘Iodine54 Xe 氙Xenon55 Cs 铯Caesium56 Ba 钡Barium57 La 镧Lanthanum58 Ce 铈Cerium59 Pr 镨Praseodymium60 Nd 钕Neodymium61 Pm 钷Promethium62 Sm 钐Samarium63 Eu 铕Europium64 Gd 钆Gadolinium65 Tb 铽Terbium66 Dy 镝Dysprosium67 Ho 钬Holmium68 Er 铒Erbium69 Tm 铥Thulium70 Yb 镱Ytterbium71 Lu 镥Lutetium72 Hf 铪Hafnium73 Ta 钽Tantalum74 W 钨Tungsten75 Re 铼Rhenium76 Os 锇Osmium77 Ir 铱Iridium78 Pt 铂Platinum79 Au 金Gold80 Hg 汞Mercury81 Tl 铊Thallium82 Pb 铅Lead83 Bi 铋Bismuth84 Po 钋Polonium85 At 砹Astatine86 Rn 氡Radon87 Fr 钫Francium88 Ra 镭Radium89 Ac 锕Actinium90 Th 钍Thorium91 Pa 镤Protactinium92 U 铀Uranium93 Np 镎Neptunium94 Pu 钸Plutonium95 Am 镅Americium96 锔Cm Curium97 锫Bk Berkelium98 锎Cf Californium99 锿Es Einsteinium100 Fm Fermium101 钔Md Mendelevium102 锘No Nobelium103 铹Lw Lawrencium104鐪Rf unnilquadium105 Db dubnium106 Sg Seaborgium107 Bh Bohrium108 Hs Hassium109 Mt Meitnerium110 鐽Ds Darmstadtium111 Rg Roentgenium稀土元素:周期表中IIIB族钪、钇和镧系元素之总称,因其天然丰度小,又以氧化物或含氧酸盐矿物共生形式存在,故得名。
分子间作用力与超分子化学(强烈推荐)

4.2 分子间作用力与超分子化学4.2.1 分子间作用力1. 分子间作用力(van de Walls Interaction)在物质的凝聚态中,除了分子内相邻原子间存在的强烈的化学键外,分子和分子之间还存在着一种较弱的吸引力——分子间作用力。
早在1972年,范德华(van de Walls)就已注意到这种力的存在,并考虑这种力的影响和分子本身占有体积的事实,提出了著名的范德华状态方程式。
所以分子间作用力也称为范德华引力。
范德华引力是决定物质的熔点、沸点、气化热、熔化热、溶解热、表面张力、粘度等物理化学性质的主要因素。
分子间主要作用包括:荷电基团、偶极子、诱导偶极子之间的相互作用,氢键、疏水基团相互作用、π…π堆叠作用以及非键电子推斥作用等。
大多数分子的分子间作用能在10kJ·mol-1以下,比一般的共价键键能小1~2个数量级,作用范围在300~500pm。
荷电基团间的静电作用的本质与离子键相当,又称盐键,例如—COO-…+H3N —,其作用能正比于互相作用的基团间荷电的数量,与基团电荷重心间的距离成反比。
偶极子、诱导偶极子和高级电极矩(如四极矩)间的相互作用,通称范德华作用。
氢键作用是分子间最重要的强相互作用,下面将详细介绍。
疏水基团相互作用是指极性基团间的静电作用和氢键使极性基团倾向于聚集在一起,因而排挤疏水基团,使疏水基团相互聚集所产生的能量效应和熵效应。
在蛋白质分子中,疏水侧链基团如苯丙氨酸、亮氨酸、异亮氨酸等较大的疏水基团,受水溶液中溶剂水分子的排挤,使溶液中蛋白质分子的构象趋向于把极性基团分布在分子表面,和溶剂分子形成氢键和盐键,而非极性基团聚集成疏水区,藏在分子的内部,这种效应即为疏水基团相互作用。
据测定使两个>CH2基团聚集在一起形成>CH2…H2C<的稳定能约达3kJ·mol-1。
π…π堆叠作用是两个或多个平面型的芳香环平行地堆叠在一起产生的能量效应。
氢硫键键长-概述说明以及解释

氢硫键键长-概述说明以及解释1.引言1.1 概述氢硫键是一种重要的化学键,在化学和生物学中具有广泛的应用和研究价值。
它由硫原子和氢原子之间的弱相互作用力组成,常见于许多有机和无机化合物中。
氢硫键具有其独特的特点和性质,对于化学反应、分子结构和生物活性等方面都有重要影响。
在氢硫键形成过程中,硫原子中的一个空轨道与氢原子中的一个非共价电子对相互作用,形成弱的相互吸引力。
这种相互作用力虽然较弱,但却具有一定的方向性和特异性。
氢硫键的键能通常较低,能量在0.5-5 kcal/mol范围内变化。
氢硫键的键长是指硫原子与氢原子之间的距离。
一般来说,氢硫键的键长较短,介于0.15-0.18 nm之间。
然而,并非所有的氢硫键键长都相同,其具体数值受多种因素的影响,包括化合物的结构、环境条件以及相互作用力的强弱等。
在分子结构中,其他官能团的存在会对氢硫键的键长产生影响。
此外,溶剂极性、温度和压力等环境因素也会对氢硫键键长产生一定的影响。
对氢硫键键长进行深入研究,可以帮助我们更好地理解分子的结构和性质,从而为新材料的设计和合成提供有益的指导。
此外,进一步研究氢硫键键长的变化规律,也有助于我们深入了解分子之间的相互作用,为合理设计具有特定功能和活性的分子提供理论依据。
综上所述,本文将对氢硫键键长进行详细的探讨和总结,并展望氢硫键键长研究的未来发展方向。
通过深入了解氢硫键键长的特点和影响因素,我们可以更好地应用和改进氢硫键在化学和生物领域的各种应用。
文章结构部分主要介绍了本篇文章的组织结构和各个部分的内容。
通过明确文章的整体框架,读者可以清楚地了解到本文的思路和篇章结构,有助于读者更好地理解和阅读全文。
在本文中,共分为三个主要部分:引言、正文和结论。
引言部分主要包括以下三个方面的内容:1.1 概述:简要介绍了本文要探讨的主题——氢硫键键长。
说明了氢硫键是一种重要的化学键,并且具有一定的特点和影响因素。
1.2 文章结构:本部分会对整篇文章的组织结构进行详细阐述。
化学知识结构框图(超详细)
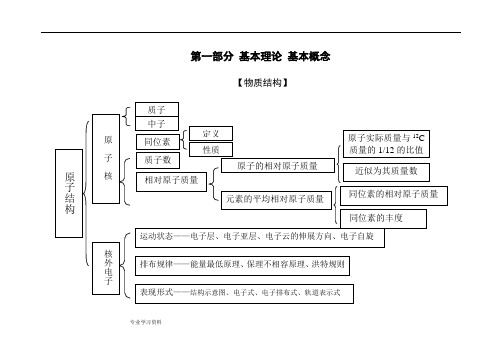
. 专业学习资料 .第一部分 基本理论 基本概念【物质结构】. 专业学习资料.晶体结构. 专业学习资料.晶体熔沸点比较表. 专业学习资料.【元素周期律】. 专业学习资料.【化学反应速率与化学平衡】. 专业学习资料.. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【胶体】【电解质溶液】.. 专业学习资料.. 专业学习资料.【氧化还原反应电化学】. 专业学习资料.【各种化学反应的关系】. 专业学习资料..专业学习资料.【化学反应规律】. 专业学习资料.. 专业学习资料.. 专业学习资料 .【物质的量】nVV n m =→nm M =Vn C =nN N A =M=a 1%·M 1+ a 2%·M 2+…(a%为体积分数). 专业学习资料..第二部分 元素及其化合物【元素化合物概述】【非金属元素】. 专业学习资料.【卤族元素】. 专业学习资料.PbS. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【金属元素】.. . .. . ..【铝及其化合物】. 专业学习资料.. 专业学习资料.. 专业学习资料.【化工生产】. 专业学习资料.第三部分 有机物【有机物导学】[有机物推断]浓H2SO4加热苯的硝化醇分子内、间脱水酯化光照——烷基卤代[官能团特征反应]聚酯反应类型与官能团的关系官能团(或物质)的特征反应[各类有机物之间的相互关系]2 =CH 2CH 3 —CH 3 CH CH CH 2 O HCH 3 CH 3 C H 2 C lCH 2 CH 2 Cl CH C HO CHClCH 2-CH NH 2n2HOCH 2 CH 2OHCH 3 C OOHCH 3 C OO CH 2 CH 3第四部分 化学实验导学[物质的分离和提纯][物质的检验][常见气体的实验室制法]第五部分 化学计算。
n-h键的键能

n-h键的键能1.引言1.1 概述在化学领域,n-h键是指氮原子和氢原子之间的共价键。
n-h键的形成对于许多化学反应和物质性质具有重要影响。
氮原子是一个非金属元素,具有五个价电子。
氢原子只有一个价电子。
当氮原子与氢原子之间形成一个共享电子对时,就形成了n-h键。
n-h键通常是较弱的键,可以被较容易地打破或形成。
然而,尽管其较弱的键能,n-h键在化学反应中扮演着至关重要的角色。
n-h键在化学反应中具有许多重要性质。
首先,由于n-h键的存在,使得氮原子和氢原子之间发生相互作用,从而影响了分子的几何构型和电子密度分布。
其次,n-h键的形成和断裂可以导致化学反应的速率和平衡位置的改变。
此外,n-h键的存在还可以影响化合物的酸碱性质和氢键的形成。
本文将深入探讨n-h键的定义、性质以及其在化学反应中的重要性。
我们将讨论n-h键的形成和特点,以及它们在不同化学反应中的作用。
此外,我们还将展望对n-h键的研究和应用,并探讨可能的未来发展方向。
通过对n-h键的深入理解,我们可以更好地理解和解释化学反应的机理和性质。
对n-h键的研究也有助于发展新的合成方法和催化剂,为化学领域的进一步发展提供更多可能性。
1.2 文章结构文章结构:本篇文章主要分为引言、正文和结论三个部分。
引言部分主要包括概述、文章结构和目的三个方面。
概述部分将简要介绍n-h键的相关背景和意义,引起读者的兴趣。
文章结构部分将阐述文章的整体结构,包括各个章节的内容安排和逻辑关系。
目的部分说明本文旨在介绍n-h键的定义、性质、形成方式以及化学反应中的重要性,并展望未来对于n-h键研究和应用的前景。
正文部分将分为2.1节和2.2节。
2.1节将详细介绍n-h键的定义和性质,包括其化学键的特点、键长、键能等相关知识。
2.2节将深入探讨n-h键的形成方式和特点,包括化合物中n-h键的构成以及影响n-h键形成的因素等。
结论部分将分为3.1节和3.2节。
3.1节将总结n-h键在化学反应中的重要性,指出n-h键在有机合成、催化反应等领域的应用价值。
化学式 表达式r的含义

化学式表达式r的含义
化学式和表达式是化学领域中的基础概念,对于化学学习者来说,理解这些概念的含义至关重要。
本文将详细解释表达式r在化学式中的含义,帮助读者更好地掌握化学知识。
一、化学式的基本概念
化学式是化学物质的结构简写,它用化学符号和数字表示化合物中各种原子的种类和数量。
化学式有助于我们了解物质的组成和性质。
二、表达式r的含义
表达式r在化学式中通常表示原子间的距离,即原子之间的平均间隔。
这个距离可以用不同的单位表示,如埃()或者纳米(nm)。
在化学研究中,原子间的距离对于了解分子结构、预测化学反应性质等方面具有重要意义。
1.原子半径
表达式r可以表示原子的半径。
原子半径是指原子中心到最外层电子的平均距离。
不同元素的原子半径有所不同,一般来说,原子半径随着元素周期表中原子序数的增加而增加。
2.键长
表达式r还可以表示化学键的长度,即两个成键原子之间的距离。
键长是分子结构的重要参数,它影响着分子的稳定性和反应性质。
不同类型的化学键(如单键、双键、三键)具有不同的键长。
3.分子间距离
在分子间相互作用中,表达式r还可以表示分子之间的平均距离。
分子间
距离对于物质的相变、溶解性等性质具有重要影响。
三、总结
表达式r在化学式中具有丰富的含义,它可以表示原子半径、键长和分子间距离等。
了解这些含义有助于我们深入理解化学物质的性质和反应机制。
希望本文的阐述能够帮助读者更好地掌握化学知识。
注意:本文仅针对表达式r在化学式中的含义进行解释,不包括其他领域中的含义。
四氨合铜的氮氢键键角

四氨合铜的氮氢键键角1.引言1.1 概述概述部分的内容可以按照以下方式编写:在化学领域,氮氢键是一种重要的化学键,它的存在与否直接影响了化合物的结构和性质。
氮氢键通常由氮原子上的孤对电子与氢原子上的正电荷形成。
氮氢键的形成是通过轨道重叠来实现的,其中氮原子的孤对电子与氢原子的1s轨道重叠形成σ键。
氮氢键的键能较弱,通常在10-30 kcal/mol范围内,因此它经常参与到分子中的反应和分子间相互作用中。
本文将重点研究四氨合铜中氮氢键的键角对其结构和性质的影响。
四氨合铜是一种重要的化合物,它由四个氨分子和一个铜离子组成。
氮氢键在四氨合铜中起到了至关重要的作用,它们不仅决定了分子的空间构型,还能影响化合物的电子结构和化学性质。
因此,研究氮氢键键角对四氨合铜的影响具有重要的理论和实际意义。
通过深入研究氮氢键键角,我们可以更好地理解四氨合铜的结构和性质。
进一步地,这项研究有望为设计和合成新型氮氢键化合物提供指导,并为开发新型催化剂和功能材料提供有力支持。
因此,本研究的目的是通过实验和理论模拟相结合的研究方法,揭示氮氢键键角对四氨合铜的影响机制,并探讨可能的应用和进一步的研究方向。
通过对氮氢键键角的研究,我们将进一步拓展对氮氢键的理解,为相关领域的研究提供新的思路和方法。
同时,本研究也有望探索其他金属配合物中氮氢键角的影响,并为实现更多具有特殊结构和性能的化合物提供重要参考。
在接下来的章节中,我们将详细介绍氮氢键的定义和特点以及四氨合铜的结构和性质,以期深入揭示氮氢键键角在四氨合铜中的重要作用。
1.2文章结构文章结构是撰写一篇长文时需要遵循的逻辑组织方式,它可以帮助读者理解文章的主题和内容。
本文的文章结构如下:1. 引言1.1 概述1.2 文章结构1.3 目的2. 正文2.1 氮氢键的定义和特点2.2 四氨合铜的结构和性质3. 结论3.1 氮氢键角对四氨合铜的影响3.2 可能的应用和进一步研究方向在本篇长文中,我们将首先在引言部分进行概述,介绍氮氢键和四氨合铜的重要性和相关研究现状。
