物理化学课件04多组分系统热力学资料
04 多组分系统热力学

什么是稀溶液的凝固点?
固态纯溶剂从稀溶液中开始析出的温度。
设纯溶剂的凝固点为
Tf*
溶液中溶剂的凝固点为 Tf
稀溶液中,由于非挥发性溶质的加入,溶
剂的蒸气压下降,所以凝固点也下降。
Tf Tf* Tf > 0 称为凝固点降低值
纯溶剂和稀溶液中溶剂的蒸气压如下图所示
pA
C
O*
D
O
B
Tf Tf*
T
溶剂凝固点下降示意图
4. 该定律适用于溶质是不挥发的非电解质。
5. 当A和B两种液体形成理想的液态混合物时, 都可以使用Raoult定律,即
pA pA* xA
pB pB* xB
二、 Henry定律
Henry定律(Henry’s Law)
1803年,英国化学家Henry根据实验总结出另 一条经验定律:
“在一定温度和平衡状态下,气体在液态溶剂 中的溶解度(用摩尔分数 x 表示)与该气体的平衡 分压 p 成正比”。
Raoult定律(Raoult’s Law) 1887年,法国化学家Raoult从实验中归纳出一
个经验定律: “定温下,在稀溶液中,溶剂的蒸气压等于纯溶
剂蒸气压 pA* 乘以溶液中溶剂的摩尔分数 xA ”
用公式表示为:
pA pA* xA
一、 Raoult定律
pA pA* xA
如果溶液中只有A,B两个组分, xA xB 1
态物质称为溶剂,气态或固态物质称为溶质。
如果都具有相同状态,则把含量多的一种称为 溶剂,含量少的称为溶质。
溶剂和溶质要用不同方法处理,他们的标准态、 化学势的表示式不同,服从不同的经验定律。
如果在溶液中含溶质很少,这种溶液称为稀溶 液,常用符号“∞”表示。
《物理化学》第四章多组分系统热力学复习资料

《物理化学》第四章多组分系统热力学复习资料1 偏摩尔量 的定义式及特点(课本154页)2 吉布斯-杜亥姆方程(课本156页)3 偏摩尔量之间的关系广延热力学间原有的关系,在他们取了偏摩尔量后依然存在例如:B B B pV U H pV U H +=→+=B B B TS U A TS U A -=→-=B B B TS H G TS H G -=→-=B nB T B T V p G V p G =∂∂⇒=∂∂,)()( B nB p B p S TG S T G -=∂∂⇒-=∂∂,)()( 4 化学势 定义式(课本157页式4.2.1)5 单项多组分系统的热力学公式(课本158页式4.4.2b---4.2.6)6 化学势判据在0',,=W p T δ一定的条件下,∑∑≤αββαμ0)()(B B dn7 气体组分在温度T 压力p 时的化学势(1)纯理想气体 )l n ()()(*θθμμppRT g pg += (2)理想气体混合物中任一组分B )ln()()(θθμμpp RT g pg B B B += (3)纯真实气体 ⎰-++=p m dp p RT g V p p RT g g 0*])([)ln()()(*θμμ 低压下的真实气体可视为理想气体,故积分项为0(4)真实气体混合物中任一组分B⎰-++=p B B B B dp pRT g V p p RT g g 0])([)ln()()(θμμ 式中)(g V B 为真是气体混合物中组分B 在温度T 压力p 下的偏摩尔体积低压下的真实气体混合物可视为理想气体,故积分项为08 稀溶液中的经验定律(1)拉乌尔定律(课本169页式4.5.1)(2)亨利定律(课本169页式4.5.2)9 理想液态混合物定义:任一组分在全部浓度范围内均符合拉乌尔定律和亨利定律的液态混合物。
数学形式:xB p p B B ⋅=*10 理想液态混合物中任一组分B 的化学势B B B x RT l l ln )()(*+=μμ(课本174页式4.6.3)常用公式:B B B x RT l l ln )()(+=θμμ(课本174页式4.6.6)11 理想液态混合物的混合性质(课本175页表4.6.1)12 理想稀溶液(1)溶剂A 的化学势课本176页 式4.7.1注意其他的表达形式(2)溶质B 的化学势(课本177页式4.7.7)常用公式 )b ln()()(θθμμbRT B B B +=溶质溶质 13 分配定律(课本179页式4.7.10---4.7.11)14 稀溶液的依数性(1)溶剂蒸汽压下降 xB p p p p A A A A **=-=∆(2)凝固点降低 (课本186页式4.9.5---4.9.6)(3)沸点升高(课本188页式4.9.8---4.9.9)(4)渗透压 TR n V B =∏15 逸度与逸度因子(课本164-165页 式 4.4.1—4.4.2)16 逸度因子的计算与普遍化因子图(课本167页图4.4.3)17 路易斯-兰德尔逸度规则(课本168页图4.4.6)18 真实溶液系统的活度、活度因子与化学势(课本181页 式 4.8.7—4.8.8)19 已知二组分溶液中溶剂A 的摩尔质量为M A ,溶质B 的质量摩尔浓度为b B ,则B 的摩尔分数为()20 在温度T 的理想稀溶液中,若已知溶质B 的质量摩尔浓度为b B ,则B 的化学势为()ln(,θθμb b RT B B b +),若溶质B 的浓度用物质的量浓度c B 表示时,则B 的化学势为()ln(,θθμcc RT B B c +),溶剂A 的化学势可表示为(A A x RT l ln )(+θμ)。
04多组分体系热力学

(3)更普遍的
热力学方程
dG SdT Vdp BdnB
B
3.化学势判据及应用举例
恒温恒压下
dG dG dG
dn
dn B B
B B B B B
B dnB
<0 自发过程
恒温恒压下W′=0的条件下: dG
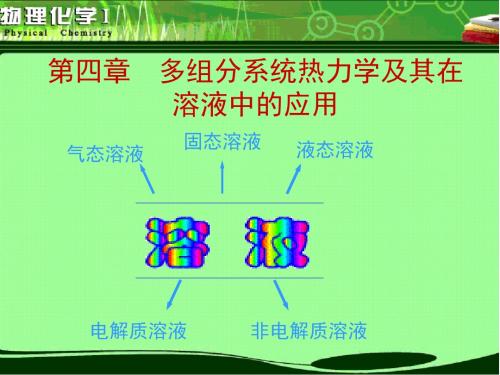
气态溶液(g+l) 液态溶液(l+l) 固态溶液(s+l)
组成的表示方法
(1)物质B的摩尔分数 xB ( mole fraction) (2)质量摩尔浓度bB(molality)
xB
def
n
def
nB
i
bB
nB mA
(3)物质的摩尔浓度cB(molarity)
cB
def
nB V
(4)质量分数wB(mass fraction)
dG SdT Vdp BdnB
B
B
B
适用于组成可变的多组分单相系统 (封闭、敞开均可)
广义的化学势
U H B ( )S ,V ,nC (CB) ( )S , p,nC (CB) nB nB A G ( )T ,V ,nC (CB) ( )T , p ,nC (CB) nB nB
物理化学
第三章 多组分系统热力学
Thermodynamics of Multicomponent Systems
学习要求:
理解偏摩尔量和化学势的定义、性质。掌握化学 势的计算以及表达式中的参考态与标准态。 掌握拉乌尔(Raoult)定律和亨利(Henry)定律的 表述与数学表达式。 掌握理想混合物的概念、性质以及任一组分化学 势表达式。 掌握理想稀溶液概念及溶剂溶质的化学势表达式。 理想稀溶液的依数性。 了解实际气体的逸度与逸度系数以及实际溶液的 活度与活度系数的概念。
第四章 多组分系统热力学

分子, A分子受力与纯A液体中的受力相似。单位液面
上A分子含量下降至xA (单位液面上蒸发速率按比例下 降),所以A的饱和蒸汽压与组成成正比,比例系数为
纯A饱和蒸汽压。
A
AA A
A
A A
A
A
B
A
A
A A
• 三、亨利定律
在一定温度和平衡态下稀溶液中挥发性溶质(B)在气相中 的分压(PB)与其在溶液中摩尔分数(ΧB)成正比,称为亨利 定律。
•一、偏摩尔量定义
•混合物中的任意广延性质X(V,S,U,H,A,GA,nB,nC…… ),
•X的全微分为:
dX
(
X T
)P
,nB
dT
(
X P
)T
,n
B
dP
B
( X nB
)T
,P ,nC
dnB
B的偏摩尔量为:
XB
( X n B
)T ,P ,nC
• 一、多组分系统
简单系统:一种物质的系统,或几种物质组 成不变的系统。
多组分系统:单相多组分、多相多组分。本 章研究的重点单向多组分系统。即由两个或 两个以上物质以分子大小相互均匀分散而成 的混合系统。
多组分系统按照处理方法不同: 混合物和溶液 多组分系统按集聚状态分类:气态、液态、固态
多组分系统按电解质分类:电解质、非电解质
注意:若A、B分子的性质非常接近,则在全浓度范围内A及B都遵守拉乌尔 ( Raoult )定律,这类系统就称为理想液态混合物。
二、拉乌尔定律的微观解释
A—B两种物质组成的稀溶液中(A为溶剂)
A的饱和蒸汽压与液体中A分子受力和在液面A分子
含量(或单位液面溶剂A蒸发速率)有关。
物理化学 04章_多组分系统热力学及在溶液中的应用

H nB H B
B
A nB AB
B
S nB S B
B
G nB GB
B
= B
上一内容
下一内容
回主目录
返回
2013-8-10
四. 偏摩尔量的求法
⑴ 数学分析法(计算法):
NaBr水溶液的体积与溶液浓度的关系为 V = 1.0029 + 23.189 b + 2.197 b3/2 - 0.178 b2
下一内容 回主目录
返回
2013-8-10
§4.1
多组分系统:
引言
两种或两种以上物质(或称为组分)所形成的系统称 为多组分系统。多组分系统可以是单相系统,也可以是 多相系统。本章主要讨论单相系统。单相系统也称为均 相系统。
人们把多组分系统分成混合物和溶液两部分,并使 用不同的方法进行研究。
上一内容
上一内容 下一内容 回主目录
返回
2013-8-10
二.多组分体系的偏摩尔热力学函数值
使用偏摩尔量时应注意: 1.偏摩尔量的含义是:在等温、等压、保持B物质 以外的所有组分的物质的量不变的条件下,改变 dnB 所引起混合体系广度性质Z的变化值,或在等温、 等压条件下,在大量的定组成体系中加入单位物质 的量的B物质所引起广度性质Z的变化值。 2.只有广度性质才有偏摩尔量,而偏摩尔量本身是 强度性质。 3.纯物质的偏摩尔量就是它的摩尔量。 4.任何偏摩尔量都是T,p和组成的函数。 5.偏摩尔量可为正,为负,亦可为零。
B=1 k
这就是偏摩尔量的集合公式,说明体系的总的容 量性质等于各组分偏摩尔量的加和。
例如:体系只有两个组分,其物质的量和偏摩尔 体积分别为 n1 ,V1 和 n2 ,V2 ,则体系的总体积为:
物理化学 第4章 多组分系统热力学及其在溶液中的应用
ZB
def
Z ( )T , p ,nc (cB) nB
ZB称为物质B的某种容量性质Z的偏摩尔量。
推导:
,k个组分组成,则 设一个均相系统由1,2, 系统任一容量性质Z应是T,p及各组分物质的量的函数, 即: Z Z (T , p, n1 , n2 , , nk )
在等温、等压条件下:
四、化学势与压力的关系
对于纯组分系统,根据基本公式
Gm ( )T Vm p
dG SdT Vdp 有:
B GB
对多组分系统,把 Gm 换为 B ,摩尔体积则改为偏 摩尔体积 VB 。
即:
B VB p T ,nB ,nC
(4.24)
五、化学势与温度的关系 (p216)
§4.1
引言
多组分系统-两种或两种以上物质所形成的系统 多组分单相系统根据研究对象的情况可分为混合物、 溶液和稀溶液 ※混合物(mixture) ——含一种以上组分的系统
多组分均匀系统中,各组分均可选用相同的标准态, 使用相同的经验定律,这种系统可分为气态混合物、液 态混合物和固态混合物。
※溶液(solution) 含一种以上组分的液体相和固体相,其中一种组分 称为溶剂,其余组分为溶质的多组分系统 广义地说,两种或两种以上物质彼此以分子或 离子状态均匀混合所形成的系统称为溶液。 溶液以物态可分为固态溶液和液态溶液。通常 所说的溶液指液态溶液 根据溶液中溶质的导电性又可分为电解质溶 液和非电解质溶液。 本章只讨论液态的非电解质溶液。
dG SdT Vdp 根据纯组分的基本公式,
Gm ( ) p Sm B GB T 将 B代替 Gm , 则得到的摩尔熵 Sm 换为偏摩 尔熵 SB 。
4-3多组分系统热力学-理想液态混合物与理想稀溶液

Physical Chemistry
物理化学(上册)
绪论 第一章 气体 第二章 热力学第一定律 第三章 热力学第二定律 第四章 多组分系统热力学 第五章 化学平衡 第六章 相平衡
第四章 多组分系统热力学
§4-!本章基本要求 §4-1多组分系统热力学概念 §4-2拉乌尔定律与亨利定律 §4-3偏摩尔量 §4-4化学势 §4-5理想液态混合物 §4-6理想稀溶液 §4-7活度活度系数 §4-8化学势小节 §4-$小结与学习指导
d* S*dT V *dp
B
B
B
mixG p
T
B
nBVB
B
nBVB* mixV
2. mixV 0 或 V mix m 0
mix p
G
T
(RT
nB ln xB )
B
p
T
0
§4-5理想液态混合物
四、理想液态混合物混合性质
dG B S B dT VB dp
dG * S * dT V *dp
B
B
6.
mixU mix H P mixV 0
mixU 0 或 mixU m 0
§4-5理想液态混合物
四、理想液态混合物混合性质
小结: 1. mixV=0 , mixU=0 , mixH=0 2. Q=0, W=0 3. mixS=-RnBlnB>0 (绝热 S>0)
mixA=RTnBlnB<0 (恒温恒容W =0 A<0) mixG=RTnBlnB<0 (恒温恒压W =0 G<0)
§4-6理想稀溶液
一、理想稀溶液定义 无限稀溶液,溶质的浓度趋于零的溶液。 对溶剂(A表示)用符合拉乌尔定律
04多组分体系热力学

B
B
吉布斯–杜亥姆方程
xBdXB 0
B
二元系统: xAdX A xBdXB 0
Gibbs-Duhem公式可以表明在温度、压力恒定下,混合物的组 成发生变化时,各组分偏摩尔量变化的相互依赖关系。某一偏 摩尔量的变化可从其它偏摩尔量的变化中求得,即一组分的偏 摩尔量增大,另一组分的偏摩尔量就减小,且增大或减小的比 例与混合物中两组分的摩尔分数成反比。
( nB
)T , p,nC (CB)
B
3.偏摩尔量的测定法举例
以二组分体系的偏摩尔体积为例,说明 测定偏摩尔量的方法原理
Vm
V n1 n2
n1V1,m n2V2,m n1 n2
X1V1,m
X V2 2,m
偏摩尔量的实验测定
以偏摩尔体积为例:
T、P一定,向物质的量 为nC的液体C中,不断 加入B形成混合物,以混 合物体积V和B的物质的 量nB作图。图中任一点 作曲线的切线,其斜率
适用于只做体积功时的任何可逆或不可逆过程:包括封闭或开 放的多组分多相系统发生PVT变化、相变化和化学变化过程。
3.化学势判据及应用举例
dG SdT Vdp B ( )dnB ( )
B
适用于恒温恒压
下封闭系统只做
B ( )dnB ( ) 0
B
体积功时相变化 和化学变化的平
衡判据
dAT ,V dGT , p
混合物中对体积的贡献量VB,等于在无限大量该组成的 混合物中加入单位物质的量的B(混合物组成未变)引起系
统体积的增加值,也等于在有限量的该组成的混合物中
加入dnB的B (混合物组成未变)引起系统体积增加量dV折
合成加入单位物质的量的B时的增量,称为物质B的偏摩
