高考化学 必考题猜测 考点二《阿伏伽德罗常数题》(扫描版,含详解)
高考化学【热点·重点·难点】专练 热点2 阿伏加德罗常数(解析版)

热点2 阿伏加德罗常数(限时:30分钟)1.(2019·新课标Ⅱ卷)已知N A是阿伏加德罗常数的值,下列说法错误的是A. 3g 3He含有的中子数为1N AB. 1 L 0.1 mol·L−1磷酸钠溶液含有的34PO-数目为0.1N AC. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N AD. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A【答案】B【详解】A. 3He的中子数为3-2=1,则3g3He的中子数为3g3g/mol AN⨯=NA,A项正确;B. 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1L 0.1mol/L的磷酸钠溶液中磷酸根离子的个数小于1L×0.1mol/L×N A mol-1 =0.1N A,B项错误;C. 重铬酸钾被还原为铬离子时,铬元素从+6降低到+3,1mol重铬酸钾转移的电子数为3mol×2×N A mol-1 =6N A,C项正确;D. 正丁烷与异丁烷的分子式相同,1个分子内所含共价键数目均为13个,则48g正丁烷与10g异丁烷所得的混合物中共价键数目为48g+10g58g/mol×13×N A mol-1 =13N A,D项正确。
2.(2019·山东省济南外国语学校高考模拟)设N A为阿伏加德罗常数的值。
下列说法正确的是()A. 用惰性电极电解CuSO4溶液一段时间后,若加入29.4 gCu(OH)2能使溶液复原,则电解过程中转移电子的数目为1.2N AB. 常温常压下,0.5 molO3与11.2 LO2所含的分子数均为0.5N AC. 一定条件下,丁烷催化裂化生成1mol乙烯时,消耗丁烷的数目为N AD. 25℃时,1LpH=10的NaHCO3溶液中含有H2CO3的数目为10-4N A【答案】A【详解】A、若加入29.4gCu(OH)2能使溶液复原,则相当于阴极上析出氢气和铜,生成0.3mol铜转移电子个数=0.3mol×2×N A/mol=0.6N A,根据原子守恒知,生成0.3mol水需要0.3mol氢气,生成0.3mol氢气转移电子的个数=0.3mol×2×N A/mol=0.6N A,所以电解过程中共转移电子数为1.2N A,选项A正确;B、常温常压下,11.2L O2的物质的量小于0.5mol,0.5mol O3和11.2L O2的分子数不相等,选项B错误;C、一定条件下,丁烷催化裂化除生成乙烯和乙烷这种均裂外,还会裂解生成甲烷和丙烯,则生成1mol乙烯时,消耗丁烷的数目大于N A,选项C错误;D、25℃时,1LpH=10的NaHCO3溶液中含有H2CO3的数目小于10-4N A,选项D 错误。
高中化学《阿伏伽德罗常数》练习题(含答案解析)

高中化学《阿伏伽德罗常数》练习题(含答案解析)学校:___________姓名:___________班级:________________一、单选题1.设N A 为阿伏加德罗常数的值,下列说法正确的是 ( )A .1 mol ·L -1 CuCl 2溶液中含Cl -的数目为2N AB .20g D 2O 中含有的电子数为12N AC .11.2 LNH 3中含有的氢原子数为1.5N AD .1mol Na 与足量O 2反应,生成Na 2O 和Na 2O 2的混合物,钠失去N A 个电子2.下列物质所含原子数最多的是( )A .常温常压下28gCOB .标准状况下22.4LN 2C .1mol 的CH 4D .N A 个NO 分子 3.下列说法正确的是( )A .28g 氮气含有的原子数为N AB .24g 金属镁变成镁离子时失去的电子数为0.1N AC .18g +4NH 中所含的质子数为10N AD .32gO 2和32gO 3所含的氧原子数目相等4.设N A 为阿伏加德罗常数的值,0.5molBa(NO 3)2含NO 3 的数目为( )A .N AB .2N AC .3N AD .4N A5.用A N 表示阿伏加德罗常数的值,下列叙述正确的是( )A .21mol H O 中含有的原子数为A NB .22H g 中含有的氢原子数为2A NC .常温常压下,11.2L 2N 中含有的分子数为0.5A ND .1L0.1mol ·L -1NaNO 3溶液中含有的钠离子数为A N6.下列说法中,正确的是( )A .O 2的摩尔质量是32gB .通常情况下,1molCO 的体积是22.4LC .1molH 2中含有的分子数约为6.02×1023D .0.1mol/LNaCl 溶液中含有0.1molNa +7.N A 表示阿伏加德罗常数的值,下列说法正确的是( )A .1molNa 含有的电子数为11N AB .常温下,11.2LCO 2中含有的分子数为0.5N AC .N 2的摩尔质量为28gD .2.4g 金属镁转化为镁离子时失去的电子数目为0.1N A8.A N 表示阿伏加德罗常数的值,下列说法正确的是( )A .41molCH 和等量的2Cl 在光照下反应生成的3CH Cl 分子数为A NB .28g 乙烯和乙烷的混合物中含有的碳氢键数为A 2NC .260gSiO 晶体中含有Si O 键的数目为A 2ND .78g 乙炔和苯分别完全燃烧,消耗2O 的分子数均为A 7.5N9.设N A 为阿伏加德罗常数的值,下列说法正确的是( )A .pH=13的NaOH 溶液中含有的OH -数目为0.1N AB .0.46gNa 与10 mL 1 mol ·L -1HCl 反应,转移的电子数为0.01N AC .1L0.5 mol ·L -1的(NH 4)2SO 4溶液中含有+4NH 总数为N AD .常温常压下,2.24L SO 2中含有的分子数小于0.1 N A10.N A 表示阿伏加德罗常数,下列判断正确的是( )A .在18g 18O 2中含有N A 个氧原子B .标准状况下,22.4L 水中含有N A 个氢原子C .1molCl 2参加氧化还原反应转移的电子数一定为2N AD .含N A 个Na +的NaOH 溶解于1L 水中,Na +的物质的量浓度为1mol/L11.用N A 表示阿伏加德罗常数的值,下列叙述正确的是( )A .含有N A 个氦原子的氦气在标准状况下的体积约为11.2LB .将1L2mol/L 的FeCl 3溶液制成胶体后,其中含有氢氧化铁胶粒数为2N AC .常温常压下,1.06gNa 2CO 3含有的Na +离子数为0.02N A 个D .标准状况下,11.2LCCl 4含有的分子数为0.5N A12.设NA 为阿伏加德罗常数,以下叙述正确的是( )A .1 L 0.1 mol/L NH 4NO 3溶液中含有铵根离子数目为0.1NAB .标准状况下,22.4 L SO 3中含有的氧原子数为3NAC .常温、常压下22.4L 氯气与含有1 mol FeI 2的溶液反应时,转移的电子数小于2N AD .常温常压下,16g O 2作氧化剂时转移电子数一定为2NA13.设N A 为阿伏加德罗常数的值,下列叙述正确的是( )A .标准状况下,22.4L H 2O 含有分子数为N AB .分子总数为N A 的N 2、CO 混合气体体积约为22.4L ,质量为28gC .常温常压下,1.6g CH 4含原子数为0.5N AD .0.2mol/L K 2SO 4溶液中有0.4N A 个K +二、填空题14.正确填写下列数据(1)1mol O 2中约含有________个氧分子;(2)2mol C 中约含有________个碳原子;(3)1mol H 2SO 4中约含有_________个硫酸分子;(4)1.5molNaOH 中约含有_______个Na +,______个OH -;(5)n mol 某微粒集合体中约含有该微粒约为__________个;(6)1.204×1024个水分子的物质的量_______mol ;(7)9.03×1023个铁原子的物质的量________mol 。
高考化学一轮复习考点真题集训 阿伏加德罗常数(word版,含解析)

【考点训练】阿伏加德罗常数【知识点的认识】1、阿伏伽德罗常数:(1)概念:阿伏加德罗常数的定义值是指0.012kg 12C所含的原子数,约为6.02×1023,符号为NA.表示1mol任何粒子的数目.(2)单位:mol-1.2、阿伏加德罗常数可用多种实验方法测得,到目前为止测得比较精确的数据是6.0221367×1023 mol-1.【命题方向】本考点主要考察阿伏伽德罗常数的概念、符号及数值、单位,需要重点掌握.题型一:阿伏伽德罗常数的概念典例1:下列叙述正确的是()A.1 mol任何物质都含有6.02×1023个原子B.0.012 kg12C约含有6.02×1023个碳原子C.硫酸的摩尔质量是98g D.常温常压下,1 mol氧气的体积约为22.4L分析:A、物质有的是单原子分子,有的是双原子分子多原子分子,离子化合物等;B、依据阿伏伽德罗常数的概念分析判断;C、摩尔质量是单位物质的量的物质的质量;D、常温常压下,气体摩尔体积不为22.4L/mol.解答:A、构成物质的微粒不同,1 mol任何物质不一定都含有6.02×1023个原子,故A错误;B、0.012 kg12C约含有6.02×1023个碳原子为1mol,为阿伏伽德罗常数的规定,故B正确;C、硫酸的摩尔质量是98g/mol,故C错误;D、常温常压下,1 mol氧气的体积不是22.4L,故D错误;故选B.点评:本题考查了阿伏伽德罗常数的应用,主要考查阿伏伽德罗常数的规定,气体摩尔体积的条件应用,摩尔质量的概念判断,题目较简单.题型二:阿伏伽德罗常数的计算应用典例2:设NA是阿伏加德罗常数的数值.下列说法正确的是()A.1L 0.1mol•L-1的FeCl3溶液中,Fe3+的数目为0.1NA B.1mol NH3中含有N-H键的数目为3NA C.7.8g Na2O2中含有的阳离子数目为0.1NA D.标准状况下,22.4L水中分子个数为NA分析:A、氯化铁溶液中铁离子部分水解,铁离子数目减少;B、氨气分子中含有3个氮氢键,1mol氨气中含有3mol氮氢键;C、过氧化钠中的阳离子为钠离子,0.1mol过氧化钠中含有0.2mol钠离子;D、标准状况下水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量.解答:A、1L 0.1mol•L-1的FeCl3溶液中含有溶质氯化铁0.1mol,铁离子部分水解,溶液中含有的铁离子小于0.1mol,Fe3+的数目小于0.1nA,故A错误;B、1mol氨气中含有3mol氮氢键,含有N-H键的数目为3nA,故B正确;C、7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.2mol钠离子,含有的阳离子数目为0.2nA,故C错误;D、标况下,水不是气体,题中条件无法计算22.4L水的物质的量,故D错误;故选B.点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下的气体摩尔体积的使用条件.【解题思路点拨】阿伏伽德罗常数的常见问题和注意事项:1)物质的状态是否为气体;2)对于气体注意条件是否为标况;3)注意同位素原子的差异;4)注意可逆反应或易水解盐中离子数目的判断;5)注意物质的结构:如Na2O2是由Na+和O22-构成,而不是有Na+和O2-构成;SiO2、SiC都是原子晶体,其结构中只有原子没有分子,SiO2是正四面体结构,1molSiO2中含有的共价键为4NA,1molP4含有的共价键为6NA等.一、选择题(共15小题)1.设N A为阿伏加德罗常数的值,下列说法中正确的是()A.常温常压下,11.2L氧气含有的原子数目为N AB.锌从盐酸中置换出1mol H2,转移的电子数目为N AC.4.4g二氧化碳含有的分子数目为0.1N AD.1mol/L CaCl2溶液中含有的氯离子数目为2N A2.设N A为阿伏加德罗常数的数值,下列说法正确的是()A.1 mol甲烷中含有10N A个质子B.27g铝被完全氧化成氧化铝,失去2N A个电子C.标准状况下,22.4 L苯含有N A个C6H6分子D.常温常压下,28g乙烯含有2N A个碳碳双键3.用N A表示阿伏加德罗常数的值.下列叙述中不正确的是()A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2N AC.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2N A4.N A为阿伏伽德罗常数,下列叙述错误的是()A.标准状况下,11.2 L氦气中含有0.5 N A原子B.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0.2 N AC.常温常压下,46g NO2和N2O4混合气体中含有原子总数为3N AD.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数N A个5.设N A为阿伏伽德罗常数的值,下列叙述正确的是()A.标准状态下,33.6L氟化氢中含有氟原子的数目为N AB.常温常压下,7.0g乙烯与丙稀的混合物红含有氢原子的数目为N AC.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46N AD.某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6N A6.用N A表示阿伏加德罗常数,下列说法正确的是()A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1N AB.1mol Na2CO3晶体中含CO离子数小于1 N AC.惰性电极电解食盐水,若线路中通过1 N A电子,则阳极产生气体11.2L D.0.1 mol的CaO2中含阴离子数是0.2 N A7.若N A为阿伏加德罗常数的值,下列说法正确的是()A.N A个Fe(OH)3胶体粒子的质量为107gB.8.0gCu2S和CuO的混合物中含有铜原子数为0.1N AC.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1N AD.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1N A到0.2N A之间8.设N A为阿伏伽德罗常数的值.下列叙述正确的是()A.78gNa2O2固体中含有的阴离子数为N AB.标准状况下,2.24L氖气所含原子数为0.2N AC.1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1N AD.标准状况下,2.24L己烷含有分子的数目为0.1N A9.下列叙述正确的是()A.标准状况下,1.12L 16O2和1.12L 18O2均含有0.1N A个氧原子B.第三周期非金属元素含氧酸的酸性从左到右依次增强C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl﹣、NO3﹣D.从C(石墨)═C(金刚石);△H=+1.9kJ•mol﹣1,可知金刚石比石墨更稳定10.N A表示阿伏伽德罗常数,下列叙述正确的是()A.1mol FeI2与足量氯气反应时转移的电子数为2N AB.2L 0.5mol•L﹣1硫酸钾溶液中阴离子所带电荷数为N AC.1mol Na2O2固体中含离子总数为4N AD.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6N A11.设N A为阿伏加德罗常数的值.下列说法正确的是()A.常温下,0.05mol•L﹣1Fe2(SO4)3溶液中含Fe3+数目为0.1N AB.标准状况下,22.4L甲苯中含C﹣H数目为8 N AC.常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1N AD.0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2N A12.设N A为阿伏加德罗常数的值,下列叙述正确的是()A.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5N AB.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为N AC.50mL18.4mol•L﹣1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46N AD.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6N A13.设N A为阿伏加德罗常数的值.下列说法正确的是()A.常温常压下,17g甲基(﹣14CH3)所含的中子数为9N AB.标准状况下,11.2L苯中含有的碳碳双键数为1.5N AC.42.0g乙烯和丙烯的混合气体中含有的碳原子数为3N AD.5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3N A14.N A为阿伏伽德罗常数的值,下列叙述正确的是()A.1.0L 1.0mo1•L﹣1的NaAlO2水溶液中含有的氧原子数为2N AB.12g石墨烯(单层石墨)中含有六元环的个数为0.5N AC.25℃时pH=13的NaOH溶液中含有OH﹣的数目为0.1N AD.1mol的羟基与1moL的氢氧根离子所含电子数均为9N A15.若N A表示阿佛加德罗常数,下列说法正确的是()A.1 mol Cl2作为氧化剂得到的电子数为N AB.在0℃,101 kPa时,22.4 L氢气中含有N A个氢原子C.14 g氮气中含有7N A个电子D.N A个一氧化碳分子和0.5 mol甲烷的质量比为7:4二、填空题(共5小题)(除非特别说明,请填准确值)16.摩尔这个单位是以kg 12C中所含的原子数目为标准,来衡量其它粒子集体中所含粒子数目的多少.该数目的数值是个常数,被称为.17.1mol H2SO4中含mol硫原子,个氧原子.18.物质的量相等的CO和CO2中,分子个数之比为;原子个数之比为;氧原子个数比为.19.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol﹣1用N A表示阿伏加德罗常数,则:(1)该气体的物质的量为mol.该气体所含原子总数为个.(3)该气体在标准状况下的体积为L.(4)该气体溶液于水后形成V L溶液,其溶液的物质的量浓度为mol•L﹣1.20.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol﹣1.若阿伏加德罗常数用N A表示,则:(1)该气体的物质的量为mol.该气体所含原子总数为个.(3)该气体在标准状况下的体积为L.(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为% .设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为mol•L﹣1.(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为mol•L﹣1.三、解答题(共1小题)(选答题,不自动判卷)21.一定质量的某金属Z A X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成:6.02×1022个Z A X n+,这些阳离子共有6.02×1.3×1023个质子、6.02×1.4×1023个中子.(1)求Z、n和A的值.Z= ;n= ;A= .写出该金属与稀H2SO4反应的化学方程式.【考点训练】阿伏加德罗常数-1参考答案与试题解析一、选择题(共15小题)1.设N A为阿伏加德罗常数的值,下列说法中正确的是()A.常温常压下,11.2L氧气含有的原子数目为N AB.锌从盐酸中置换出1mol H2,转移的电子数目为N AC.4.4g二氧化碳含有的分子数目为0.1N AD.1mol/L CaCl2溶液中含有的氯离子数目为2N A考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、依据气体摩尔体积应用条件分析,标准状况气体摩尔体积为22.4L/mol;B、依据电子守恒计算;C、依据n=计算物质的量得到分子数;D、溶液体积不知不能计算微粒数;解答:解:A、依据气体摩尔体积应用条件分析,标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L 氧气物质的量小于0.5mol,故A错误;B、依据电子守恒计算,锌从盐酸中置换出1mol H2,转移的电子数目为2N A,故B错误;C、依据n=计算物质的量==0.1mol,得到分子数0.1N A,故C正确;D、溶液体积不知不能计算微粒数,故D错误;故选C.点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件分析,物质的量计算微粒数,题目较简单.2.设N A为阿伏加德罗常数的数值,下列说法正确的是()A.1 mol甲烷中含有10N A个质子B.27g铝被完全氧化成氧化铝,失去2N A个电子C.标准状况下,22.4 L苯含有N A个C6H6分子D.常温常压下,28g乙烯含有2N A个碳碳双键考点:阿伏加德罗常数.分析:A、甲烷是10电子微粒;B、根据反应后铝的价态来分析;C、标况下,苯为液态;D、求出乙烯的物质的量,然后根据1mol乙烯含1mol双键来分析.解答:解:A、甲烷是10电子微粒,1mol甲烷含10mol电子和10mol质子,故A正确;B、27g铝的物质的量为1mol,反应后铝的价态为+3价,故1mol铝失去3mol电子,故B错误;C、标况下,苯为液态,故C错误;D、28g乙烯的物质的量为1mol,而1mol乙烯含1mol双键,故D错误.故选A.点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.3.用N A表示阿伏加德罗常数的值.下列叙述中不正确的是()A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2N AC.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2N A考点:阿伏加德罗常数.分析:A、NO2和CO2均含2个氧原子;B、乙烯C2H4)和环丁烷(C4H8)的最简式均为CH2;C、NO2和N2O4的最简式均为NO2;D、常温常压下,气体摩尔体积大于22.4L/mol.解答:解:A、分子总数为N A的NO2和CO2混合气体的物质的量为1mol,而NO2和CO2均含2个氧原子,故1mol混合气体中无论两者的比例如何,均含2mol氧原子,即2N A个,故A正确;B、乙烯C2H4)和环丁烷(C4H8)的最简式均为CH2,故28g混合物中含有的CH2的物质的量n==2mol,故含有2mol碳原子,即2N A个,故B正确;C、NO2和N2O4的最简式均为NO2,故92g混合物中含有的NO2的物质的量n==2mol,而1molNO2中含3mol原子,即2molNO2中含6mol原子,即6N A个,故C正确;D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氯气的物质的量小于1mol,故转移的电子的物质的量小于2mol,故D错误.故选D.点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.4.N A为阿伏伽德罗常数,下列叙述错误的是()A.标准状况下,11.2 L氦气中含有0.5 N A原子B.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0.2 N AC.常温常压下,46g NO2和N2O4混合气体中含有原子总数为3N AD.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数N A个考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、氦气是单原子分子,标准状况下,11.2 L氦气的物质的量是0.5mol;B、氯气参加的反应,可能是自身的氧化还原反应,转移的电子数减少;C、根据质量守恒定律,46g混合气体相当于是1mol二氧化氮的组成;D、根据电子守恒,钠反应失去1个电子,生成+1价的钠离子.解答:解:A、标准状况下,11.2 L氦气的物质的量是0.5mol,含有的原子是0.5mol,含有0.5 N A原子,故A正确;B、氯气和水、强碱溶液的反应,属于自身氧化还原反应,0.1 mol Cl2反应转移0.1mol电子,故B错误;C、46g NO2和N2O4混合气体与46g二氧化氮组成相同,含有原子总数为3N A,故C正确;D、钠反应失去1个电子,1 mol Na与足量O2反应,失去1mol电子,转移电子总数N A个,故D正确;故选B.点评:本题考查阿伏伽德罗常数,转移质量守恒定律和电子守恒的应用,本题难度中等.5.设N A为阿伏伽德罗常数的值,下列叙述正确的是()A.标准状态下,33.6L氟化氢中含有氟原子的数目为N AB.常温常压下,7.0g乙烯与丙稀的混合物红含有氢原子的数目为N AC.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46N AD.某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6N A考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、根据标准状况下氟化氢的状态进行判断;B、根据乙烯和丙烯的最简式计算出含有的氢原子的物质的量及数目;C、根据铜足量,浓硫酸变成稀硫酸,稀硫酸与铜不反应进行分析;D、根据合成氨的反应是可逆反应进行分析.解答:解:A、在标准状况下,氟化氢不是气体,无法计算33.6L氟化氢的物质的量,故A错误;B、乙烯和丙烯的最简式为CH2,7.0g混合气体含有0.5mol最简式,含有1mol氢原子,含有氢原子的数目为N A,故B正确;C、50mL18.4mol/L浓硫酸中含有0.92mol硫酸,浓硫酸完全反应生成0.46mol二氧化硫,由于铜足量,浓硫酸反应后变成稀硫酸,稀硫酸与铜不反应,故生成SO2分子的数目小于0.46N A,故C错误;D、由于氮气与氢气生成氨气的反应是可逆反应,0.1molN2和0.3molH2不可能完全转化成0.2mol氨气,因此转移电子的数目小于0.6N A,故D错误;故选:B.点评:本题考查了阿伏伽德罗常数,注意标准状况下的物质状态,注意可逆反应不可能完全转化,本题难度不大.6.用N A表示阿伏加德罗常数,下列说法正确的是()A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1N AB.1mol Na2CO3晶体中含CO离子数小于1 N AC.惰性电极电解食盐水,若线路中通过1 N A电子,则阳极产生气体11.2LD.0.1 mol的CaO2中含阴离子数是0.2 N A考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、金属钠为1价金属,根据电子守恒分析2.3g钠完全反应注意的电子的物质的量;B、碳酸钠晶体中碳酸根离子的物质的量等于碳酸钠的物质的量;C、没有告诉是标准状况下,无法计算阳极生成气体的体积;D、过氧化钙中的阴离子为过氧根离子,0.1mol过氧化钙中含有0.1mol阴离子.解答:解:A、2.3g金属钠的物质的量为0.1mol,金属钠完全反应失去0.1mol电子,转移电子数均为0.1N A,故A正确;B、1mol碳酸钠中含有1mol碳酸根离子,含有的碳酸根离子数为1N A,故B错误;C、惰性电极电解食盐水,若线路中通过1N A电子,电子的物质的量为1mol,阳极生成了0.5mol氯气,由于不是标况下,阳极产生气体的体积无法计算,故C错误;D、0.1molCaO2中含有0.1mol阴离子O22﹣离子,所以含有的阴离子数为0.1N A,故D错误;故选A.点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,并准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.7.若N A为阿伏加德罗常数的值,下列说法正确的是()A.N A个Fe(OH)3胶体粒子的质量为107gB.8.0gCu2S和CuO的混合物中含有铜原子数为0.1N AC.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1N AD.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1N A到0.2N A之间考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、胶体粒子是由多个氢氧化铁聚集成较大颗粒的粒子;B、从Cu2S和CuO的相对分子质量可知,铜元素在Cu2S和CuO中的质量分数相同;C、Cl2溶于水,只有部分Cl2反应;D、根据Na元素的化合价变化计算.解答:解:A、胶体粒子是由多个氢氧化铁聚集成较大颗粒的粒子,因此无法确定Fe(OH)3的数目,故A错误;B、从Cu2S和CuO的相对分子质量可知,铜元素在Cu2S和CuO中的质量分数相同,无论Cu2S和CuO 物质的量之比如何变化,8.0g混合物中铜元素物质的量为0.1mol,即0.1NA,故B正确;C、Cl2溶于水,只有部分Cl2反应,故无法确定参加反应的氯气的量,故C错误;D、Na元素的化合价从0变化为+1价,转移1个电子,所以2.3gNa与氧气完全反应,反应中转移的电子数为0.1N A,故D错误;故选B.点评:本题考查阿伏加德罗常数,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.8.设N A为阿伏伽德罗常数的值.下列叙述正确的是()A.78gNa2O2固体中含有的阴离子数为N AB.标准状况下,2.24L氖气所含原子数为0.2N AC.1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1N AD.标准状况下,2.24L己烷含有分子的数目为0.1N A考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有1mol过氧根离子;B.稀有气体为单原子分子,标况下2.24L氖气的物质的量为0.1mol,含有0.2mol氖原子;C.醋酸为弱电解质,溶液中只能部分电离出氢离子;D.标况下己烷为液体,不是气体,不能使用标况下的气体摩尔体积计算其物质的量.解答:解:A.78g过氧化钠的物质的量为:=1mol,1mol过氧化钠中含有1mol过氧根离子,含有的阴离子数为N A,故A正确;B.标准状况下,2.24L氖气的物质的量为:=0.1mol,0.1mol氖气中含有0.1mol氖原子,所含原子数为0.1N A,故B错误;C.1L0.1 mol/L醋酸溶液中含有溶质醋酸0.1mol,0.1mol醋酸只能部分电离出氢离子,则溶液中氢离子的物质的量小于0.1mol,含有的氢离子数小于0.1N A,故C错误;D.标准状况下,己烷不是气体,题中条件无法计算2.24L己烷的物质的量,故D错误;故选A.点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,选项A为易错点,注意过氧化钠中的阴离子为过氧根离子.9.下列叙述正确的是()A.标准状况下,1.12L 16O2和1.12L 18O2均含有0.1N A个氧原子B.第三周期非金属元素含氧酸的酸性从左到右依次增强C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl﹣、NO3﹣D.从C(石墨)═C(金刚石);△H=+1.9kJ•mol﹣1,可知金刚石比石墨更稳定考点:阿伏加德罗常数;元素周期律的作用;反应热和焓变;离子共存问题.专题:基本概念与基本理论.分析:A.标况下1.12L气体的物质的量为0.05mol,16O2和18O2分子中都含有2个氧原子;B.应该为最高价氧化物对应的水化物的酸性从左到右依次增强;C.能使甲基橙显红色的溶液为酸性溶液,硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;D.物质能量越高,稳定性越差,该反应为吸热反应,石墨能量小于金刚石.解答:解:A.标准状况下1.12L氧气的物质的量为0.05mol,0.05mol16O2和1.12L 18O2均含有0.1mol 氧原子,含有0.1N A个氧原子,故A正确;B.第三周期非金属元素最高价含氧酸的酸性从左到右依次增强,没有指出元素的化合价为最高价,故B 错误;C.能使甲基橙显红色的溶液中中存在大量氢离子,NO3﹣在氢离子存在条件下能够氧化Fe2+,在溶液中不能大量共存,故C错误;D.从C(石墨)═C(金刚石);△H=+1.9kJ•mol﹣1,石墨的能量低于金刚石,则石墨的稳定性高于金刚石,故D错误;故选A.点评:本题考查阿伏加德罗常数、离子共存、物质稳定性与能量的关系,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确离子共存的条件及物质能量越低、稳定性越强.10.N A表示阿伏伽德罗常数,下列叙述正确的是()A.1mol FeI2与足量氯气反应时转移的电子数为2N AB.2L 0.5mol•L﹣1硫酸钾溶液中阴离子所带电荷数为N AC.1mol Na2O2固体中含离子总数为4N AD.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6N A考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A.亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气;B.根据n=cV计算出硫酸钾的物质的量,再根据硫酸根离子的物质的量计算出所带的电荷的数目;C.过氧化钠中含有的离子为钠离子和过氧根离子;D.根据丙烯和环丙烷的最简式计算出混合物中含有的氢原子数目.解答:解:A.1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3N A,故A错误;B.2L 0.5mol•L﹣1硫酸钾溶液中含有溶质硫酸钾1mol,1mol硫酸钾中含有1mol硫酸根离子,带有2mol 负电荷,所带电荷数为2N A,故B错误;C.1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子,含离子总数为3N A,故C错误;D.42g丙烯和环丙烷中含有3mol最简式CH2,含有6mol氢原子,含有的氢原子的个数为6N A,故D 正确;故选D.点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确过氧化钠中阴离子为过氧根离子,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意根据最简式计算混合物中含有氢原子、碳原子的数目的方法.11.设N A为阿伏加德罗常数的值.下列说法正确的是()A.常温下,0.05mol•L﹣1Fe2(SO4)3溶液中含Fe3+数目为0.1N AB.标准状况下,22.4L甲苯中含C﹣H数目为8 N AC.常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1N AD.0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2N A考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、没有告诉硫酸铁溶液的体积,无法计算溶液中铁离子数目;B、标准状况下,甲苯的状态不是气体,不能使用标况下的气体摩尔体积计算甲苯的物质的量;C、1.6g氧气和臭氧中含有11.6g氧原子,含有0.1mol氧原子;D、过氧化钠中氧元素为﹣1价,0.1mol过氧化钠与二氧化碳完全反应生成了0.05mol氧气,转移了0.1mol 电子.解答:解:A、题中没有告诉0.05mol•L﹣1Fe2(SO4)3溶液的体积,无法计算溶液中铁离子的数目,故A错误;B、标况下,甲苯不是气体,题中条件无法计算22.4L甲苯的物质的量,故B错误;C、1.6g氧气和臭氧的化合物中含有11.6g氧原子,1.6g氧原子的物质的量为0.1mol,氧原子的数目为0.1N A,故C正确;D、0.1mol过氧化钠与足量二氧化碳完全反应生成了0.05mol氧气,转移了0.1mol电子,转移的电子数目为0.1N A,故D错误;故选C.点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.12.设N A为阿伏加德罗常数的值,下列叙述正确的是()A.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5N AB.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为N AC.50mL18.4mol•L﹣1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46N AD.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6N A考点:阿伏加德罗常数.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、氟化氢的沸点是19.4℃,在标准状况下是液体,所以不能用气体摩尔体积来计算;B、乙烯与丙烯的最简式均为CH2,计算7gCH2中的氢原子数得到;C、浓硫酸随反应进行浓度变稀后不与铜反应;D、氮气和氢气合成氨是可逆反应不能进行彻底.解答:解:A、氟化氢的沸点是19.4℃,在标准状况下是液体,33.6L氟化氢物质的量不是1.5mol,不能用气体摩尔体积来计算,故A错误;B、.0g乙烯与丙烯的混合物中含有氢原子的数目,因为乙烯与丙烯的最简式均为CH2,所以计算7gCH2中的氢原子数=×2=1mol,故B正确;C、50mL18.4mol•L﹣1浓硫酸与足量铜微热反应,浓硫酸随反应进行浓度变稀后不与铜反应,生成SO2分子的数目小于0.46N A,故C错误;D、氮气和氢气合成氨是可逆反应不能进行彻底,0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目小于0.6N A,故D错误;故选B.点评:本题考查了阿伏伽德罗常的应用,主要考查气体摩尔体积的体积应用,质量换算物质的量计算微粒数,关键是浓硫酸岁反应进行浓度变稀不与铜反应,合成氨反应是可逆反应,题目难度中等.13.设N A为阿伏加德罗常数的值.下列说法正确的是()A.常温常压下,17g甲基(﹣14CH3)所含的中子数为9N AB.标准状况下,11.2L苯中含有的碳碳双键数为1.5N AC.42.0g乙烯和丙烯的混合气体中含有的碳原子数为3N AD.5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3N A考点:阿伏加德罗常数.。
高考选择。阿伏伽德罗专题。(含答案解析)

高考选择。
阿伏伽德罗专题。
(含答案解析)1.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
3.6 g D₂O中含有的中子数为2N_A。
B。
10 g C₂H₄和4 g CO组成的混合气体中含有的分子数为0.5N_A。
C。
标准状况下,2.24 L HF中含有的分子数为0.1N_A。
D。
KIO₃与HI溶液反应,生成0.1 mol I₂转移的电子数为0.2N_A。
2.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
标准状况下,22.4 L盐酸含有N_A个HCl分子。
B。
常温常压下,7.8 g Na₂O₂含离子数为0.4N_A。
C。
室温下向1 L pH=1的醋酸溶液中加水,所得溶液中H 数目大于0.1 N_A。
D。
1 mol 乙酸(忽略挥发损失)与足量的 C₂H₅OH 在浓硫酸作用下加热,充分反应可生成N_A个CH₃COOC₂H₅。
3.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列有关叙述正确的是:A。
将 78 g Na₂O₂与过量 CO₂反应转移的电子数为2N_A。
B。
1 mol N₂与4 mol H₂反应生成的 NH₃分子数为2N_A。
C。
标准状况下,2.24 L CCl₄中所含原子数为0.5N_A。
D。
标准状况下,18 g D₂O中所含电子数为9N_A。
4.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
标准状况下,11.2 L的甲醇所含的氢原子数等于2N_A。
B。
常温常压下,Na₂O₂与H₂O反应生成1 mol O₂时,转移电子数是2N_A。
C。
25℃时,Ksp(BaSO₄)=1×10⁻¹³,则 BaSO₄饱和溶液中 Ba 数目为1×10⁻¹³N_A。
2022届高考化学一轮复习常考题型02阿佛伽德罗常数含解析

阿佛伽德罗常数一、单选题(共20题)1.设N A表示阿伏加德罗常数的值,下列说法不正确的是A.标准状况下,3.2g14C18O中含中子数为1.8N AB.常温常压下,4.6gNO2和N2O4混合气体中含有的氧原子数目为0.2N A C.78gNa2S和Na2O2的混合物中含有阴离子数等于N AD.235g核素23592U发生裂变反应:23592U+1n裂变−−−−−→9038Sr+13654Xe+1010n,净产生的中子(10n)数为10N A2.N A表示阿伏加德罗常数的值,下列说法错误的是A.1 mol白磷分子中含有P-P 共价键数为6N AB.1 mol NH4Cl溶于水形成的溶液中阳离子总数大于N AC.1 mol H2O分子中氧原子的价层电子对数为4N AD.常温下,pH=10的NaHCO3溶液中由水电离产生的H+数为1N A3.设N A为阿伏伽德罗常数的值,下列说法正确的是A.19 g18OH-所含的中子数和电子数均为9 N AB.标况下,2.24 L CHCl3含有的共价键数目为0.4 N AC.苯与苯甲酸的混合物共1 mol,充分燃烧消耗氧气的分子数为7.5 N AD.0.1 mol乙酸乙酯与稀硫酸共热,充分反应后得到乙醇的分子数为0.1 N A4.设N A表示阿伏加德罗常数的值,下列说法正确的是A.16 g甲烷中含电子数为10N AB.78 g苯中含碳碳双键数目为3N AC.标准状况下,11.2 L己烷中含有的分子数为 0.5N AD.0.1 mol乙酸与0.1 mol乙醇在浓硫酸催化下充分反应,生成乙酸乙酯的分子数为0.1N A 5.设N A是阿伏加德罗常数的值。
下列说法正确的是A.2.4g石墨烯与金刚石的混合物中含有的碳原子数为0.2N AB.7.8g苯分子中含有碳碳双键的数目为0.3N A、碳碳单键的数目为0.3N AC.0.1molOH和1.7g羟基(—OH)的电子数均为N AD.标准状况下,11.2L二氯甲烷中含共用电子对数为2N A6.设A N 为阿伏加德罗常数的值,下列叙述正确的是A .标准状况下,2.24L 四氯化碳含碳原子数为A 0.1NB .32 gCu 与足量浓硝酸反应,产物为2NO 和NO ,则反应中浓硝酸得到的电子数为A NC .1821.8gH O 与2D O 的混合物中含有的质子数和电子数均为A ND .40.1 mol CH 与20.1 mol Cl 混合充分光照,生成3CH Cl 分子数为A 0.1 N7.设A N 为阿伏加德罗常数的数值,下列说法正确的是A .通常状况下,2.24L 2NO 和24N O 的混合气体中氮原子和氧原子个数之比为1∶2B .1L 10.1mol L -⋅的氨水中含有0.1A N 个OH -C .56gFe 和64gCu 分别与1molS 反应转移的电子数均为2A ND .46g 甲苯中含有碳碳双键的数目为1.5A N8.设A N 为阿伏加德罗常数。
高考化学备考全方案12题揭秘专题02阿伏伽德罗常数题型揭秘
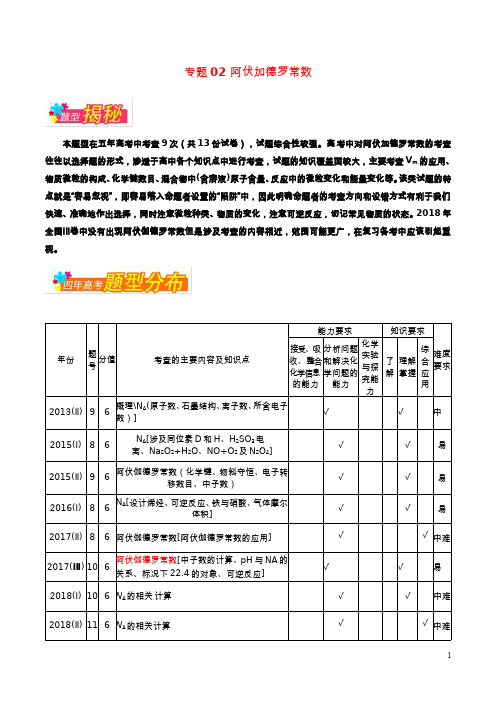
专题02 阿伏加德罗常数本题型在五年高考中考查9次(共13份试卷),试题综合性较强。
高考中对阿伏加德罗常数的考查往往以选择题的形式,渗透于高中各个知识点中进行考查,试题的知识覆盖面较大,主要考查V m的应用、物质微粒的构成、化学键数目、混合物中(含溶液)原子含量、反应中的微粒变化和能量变化等。
该类试题的特点就是“容易忽视”,即容易落入命题者设置的“陷阱”中,因此明确命题者的考查方向和设错方式有利于我们快速、准确地作出选择,同时注意微粒种类、物质的变化,注意可逆反应,切记常见物质的状态。
2018年全国Ⅲ卷中没有出现阿伏伽德罗常数但是涉及考查的内容相近,范围可能更广,在复习备考中应该引起重视。
的相关计算1.【2018新课标1卷】N A是阿伏加德罗常数的值,下列说法正确的是A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB.22.4 L(标准状况)氩气含有的质子数为18N AC.92.0 g甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A【答案】B【解析】A、16.25g氯化铁的物质的量是16.25g÷162.5g/mol=0.1mol,由于氢氧化铁胶体是分子的集合2.【2018新课标2卷】N A代表阿伏加德罗常数的值。
下列说法正确的是A.常温常压下,124 g P4中所含P—P键数目为4N AB.100 mL 1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1N AC.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2N AD.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2N A【答案】C【解析】A.常温常压下,124 g P4的物质的量是1mol,由于白磷是正四面体结构,含有6个P-P键,因此其中所含P—P键数目为6N A,A错误;B.铁离子在溶液中水解,所以100 mL 1mol·L−1FeCl3溶液中所含Fe3+的数目小于0.1N A,B错误;C.甲烷和乙烯分子均含有4个氢原子,标准状况下,11.2 L 甲烷和乙烯混合物的物质的量是0.5mol ,其中含氢原子数目为2N A ,C 正确;D .反应2SO 2+O 22SO 3是可逆反应,因此密闭容器中,2 mol SO 2和1 mol O 2催化反应后分子总数大于2N A ,D 错误。
阿伏加德罗常数-2024年高考化学一轮复习基础考点必刷好题(新教材新高考)(解析版)
专题03阿伏加德罗常数(建议完成时间:45分钟实际完成时间:_______分钟)目录考点一“V m =22.4L ·mol -1”及N A 的计算考点二物质的组成与结构及N A 的计算考点三氧化还原反应及N A 的计算考点四可逆反应及N A 的计算考点五电解质溶液中粒子数目及N A 的计算考点一“Vm =22.4L ·mol -1”及N A 的计算1(2023·陕西西安·统考一模)N A 为阿伏加德罗常数的值,下列说法正确的是A.1LpH =4的0.1mol •L -1K 2Cr 2O 7溶液中Cr 2O 2-7离子数为0.1N AB.标准状况下,11.2LNH 3与11.2LHF 均含有5N A 个质子C.4.6g 甲苯和甘油的混合物中含有氢原子数目为0.4N AD.用惰性电极电解CuSO 4溶液,阴极增重6.4g ,外电路中通过电子的数目一定为0.20N A【答案】C【解析】A .重铬酸钾发生水解,反应的离子方程式为H 2O +Cr 2O 2-7⇌2CrO 2-4+2H +,1L 0.1mol/LK 2Cr 2O 7溶液中Cr 2O 2-7的数目小于0.1N A ,A 错误;B .标准状况下HF 为无色液体,故无法计算11.2LHF 含有的质子数目,B 错误;C .甲苯即C 7H 8和甘油即C 3H 8O 3,二者相对分子质量均为92,故4.6g 二者的混合物中含有氢原子数目为 4.6g 92g •mol-1×8×N A mol -1=0.4N A ,C 正确;D .用惰性电极电解CuSO 4溶液,Cu 2+首先在阴极放电,当Cu 2+放电完全后,溶液中的氢离子还可能会放电,故当阴极增重6.4g 时,外电路中通过电子的数目可能为0.20N A ,也可能大于0.20N A ,D 错误;故答案为:C 。
2(2023·河北衡水·衡水市第二中学校考三模)N A 为阿伏加德罗常数的值.下列说法正确的是A.1.8gH 218O 中含有的中子数为N AB.3.9gNa 2O 2与水完全反应时转移的电子数为0.05N AC.0.1mol ⋅L -1AlCl 3溶液中Al 3+数目小于0.1N AD.2.8L 由甲烷和乙烯组成的混合气体中所含碳氢键数为0.5N A【答案】B【解析】A .1个H 218O 分子中含有10个中子,1.8gH 218O 中含有的中子数为0.9N A ,A 错误;B .3.9gNa 2O 2的物质的量是0.05mol ,与水完全反应时Na 2O 2既作氧化剂又作还原剂,转移的电子数为0.05N A ,B 正确;C .溶液体积未知,不能计算Al 3+数目,C 错误;D .温度和压强不确定,无法计算2.8L 甲烷和乙烯的物质的量,D 错误;故选B 。
高考化学 题型揭秘(第01期)专题02 阿伏加德罗常数(含解析)
专题02 阿伏加德罗常数(第01期)1.N A为阿伏伽德罗常数.下列说法正确的是()A.1 mol FeCl3完全水解生成的 Fe(OH)3胶粒数为 N AB.将 1mol Cl2完全通入水中,HClO、Cl-、ClO -粒子数之和为 2N AC.12g石墨中含有3N A个C﹣C共价键D.10℃时,1L pH=1.0 的 H2SO4溶液中含 H+为 0.1N A【答案】D2.设N A为阿伏加德罗常数的值,下列叙述正确的是A.标准状况下,22.4 L SO3与水反应生成1 mol硫酸B.1 L 1mol/L醋酸溶液中离子总数为2 N AC.78 g苯中含有的碳碳双键的数目为3 N AD.1 mol N2与3 mol H2在一定条件下充分反应生成的NH3分子数小于2 N A【答案】D【解析】A.标准状况下,SO3为固体,不可根据气体摩尔体积计算其物质的量,故A错误;B.醋酸是弱酸不可能完全电离,故B错误;C.苯中无碳碳双键,故C错误;D.合成氨是可逆反应,反应物的限度不可能达到100%,则1 mol N2与3 mol H2在一定条件下充分反应生成的NH3分子数小于2 N A,故D正确;答案为D。
3.设N A为阿伏加德罗常数的值,下列说法正确的是A.100g 98%的浓硫酸中含有的氢原子数目为2N AB.常温下,2.7gAl与足量浓度为18mo1/L的浓硫酸反应时,转移的电子数为0.3N AC.标准状况下,22.4L的CCl4含有的CCl4分子数大于N AD.1 mol苯完全转化为环己烷,参与反应的碳碳双键数为3N A【答案】C4.设N A为阿伏加德罗常数的值。
下列说法不正确的是A.常温常压下,35.5g的氯气与足量的氢氧化钙溶液完全反应,转移的电子数为0.5N AB.60g甲酸甲酯和葡萄糖的混合物含有的碳原子数目为2N AC.标准状况下,2.24L PH3与3.4gH2S气体分子所含电子数目均为1.8N AD.已知合成氨反应N2(g)+3H2(g) 2NH3(g) △H= -92.4kJ/mol当该反应生成N A个NH3分子时,反应放出的热量小于46.2kJ【答案】D【解析】A项,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,35.5 g氯气是1 mol,1 mol氯气参加反应转移0.5mol 电子,故A正确;B项,甲酸甲酯的分子式为:C2H4O2,葡萄糖的分子式为:C6H12O6,二者最简式都是CH2O,60g混合物含有的碳原子数目为:60g÷30g/mol×N A=2N A,故B正确;C项,标准状况下,2.24L PH3是0.1mol,所含电子数为:0.1×(15+1×3)N A=1.8N A,3.4 gH2S是1 mol,所含电子数为:0.1×(1×2+16)N A=1.8N A,故C正确;D项,由热化学方式可知,1 molN2与3 molH2完全反应生成2 molNH3,放出92.4kJ 热量,所以生成N A个NH3分子(1 mol)时,反应放出的热量等于46.2kJ,故D错误。
高三化学阿伏伽德罗定律试题答案及解析
高三化学阿伏伽德罗定律试题答案及解析1.若一氧化碳和二氧化碳的混合气体的密度与同温同压下氧气的密度相同,则混合气体中一氧化碳和二氧化碳的物质的量之比是A.1∶3B.3∶1C.2∶1D.1∶2【答案】B【解析】CO相对分子质量是28,CO2是44,O2是32,若一氧化碳和二氧化碳的混合气体的密度与同温同压下氧气的密度相同,则气体的平均相对分子是32.假设混合气体中一氧化碳和二氧化碳的物质的量分别是x、y.则(28x+44y)÷(x+y)=32,,解得x:y=3:1,因此选项是B。
【考点】考查混合气体的物质的量与气体的密度的关系的知识。
2.设为阿伏加德罗常数的数值,下列说法正确的是A.1 mol CH5+所含电子数为8nAB.标准状况下,11.2L Br2中Br原子数为nAC.1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NAD.18 g的D216O中含有的中子数为9 NA【答案】D【解析】A. 1 mol CH5+所含电子数为10nA,错误;B.溴为液体,不适用于摩尔体积,错误;C.1mol/L的Al2(SO4)3溶液,未说明体积,所以不能得出Al3+的数目小于2NA,错误;D.18g÷20g/mol×10NA=9NA,正确。
【考点】带电粒子电子数的计算;气体摩尔体积的适用范围;有关物质的量浓度的计算;中子数的计量。
3.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )A.1 mol Na2O2中含有的阴离子数为0.2NAB.标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NAC.常温常压下,8gO3含有4 NA个电子D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA【答案】C【解析】 1 mol Na2O2中含有的阴离子数为0.1NA,A错误;H2O2制得2.24LO2转移电子数为0.2 NA ,B错误;8gO3的中O原子的物质的量为0.5mol,所以含有的电子数为4 NA个,C正确;pH=2的H2SO4溶液c(H+)=0.01mol/L,所以1L的溶液中含有H+数目为0.02NA,D错误;故选C。
高中化学阿伏伽德罗常数测试题(含答案)
高中化学阿伏伽德罗常数测试题(共15小题)1.用NA表示阿伏加德罗常数的值,下列说法正确的是()A.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NAB.1 mol乙烷分子含有8 NA个共价键C.58.5 g氯化钠固体中含有NA个氯化钠分子D.在1 L 0.1 mol/L碳酸钠溶液中阴离总数大于0.1 NA 2.用N A表示阿伏加德罗常数的值,下列说法不正确的是()A.分子总数为NA 的NO2和CO2混合气体中含有的氧原子数为2NAB.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2N AC.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 N A D.常温常压下,22.4L氯气与足量镁粉充分反应,转移电子数为2 N A 3.用NA表示阿伏加德罗常数的值,下列说法正确的是()A.标准状况下,5.6L四氯化碳含有的分子数为0.25 NAB.标准状况下,14g氮气含有的核外电子数为5 NAC.标准状况下,22.4 L任意比的H2和Cl2混合气体中含有的分子总数为NAD.标准状况下,铝跟NaOH溶液反应生成1 mol氢气时,转移的电子数为NA 4.用NA表示阿伏加德罗常数的值,下列说法不正确的是()A.18 g H2O中含有的质子数为10 N AB.12 g金刚石中含有的共价键数为4 NAC.46 g NO2和N2O4混合气体含有的原子总数为6 NAD. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去N A个电子5.设N A为阿伏加德罗常数的值,下列说法正确的是()A. 1 mol硫酸钾中阴离子所带电荷数为NAB.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移电子数为NAD.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+6. NA为阿伏加德罗常数的值,下列说法正确的是()A.标准状况下,2.24L H2O含有的分子数等于0.1NAB.常温下,100 mL 1 mol/L Na2CO3溶液中阴离子总数大于0.1 NAC.分子数为NA 的CO、C2H4混合气体体积约为22.4L,质量为28 gD. 3.4 g NH3中含N-H键的数目为0.2NA7 . 设n A为阿伏加德罗常数的值,下列说法正确的是()A.常温下,4 g CH4含有nA个C-H共价键B. 1 mol Fe与足量的稀HNO3反应,转移2n A个电子C. 1 L 0.1 mol/L NaHCO3溶液中含有0.1 n A个HCO3-D.常温常压下,22.4 L的NO2和CO2混合气体含有2n A个O原子8. 设N A为阿伏加德罗常数的值,下列说法正确的是()A. 标准状况下,33.6 L氟化氢中含有氟离子的数目为1.5 NAB. 常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NAC.50 mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子数为0.46 NAD.某密闭容器盛有0.1 molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA9. 设N A为阿伏加德罗常数的值,下列说法正确的是()A. 1.00 molNaCl中含有NA个NaCl分子B. 1.00 molNaCl中,所有Na+的最外层电子数为8NAC. 欲配制1.00 L 1.00 mol/L的NaCl溶液,可将58.5 gNaCl溶于1.00 L水中D. 电解58.5 g熔融的NaCl,能产生22.4 LCl2, 23.0 g金属钠10.设NA为阿伏伽德罗常数,下列叙述正确的是()A.24g镁的原子最外层电子数为NAB.1L0.1mol·L-1乙酸溶液中H+数为0.1NAC.1mol甲烷分子所含质子数为10NAD.标准状况下,22.4L乙醇的分子数为NA11.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NAB.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NAC.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA12.下列叙述中指定粒子的数目等于阿伏加德罗常数的是()A.KMnO4分解生成1mol O2转移的电子数B.0.1mol F-中含有质子数C.46g NO2中的氧原子数D.1L 0.5mol/L1 Na2SO4溶液中的Na+离子数13.设NA为阿伏伽德罗常数,下列说法正确的是( )A.标准状况下,含1molHCl和氢氟酸的混合物的体积约为22.4 L B.电解精炼铜时,当转移1mol电子时,阳极材料质量减轻了32gC.1.72g生石膏(CaSO4·2H2O)转化为熟石膏(2CaSO4·2H2O)失去的结晶水数目为0.015NAD.9g重水含有的电子数为5NA14.设NA为阿伏伽德罗常数,下列说法正确的是( )A.28g铁在硫蒸气气中完全反应失去电子数为1.5NAB.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NAC.标准状况下,11.2 L的SO3所含分子数为0.5NAD.8g硫在氧气中完全燃烧生成的气体产物含原子数为NA15. 设NA为阿伏伽德罗常数,下列说法正确的是()A.已知异丁烷比正丁烷稳定,则正丁烷转化为异丁烷的过程为吸热过程B.标准状况下,22.4L NO与11.2L O2混合所得气体的分子数一定小于NAC.3.2g Cu在硫蒸气中完全燃烧,转移的电子数为0.1NAD.1molP4与1molSiO2晶体中所含有的共价键数目都为4NA参考答案:1-5:D D C B C, 6-10:B A B B C,11-15: C D C B B。
