2014-2015学年一学期无机化学期中考试试卷(B卷)
无机期中卷参考答案

无机化学期中考试参考答案一、单项选择题(共15分)二、真空题(每空1分,共20分)16. 阳离子电荷与其半径之比,阳离子的极化能力, BeCl 2 > CaCl 2 > HgCl 2,BaCO 3 > SrCO 3 > CaCO 3 > MgCO 3 > BeCO 317. <18. [Fe(CN)5CO]3-; [PtCl 2(OH)2(NH 3)2]; [CrBr 2(H 2O)4]Br ·2H 2O19. 62g t 0g e ; 32g t 2g e20.PF 3<PCl 3<PBr 3<PI 321.(σ 1s )2 (σ *1s )2 (σ 2s )2 (σ *2s )2 (π 2py )2 (π 2pz )2 (σ 2px )2 3 反磁性 CO (N 2) 22.重铬酸根有氧化性,氨离子有还原性23. 阴离子半径较大时,其盐的溶解度常随阳离子的半径增大而减小 24. 6:6, 8:8, 4:4 三、简答题25. 酸性顺序: HClO <HClO 3<HClO 4。
氧化性顺序: HClO >HClO 3>HClO 4。
原因:①三分子中非羟氧依次增多,诱导效应增大;②酸根结构的影响。
酸根结构的稳定性依次增强,ClO 4-是四面体结构,最为稳定。
26.27.四、计算题与判断(共30分)28. 解:① 因 Cu + + e - == Cu φ(Cu + /Cu)= 0.521VΔr G = - n F φ F = 96.5 kJ·V -1·mol -1 G 终 — r G 始 = - n F φ G = n F φ + G = 1×96.5×0.521 = 50.28 kJ·mol -1 ② 因Cu 的G 最低,所以最稳定;③ 因CuO + 的G 最高,所以氧化性最强;④ 因Cu + 位于Cu 和Cu 2+ 连线的上方,所以Cu + 会发生歧化反应2Cu + == Cu + Cu 2+29.30.ϕ([Co(CN)6]3-/[Co(CN)6]4-) =ϕ(Co 3+/Co 2+) - 0.0591 lg)])Co(CN ([)])Co(CN ([466−稳稳K K= 1.808 - 0.0591 lg 1964100.1100.1⨯⨯= -0.852 V按 ϕ值,H 2O 可氧化[Co(CN)6]4-2[Co(CN)6]4- + 2H 2O 2[Co(CN)6]3- + 2OH − + H 2↑lg K = 0591.0)]852.0(829.0[2−−−= 0.778 K = 6.0所以[Co(CN)6]4-在水溶液中不稳定。
《无机化学》期终考试试卷

《无机化学》期终考试试卷一、判断题(每小题1分,共15分)1、只要能向两个相反方向进行的反应都是可逆反应。
()都是一个常数。
()2、在一定温度下,任何电解质的稀溶液中Kw3、在缓冲溶液中即使加入大量的酸或碱,溶液的pH也改变很小。
()4、升高温度会促进盐的水解。
()5、将1×10-6 mol·L-1的HCl冲稀1000倍后,溶液中的C(H+)=1×10-9 mol·L-1。
()6、所谓某物质的浓度通常是指某物质的物质的量浓度。
()7、AgI是难溶物,所以在AgI溶液里没有Ag+和I- 。
()8、原电池中正极发生还原反应,负极发生氧化反应。
()9、某盐溶液的pH=7,则该盐一定为强酸强碱盐。
()10、使甲基橙显黄色的溶液一定是碱性的。
()11、某离子被沉淀完全是指在溶液中其浓度为0。
()12、可用SO3与水作用制得硫酸。
()13、KCl是离子晶体。
()14、常温下所有金属都是固态的。
()15、氯化钠分散在苯中,可形成颗粒直径在1-100nm范围内的分子聚集体,该体系属于溶胶。
()二、选择题(每小题2分,共50分)16、室温下,铝片不能从下列物质中置换出氢气的是()A、HCl 溶液B、NaOHC、稀H2SO4D、H2O17、摩尔气体常数的数值等于()A、8.214B、8.314C、7.214D、7.31418、影响化学反应速率的主要因素是()A、反应物的本性B、反应物的浓度C、反应温度D、是否使用催化剂19、在850℃时,CaCO3(s) CaO(s)+CO2(g)反应的Kp=0.50,下列情况不能达到平衡的是()A、有CaO和CO2(P(CO2)=100kPa)B、有CaCO3和CaOC、有CaO和CO2(P(CO2)=10kPa)D、有CaCO3和CO2(P(CO2)=10kPa)20、已知一种H+离子浓度为1×10-3mol·L-1的酸和一种OH-浓度为1×10-3mol·L-1的碱溶液等体积混合后溶液呈酸性,其原因可能是()A、强酸与浓度为其一半的二元强碱溶液反应B、浓的弱酸和稀的强碱溶液反应C、等浓度的强酸和弱碱溶液反应D、生成了一种强酸的弱碱盐21、向1L 0.1mol·L-1的氨水中加入一些NH4Cl晶体,会使()A、氨水的离解常数增大B、氨水的离解常数的减小C、溶液的pH增大D、溶液的pH减小22、下列各组溶液都以等体积混合,构成缓冲溶液的是()A、0.100mol·L-1 HCl与0.200mol·L-1 NaAc溶液B、0.200mol·L-1 HCl与0.100mol·L-1 NaAc溶液C、0.100mol·L-1 HCl与0.050mol·L-1 NaNO2溶液D、0.200mol·L-1 HCl与0.100mol·L-1 NaOH溶液23、盛Ba(OH)2溶液的瓶子在空气中放置一段时间后,其内壁会被蒙上一层白层薄膜,欲将其从瓶壁洗去应该用()A、H2OB、稀HClC、稀H2SO4D、浓NaOH24、配制SnCl2溶液时,必然加入()A、足够量的水B、盐酸C、碱溶液D、氯气25、下列各组一元酸,酸性强弱顺序正确的是()A、HClO>HClO3>HClO4B、HClO>HClO4>HClO3C、HClO4>HClO>HClO3D、HClO4>HClO3>HClO26、在反应4NH3(g)+5O2(g)→4NO(g)+6H2O(g)的平衡体系中加入惰性气体以增加体系的压强,这时()A、NO平衡浓度增加B、NO平衡浓度减少C、加快正向反应速度D、平衡时,NH3和NO的量没有变化27、催化剂能加速反应速率,它的作用机理是( )A、增大碰撞频率B、改变反应途径,减低活化能C、减小速率常数D、增大平衡常数数值28、电解质破坏胶体的主要原因()A、使布朗运动减慢B、破坏水化膜C、中和胶粒电荷D、发生沉淀反应29、不属于物质常见聚集状态的是()A、气体B、等离子体C、固体D、液体30、在1L的Mg(OH)2饱和溶液中,加入MgCl2固体,溶液pH值的变化趋势是()A、减小B、增大C、不变D、不确定31、目前对人类环境造成危害的酸雨主要是由下列哪种气体污染造成的()A、CO2B、H2SC、SO2D、CO32、已知φθ(Fe3+/Fe2+)=0.77V, φθ(Cu2+/ Cu)=0.34V,φθ(Sn4+/ Sn2+)=0.15V, φθ(Fe2+ /Fe)=-0.41V,在标准状态时,下列反应能正向进行的是()A、Sn4+ + Cu=Sn2+ + Cu2+B、2Fe3+ + Cu=2 Fe2+ + Cu2+C、Cu+ Fe2+ = Cu2+ + FeD、Cu2+ + 2 Fe2+=2Fe3++ Cu33、共价键最可能存在于()A金属原子之间B非金属原子之间C金属原子与非金属原子之间D电负性相差很大的元素的原子之间34、温室气体主要是指下列哪种气体()A、CO2B、H2SC、SO2D、CO35、下列物质中,有固定沸点的是()A 、汽水B、水C、王水D、氯水36、HPO42-的共轭碱是()A、H2PO4-B、H3PO4C、PO43-D、HPO42-37、等浓度等体积的NaOH溶液和HAc溶液混合后,混合溶液中有关离子浓度间的关系正确的是()A 、C(Na+) ﹥C(Ac-)﹥C(OH-)﹥C(H+)B、C(Na+) ﹥C(Ac-)﹥C(H+)﹥C(OH-)C、C(Na+) ﹥C(H+)﹥C(Ac-)﹥C(OH-)D、C(Na+) ﹥C(OH-)﹥C(Ac-)﹥C(H+)38、影响化学反应速率的主要因素是()A、反应物的本性B、反应物的浓度C、反应温度D、是否使用催化剂39、摩尔是表示()A、物质的量的单位B、摩尔质量的单位C、物质浓度的单位D、物质微粒的单位40、下列物质不具有消毒,漂白作用的是()A、Ca(ClO)2B、Cl2和水C、Cl2(g)D、Ca(ClO)2和CaCl2三、填空题(每题3分,共15分)41、对于可逆反应N2+3H2NH3,某一瞬间以N2表示的化学反应速率v(N2)=0.5 mol·L-1,则v(H2)= mol·L-1,v(NH3)= mol·L-1。
14—15学年下学期高一期中考试化学试题(附答案)

2014-2015学年度第二学期期中联考高一化学试题2015.05相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32选择题(共40分)单项选择题(本题包括15小题,每题2分,共30分。
每小题只有一个选项符合题意)1.科学家发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。
下列有关这两种粒子的说法不.正确..的是A.“四中子”不显电性B.“四中子”的质量数为4,其质量比氢原子大C.“零号元素”在元素周期表中与氢元素占同一位置D.第二种粒子的化学式为O4,与O2互为同素异形体2.下列化学用语表示正确的是A.乙烯的结构简式:CH2CH2 B.甲烷的比例模型:C.硫化钾的电子式:D.CO2的结构式:O—C—O3.由长周期元素和短周期元素共同构成的族是①0族②主族③副族④第Ⅷ族A.①②B.①③C.②③D.③④4.下列物质中,属于共价化合物的是A.NH4Cl B.SO2C.Cl2D.Na2SO45.下列选项描述的过程能实现化学能转化为热能的是A.光合作用B.烧炭取暖C.风力发电D.电解冶炼6.元素周期表是学习化学的重要工具。
下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是A.该元素的原子序数为6B.该元素所有原子的质子数均为6C.该元素的相对原子质量为12.01D.该元素没有同位素,所有原子的中子数均为67.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成的化学式最可能表示为A.B3A2B.BA2C.A3B2D.AB28.绿色能源是指使用不会对环境造成污染的能源。
下列属于绿色能源的是①太阳能②风能③潮汐能④煤⑤天然气⑥石油A.①②③B.③④C.④D.①②⑥9.设N A为阿伏加德罗常数,下列说法中错误的是A.在标准状况下,22.4 LSO3所含的硫原子数目为N AB.常温常压下,7.8g过氧化钠含有的离子数为0.3N AC.18 g 水所含的电子数目为10 N AD.3.2g O2、O3混合物中所含氧原子一定是0.2N A10.下列做法,不能..使CaCO3+2HCl〓CaCl2+CO2↑+H2O的反应速率增大的是A.增大盐酸的浓度B.碾碎碳酸钙C.适当加热D.把盐酸换成同浓度硫酸11.近年来科学家发现铝的超原子结构Al13和Al14,Al13和Al14的性质与元素周期表中某些主族元素的性质相似,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定的Al13-、Al142+。
高二化学期中考试题2014--2015第一学期

2014—2015学年度第一学期期中考试化学试题一.选择题(每小题只有一个正确答案,每小题3分,共60分)1.关于吸热反应的说法正确的是()。
A.凡需加热的反应一定是吸热反应B.只有分解反应才是吸热反应C.使用催化剂的反应是吸热反应D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应2.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()。
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-4b kJ·mol-1B.C2H2(g)+5/2O2(g)===2CO2(g)+H2O(l)ΔH=2b kJ·mol-1C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-2b kJ·mol-1D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=b kJ·mol-13.已知299 K时,合成氨反应N2(g)+3H2(g)2NH3(g)ΔH=-92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)()。
A.一定等于92.0 kJ B.一定小于92.0 kJC.一定大于92.0 kJ D.不能确定4.(海南高考)已知:2Zn(s)+O2(g)===2ZnO(s) ΔH1=-701.0 kJ·mol-12Hg(l)+O2(g)===2HgO(s) ΔH2=-181.6 kJ·mol-1则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为:( )A.+519.4 k J·mol-1B.+259.7 kJ·mol-1C.-259.7 kJ·mol-1D.-519.4 kJ·mol-15.从如图所示的某气体反应的能量变化分析,以下判断错误的是( )A.这是一个放热反应B.该反应可能需要加热C.生成物的总能量低于反应物的总能量D.反应物比生成物更稳定6.已知热化学方程式2H2(g)+O2(g)===2H2O(l)ΔH1=-571.6 kJ/mol,则关于热化学方程式2H2O(l)===2H2(g)+O2(g) ΔH2=?的说法正确的是( )A.热化学方程式中化学计量数表示分子数B.该反应ΔH2大于零C.该反应ΔH2=-571.6 kJ/mol D.该反应与上述反应属于可逆反应7.(南昌模拟)对于反应:2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( ) A.通入大量O2B.增大容器容积C.移去部分SO3D.降低体系温度8.(湖南十二校联考)使反应:4NH3(g)+3O2(g)===2N2(g)+6H2O(g)在2 L的密闭容器中进行,半分钟后N2的物质的量增加了0.6 mol。
2014-2015学年一学期无机化学期中考试试卷(B卷)
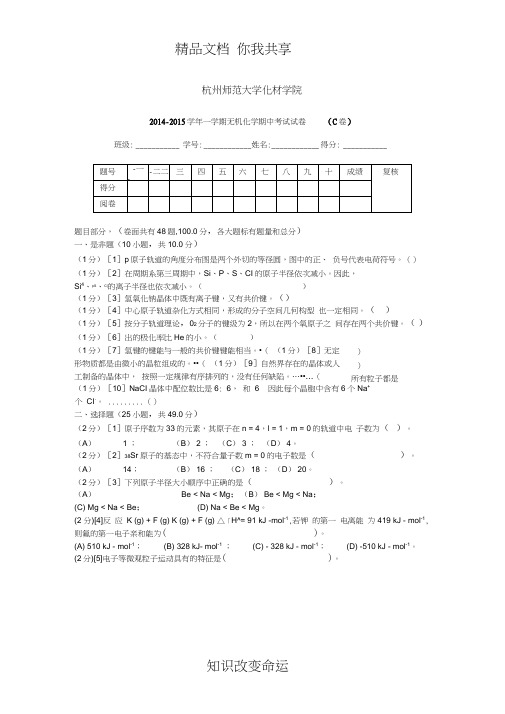
杭州师范大学化材学院2014-2015学年一学期无机化学期中考试试卷(C 卷)班级: ___________ 学号: ____________ 姓名:____________ 得分: ___________题目部分,(卷面共有48题,100.0分,各大题标有题量和总分) 一、是非题(10小题,共10.0分)(1分)[1]p 原子轨道的角度分布图是两个外切的等径圆,图中的正、 负号代表电荷符号。
() (1分)[2]在周期系第三周期中,Si 、P 、S 、CI 的原子半径依次减小。
因此, Si 4、pS 、C|的离子半径也依次减小。
()(1分)[3]氢氧化钠晶体中既有离子键,又有共价键。
()(1分)[4]中心原子轨道杂化方式相同,形成的分子空间几何构型 也一定相同。
( )(1分)[5]按分子轨道理论,02分子的键级为2,所以在两个氧原子之 间存在两个共价键。
( ) (1分)[6]出的极化率比He 的小。
()(1分)[7]氢键的键能与一般的共价键键能相当。
•( (1分)[8]无定形物质都是由微小的晶粒组成的。
••( (1分)[9]自然界存在的晶体或人工制备的晶体中, 按照一定规律有序排列的,没有任何缺陷。
…••…(二、选择题(25小题,共49.0分)(2分)[1]原子序数为33的元素,其原子在n = 4,l = 1,m = 0的轨道中电 子数为( )。
(A ) 1 ; (B ) 2 ; (C ) 3 ; (D ) 4。
(2分)[2]38Sr 原子的基态中,不符合量子数m = 0的电子数是()。
(A ) 14;(B ) 16 ;(C ) 18 ; (D ) 20。
(2分)[3]下列原子半径大小顺序中正确的是()。
(A )Be < Na < Mg ; (B ) Be < Mg < Na ;(C) Mg < Na < Be ; (D) Na < Be < Mg 。
无机化学试卷及答案

☆☆ 密 封 线 内不要 答题 ☆ ☆《无机化学》试题(B 卷)(答案)本套试卷共 3 页一、判断是非题(每小题2分,共20分)1、同一温度下,溶液的蒸气压大于水的蒸气压。
( × )2、配位化合物在水中的溶解度很低。
( × )3、原子通过化学键结合成分子,所以化学键是分子中相邻原子间较强烈的结合力。
( √ )4、 光子的运动具有波粒二象性,同样原子核外电子的运动具有波粒二象性。
( √ )5、电负性越大的元素氧化性越强。
( √ )6、在同一温度下,某一化学反应的焓变等于其等容反应热。
( × )7、最稳定相态单质的焓值等于零( √ )8、催化剂可以增加活化能,提高反应速率。
( × )9、甲物体的温度比乙物体高,表明甲物体的热力学能比乙物体大。
( × ) 10、同一温度下,平衡常数随反应物浓度的不同而不同。
( × )二、选择题(每小题2分,共计20分)1、 在0oC 时,烧杯中盛有水,上面浮着冰块,保持温度不变,加入少量NaCl 并使其全部溶解,再加入AgNO 3 溶液,此时烧杯中共有( B )相。
A. 1; B 2; C 3; D 4;2、 一定温度下,已知某反应ΔG θ>0,则该反应的平衡常数K θ( C )A.> 0B.< 0C.< 1D.> 13、已知E◎(I2/I-) =;E◎(Br2/Br-) =;在标准状态下,比较I2和Br2氧化性强弱。
( B ) A. I2比Br2强;B. Br2比I2强;C. 一样强;D. 不能确定;4、下列含氢化合物中,不含有氢键的(C)A. CH4;2;C. H3BO3; D. HF ;5、第二十五号元素Mn(25)属于第(C)副族元素。
A. 2 ;B. 5 ;C. 7 ;D. 3 ;6、常温33-溶液中加入一些NaAC晶体并使之溶解,则发生的变化是(D)A. HAC的Kaθ增大;B. HAC的Kaθ减小;C. HAC解离度增大;D. HAC解离度减小;7、在盛有稀盐酸的开口玻璃烧杯中,加入锌粒进行反应生成氢气,问此化学反应系统是:( C )A. 封闭系统;B. 孤立系统;C. 敞开系统;D. 氧化还原系统;8、量子力学中,原子轨道的同义词是(B)A. 电子运动的轨迹;B.波函数;C.原子运动轨道;D.电子云;☆☆密封线内不要答题☆☆9、在下列电池反应中,Ni(s)+Cu+2(aq)=Ni+2·dm3-)+Cu(s);当该原电池的电动势为零时,Cu2+的浓度为(B)A.×1027- mol·dm3-; B.×1021-mol·dm3-;C.×1014- mol·dm3-; D.×1011-mol·dm3-;10、已知下列各电对的标准电极电势:E(Fe3+/Fe2+)=+ ;E(Cu2+/Cu)=+;E(Mg2+/Mg)= ;E(Cl2/Cl-)=+;则在标准条件下,最强的还原剂是( C )+ -三、完成下表:(每个元素2分,共10 分)四、简要回答下列问题(每小题4分,共20 分)1、简述CH4的分子结构:答:CH4中的C原子进行sp3杂化,形成4个等性sp3杂化轨道,每个sp3轨道中的单电子与4个氢原子中的1s电子形成4个等长共价键,故CH4空间构型是四面体。
无机化学期中考试试题

无机化学期中测试题一.选择题(以下四个选项只有一个是正确的,请选出正确答案,每小题2分,共20分)1.根据元素的核电荷数,不能..确定的是 ( ) A .原子核内质子数 B .原子核中子数C .核外的价电子数D .原子的电子数2.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为( )A .57B .47C .61D .2933.下列关于188O 的叙述中,错误的是A .质子数为8B .中子数为8C .电子数为8D .质量数为184. 下列属于同位素的一组是 ( )A .O 2、O 3B .Na 2O 、Na 2O 2C .1940K 、2040CaD .氕、氘、氚5.下列物质中, 不存在化学键的是( )A .水B .食盐C .氯气D . 氦气6.下列物质中, 既含离子键、又含共价键的是A .NaOHB .Na 2OC .NH 4ClD .CaCl 27.根据元素在周期表中的位置判断,下列元素中原子半径最小的是A .氧B .氟C .碳D . 氮8.下列物质中,含有离子键的是A .N2B .CO2C .NaOHD .CH49.提出元素周期律并绘制了第一个元素周期表的科学家是A.戴维B.阿伏加德罗C.门捷列夫 D.道尔顿10.下列的氢氧化物中,碱性最强..的是 ( ) A. LiOH B. NaOH C. KOH D.RbOH二.填空题(25×2分,共50分)1.核电荷数=________________=__________________2. 质量数=______________+_______________3. 原子是由____________和______________构成的。
4 .能量低的电子通常在离核_______(填远或者近)的区域运动,能量高的电子通常在离核_______(填远或者近)的区域运动5 .不同元素的核电荷数不同,把元素按核电荷数由小到大的顺序排列起来所编的序号叫做该元素的_ _ _ _ _6. 含有配位键的一个典型例子是_ _ _ _ _ _,举两个含有氢键的分子的例子_ _ _ _ _和_ _ _ _ _ _。
2014级 化学专业《无机化学》试题

(2) KF熔点880℃,属________晶体,微粒之间的作用力为
_____________________________________。
(3) Si熔点1423℃,属________晶体,微粒之间的作用力为________。
(6分)
3. 画出O2的Lewis结构成键图(大π键,σ键)(2分)
子在n = 1 轨道上能量之比值为……………………………………………
()
(A) 3:1
(B) 6:1 (C) 9:1 (D) 1:3
3. 常温常压下, 偏离理想气体行为最多的气体是…………………… ( )
(A) CO (B) CO2 (C) N2
(D) NH3
4. 下列说法中正确的是…………………………………………………(
解:
3、应用价层电子对互斥理论,画出下列化合物的空间构型(标出孤电子 对的位置) (12 分)
(1) ; (2) ; (3) ; (4) PCl3
得分
体、固体钠 >
二、填空和判断题(本题共10小题,共26分) 1、 按熔点大小顺序排列 干冰、金刚石、NaCl晶
> > 。 (2分)
2、(1)
BBr3熔点-46℃,属________晶体,微粒之间的作用力为
__________________________________________________。
10. 下列物质熔点变化顺序中,不正确的是………………………………
()
(A) NaF > NaCl > NaBr > NaI (B) NaCl < MgCl2 < AlCl3 < SiCl4 (C) LiF > NaCl > KBr > CsI (D) Al2O3 > MgO > CaO > BaO
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
杭州师范大学化材学院2014-2015学年一学期无机化学期中考试试卷(C卷)班级:___________学号:___________姓名:___________得分:___________题目部分,(卷面共有48题,100.0分,各大题标有题量和总分)一、是非题(10小题,共10.0分)(1分)[1]p原子轨道的角度分布图是两个外切的等径圆,图中的正、负号代表电荷符号。
()(1分)[2] 在周期系第三周期中,Si、P、S、Cl 的原子半径依次减小。
因此,Si4-、P3-、S2-、Cl-的离子半径也依次减小。
( )(1分)[3] 氢氧化钠晶体中既有离子键,又有共价键。
( )(1分)[4] 中心原子轨道杂化方式相同,形成的分子空间几何构型也一定相同。
( )(1分)[5] 按分子轨道理论,O2分子的键级为2,所以在两个氧原子之间存在两个共价键。
( )(1分)[6]H2的极化率比He 的小。
( )(1分)[7] 氢键的键能与一般的共价键键能相当。
.()(1分)[8] 无定形物质都是由微小的晶粒组成的。
..()(1分)[9] 自然界存在的晶体或人工制备的晶体中,所有粒子都是按照一定规律有序排列的,没有任何缺陷。
........()(1分)[10]NaCl 晶体中配位数比是6:6,因此每个晶胞中含有6 个Na+和6 个Cl-。
........()二、选择题(25小题,共49.0分)(2分)[1] 原子序数为33 的元素,其原子在n = 4,l = 1,m = 0 的轨道中电子数为( )。
(A) 1 ;(B) 2 ;(C) 3 ;(D) 4。
(2分)[2]38Sr 原子的基态中,不符合量子数m = 0 的电子数是( )。
(A) 14;(B) 16 ;(C) 18 ;(D) 20 。
(2分)[3] 下列原子半径大小顺序中正确的是( )。
(A) Be < Na < Mg;(B) Be < Mg < Na;(C) Mg < Na < Be;(D) Na < Be < Mg。
(2分)[4] 反应K (g) + F (g) →K+ (g) + F- (g) △r H= 91 kJ·mol-1,若钾的第一电离能为419 kJ·mol-1,则氟的第一电子亲和能为( )。
(A) 510 kJ·mol-1;(B) 328 kJ·mol-1;(C) - 328 kJ·mol-1;(D) -510 kJ·mol-1。
(2分)[5] 电子等微观粒子运动具有的特征是( )。
(A) 穿透性;(B) 屏蔽性;(C) 只有波动性;(D) 波、粒二象性。
(2分)[6] 下列化合物中,既存在离子键和共价键,又存在配位键的是( )。
(A) H3PO4;(B) BaCl2;(C) NH4F;(D) NaOH。
(2分)[7] 下列分子中不呈直线形的是( )。
(A) HgCl2;(B) CO2;(C) H2O;(D) CS2。
(2分)[8]AB m型分子中,A 原子采取sp3d2杂化,m = 4,则AB m分子的空间几何构型是( )。
(A) 平面正方形;(B) 四面体;(C) 八面体;(D) 四方锥。
(2分)[9] 对于一个反键分子轨道,下列叙述中正确的是( )。
(A) 它不能有电子占有;(B) 它的能级比所在分子中所有成键分子轨道的能级都高;(C) 它的能级比相应的原子轨道能级高;(D) 有电子进入反键轨道就不能形成有一定稳定性的分子。
(2分)[10] 按照分子轨道理论,N2+中电子占有的能量最高的轨道是( )。
(A) σ2p;(B) σ2p*;(C) π2p;(D) π2p*。
(2分)[11]F2的分子轨道排布式正确的是( )。
(A) KK (σ2s )2 (σ2s*)2 (σ2p)2 (π2p )4 (π2p* )4;(B) KK (σ2s )2 (σ2s*)2 (π2p)4 (σ2p)2 (π2p* )4;(C) KK (σ2s )2 (σ2s*)2 (σ2p)2 (π2p)4 (σ2p*)2 (π2p*)2;(D) KK (σ2s )2 (σ2s*)2 (σ2p)2 (π2p)4 (π2p*)2 (σ2p*)2。
(2分)[12] 下列化合物中,含有非极性键的是( )。
(A) BF3;(B) P4;(C) CO2;(D) H2S。
(2分)[13] 下列叙述中正确的是.....()。
(A) CH4、CO2为非极性分子,BCl3、H2S 为极性分子;(B) CH4、H2S 为非极性分子,CHCl3、HCl 为极性分子;(C) CO2、BCl3为非极性分子,CHCl3、HCl 为极性分子;(D) BCl3、H2S 为非极性分子,HCl、PCl3为极性分子。
(2分)[14]HCl、HBr、HI 的熔、沸点依次升高,其主要原因是....()。
(A) 键能依次减弱;(B) 键长依次增长;(C) 色散作用依次增强;(D) Cl、Br、I 的电负性依次减小。
(2分)[15]HF 比同族元素氢化物的熔、沸点高,这主要是由于HF 分子间存在()。
(A) 取向力;(B) 诱导力;(C) 色散力;(D) 氢键。
(2分)[16] 用价层电子对互斥理论推测NH4+的几何形状是...()。
(A) 三角锥形;(B) 平面四方形;(C) 四面体形;(D) 四方锥形。
(2分)[17] 用价层电子对互斥理论推测,下列各组分子或离子中,构型均为三角锥形的是...()。
(A) NF3,BCl3;(B) H3O+,CO32-;(C) NF3,H3O+;(D) BCl3,CO32-。
(2分)[18] 下列物质按晶格结点上粒子间作用由小至大的顺序排列中,正确的是...()。
(A) H 2S < SiO 2 < H 2O ;(B) H 2O < H 2S < SiO 2;(C) H 2S < H 2O < SiO 2; (D) H 2O < SiO 2 < H 2S 。
(2分)[19]MgO 在 工 业 上 可 用 于 耐 火 材 料, 这 主 要 与 下 列 各 种 性 质 中有 关 的 是......( )。
(A) 键 型; (B) 晶 格 能; (C) 电 负 性; (D) 电 离 能。
(2分)[20] 所 谓 某 原 子 轨 道 是 指( )。
(A) 一 定 的 电 子 云; (B) 核 外 电 子 出 现 的 概率(几 率);(C) 一 定 的 波 函 数; (D) 某 个 径 向 分 布 函 数。
(2分)[21] 氢 原 子 的 原 子 轨 道 能 量 取 决 于 量 子 数( )。
(A) n ; (B) n 和 l ; (C) l ; (D) m 。
(2分)[22] 下 列 有 关 电 子 云 的 叙 述中, 错 误 的 是.( )。
(A) 电 子 云 形 象 地 表 示 了 电 子 在 核 外 某 处 单 位 微 体 积 内 出 现 的概率(几 率);(B) 电 子 云 形 象 化 地 表 示 了 电 子 在 核 外 空 间 某 处 出 现 的概率( 几率 )密 度;(C) 1s 电 子 云 界 面 图 是 一 个 球 面, 表 示 在 这 个 球 面 以 外,电 子 出 现的概率( 几 率 )为 零;(D) 电 子 云 是 电 子 运 动 的 统 计 结 果, 它 好 象 形 成 了 一 团 带 负 电荷 的 云, 包 围 在 原 子 核 的 外 边。
(2分)[23] 对 于 原 子 核 外 的 电 子 来 说, 下 列 各 组 量 子 数 的 组 合 中 错误 的 是( )。
(A) n = 3,l = 2,m = 0,m s = +12; (B) n = 2,l = 2,m = -1,m s = -12; (C) n = 4,l = 1,m = 0,m s = -12; (D) n = 3,l = 1,m = -1,m s = +12。
(2分)[24] 下 列 各 组 量 子 数 中, 对 应 于 能 量 最 低 的 电 子 是( )。
(A) 3,1,0,+12;(B) 3,1,1,-12; (C) 3,0,0,+12; (D) 3,2,1,-12。
(1分)[25] 对 下 图 所 示, 正 确 的 叙 述 是( )。
(A) 图 形 表 示 d x y 原 子 轨 道 的 形 状;(B) 图 形 表 示 dx y 22- 原 子 轨 道 的 形 状; (C) 图 形 表 示 d x y 22- 原 子 轨 道 角 度 分 布 图;(D) 图 形 表 示 d x y 22- 电 子 云 角 度 分 布 图。
三、填充题(8小题,共16.0分)(2分)[1] 某元素的原子核外共有5 个电子,其中对应于能级最高的电子的量子数n = ______,l = ________。
(2分)[2] 原子核外最先开始填充 4 p亚层的元素的原子序数为________;原子核外最先开始填充7 s亚层的元素的原子序数为________。
(2分)[3] 下列分子BCl3、CCl4、H2S 和CS2中,其键角由小到大的顺序为______________________,其中属于极性分子的是_______________。
(2分)[4] 下列物质: CO2、SiO2、MgO、Ca 中,熔点最高的是________,熔点最低的是________。
(2分)[5] 氧化钙晶体中晶格结点上的粒子为________ 和________;粒子间作用力为________,晶体类型为________。
(2分)[6] 已知下列各离子的半径为:O2- (140 pm),S2- (184 pm ),Be2+ (31 pm ),Mg2+ (65 pm ),Ca2+ (99 pm ),Sr2+ (113 pm )。
试按半径比规则推测:MgO 属________ 型结构;CaS 属________ 型结构;SrS 属________ 型结构;BeO 属________ 型结构。
(2分)[7] 下列离子:Mg2+、K+、Fe3+、Ca2+的极化力大小顺序为______________________,它们的氢氧化物脱水由易到难的顺序为_______________________________。
(2分)[8] 假定氢原子处于两种状态:(1) 电子在n = 1 的原子轨道上运动;(2) 电子在n = 3 的原子轨道上运动;那么状态__________ 的氢原子能量较低;状态__________ 的氢原子失去一个电子需要较多的能量。
