浙江大学2005-2006学年冬季学期《物理化学(乙)》课程期末考试试卷1
《物理化学(乙)》 Zhejiang University.pdf

《物理化学(甲)》考试大纲一、内容:涵盖物理化学(占80%左右)和结构化学(占20%左右)。
二、物理化学大纲1. 气体的PVT关系基本内容:理想气体状态方程;分压定律和分体积定律;理想气体的微观模型;气体的液化;范德华方程与维里方程;临界性质;对应状态原理;压缩因子图。
2. 热力学第一定律基本概念:重要热力学概念;热力学第一定律;热、功;内能;焓;热容;可逆体积功;相变焓;反应焓;节流膨胀。
基本内容:热力学基本概念及术语;热力学第一定律的表述与数学表达式;Qv=ΔU,Qp=ΔH及H的定义;过程热的计算;Cp与Cv的关系;由Cp计算Qp和ΔH;理想气体的等温可逆过程与绝热可逆过程功的计算;其他常见过程功的计算;相变焓、相变过程、相变热的计算;化学变化过程、化学反应热效应的计算;化学反应进度;标准热力学函数的计算。
3.热力学第二定律基本概念:卡诺循环,过程可能性判据,热力学第二定律,熵及熵变,第三定律,吉布斯自由能,亥姆霍兹自由能,热力学基本方程及麦克斯韦关系式,特性函数,克-克方程。
基本内容:卡诺循环;自发过程的共同特征;卡诺定理与热力学第二定律,熵增原理;熵函数,熵判据;各种典型过程熵变的计算;热力学第三定律,规定熵与标准熵;亥姆霍兹函数与吉布斯函数;ΔA与ΔG判据;一些基本过程ΔG的计算与应用;热力学基本方程与麦克斯韦关系式;吉布斯—亥姆霍兹方程;克拉贝龙方程及其应用。
4.多组分系统热力学基本概念:偏摩尔量,化学势,化学势判据,拉乌尔定律,亨利定律,理想液态混合物,理想稀溶液,稀溶液的依数性,逸度与逸度因子,活度与活度因子,热力学标准态。
基本内容:偏摩尔量与摩尔量;偏摩尔量的集合公式;Gibbs-Duhem方程;化学势的定义与各类系统化学势的表示式;化学势判据;拉乌尔定律与享利定律;理想液态混合物的定义及其特征;稀溶液的定义及其依数性;逸度与逸度因子的计算;活度和活度因子的计算;标准态选择与活度的关系;简单汽液平衡计算。
大学计算机基础期末试卷

浙江大学2005–2006学年秋冬季学期《大学计算机基础》课程期末考试试卷开课学院:计算中心,考试形式:闭卷,允许带 / 入场考试时间:2006年1月18日,所需时间: 90 分钟姓名___________学号________________专业____________________一.单选题(每一小题1分,共20分)1、在计算机中作为数据交换使用的ASCII是( D )。
A、条件码B、二——十进制编码C、二进制编码D、美国信息交换标准代码2、24×24汉字点阵字库中,表示一个汉字字形需要( D )字节。
A、24B、32C、48D、723、操作系统是( D )的接口。
A、用户和软件B、系统软件和应用软件C、主机和外设D、用户和计算机4、Internet与WWW的关系是( D )。
A、都是因特网,只是名称不同B、Internet就是WWWC、Internet与WWW完全没有关系D、WWW是Internet上的一个应用5、IP地址所对应的二进制数字的长度为( D )。
(P298)A、8位B、16位C、24位D、32位6、下列( C )不是操作系统软件。
A、LinuxB、Windows 2000C、MS OfficeD、Unix7、计算机能够直接识别和运行的语言是( A )。
A、机器语言B、高级语言C、汇编语言D、智能语言8、一个指令通常由两部分组成,它们是( A )。
(P185)A、操作数和操作码B、内部指令和扩展指令C、算术指令和逻辑指令D、Intel指令系统和AMD指令系统9、若用8位表示一个整数,则十进制数-36的补码是( A )。
A、B、C、D、10、目前大多数数据库管理系统都支持( C )数据模型。
A、层次型B、网模型C、关系型D、面向对象型11、按结构化程序设计的观点,任何程序模块都可以由三种基本的控制结构组合而成。
这三种基本的控制结构是:顺序控制结构、分支控制结构和( B )。
2014-2015秋冬物理化学(乙)试卷A及标准答案

浙江大学2014–2015学年秋冬学期《物理化学》课程期末考试试卷课程号:061B9030,开课学院:__理学院_考试试卷:√A卷、B卷(请在选定项上打√)考试形式:√闭、开卷(请在选定项上打√),允许带__计算器__入场考试日期:2015年 1 月 29 日, 考试时间: 120 分钟诚信考试,沉着应考,杜绝违纪。
考生姓名:学号:所属院系: _1.1 mol of water vaporizes at 298 K and 100 kPa. Calculate Q, W, ΔU,ΔH, ΔS, ΔG and ΔA. The volume of water can be neglected. The vaporizing enthalpy change of water at 373 K Δvap H m= 40.668 kJ·mol-1.The isobaric heat capacities of water and vapor (perfect gas) are: C p,m (H2O,l) = 75.75 J·mol-1·K-1, and C p,m (H2O,g) = 33.76 J·mol-1·K-1 (15 scores).ΔH是重点!基尔霍夫定律!Q与ΔH关系要注意!计算W用了一长串近似公式要记忆2. When 2.00 mol of a perfect gas at 330 K and3.50 atm is subjected to isothermal compression, its entropy decreases by 25.0 J·K-1. Calculate (a) the final pressure of the gas and (b) ΔG for the compression (15 scores).(5.8a)注意:出现deabsorb,decrease之类的字眼要注意物理量的符号3. The vapor pressure of benzene is 400 Torr at 60.6 ℃, but it fell to 386 Torr when 19.0 g of an involatile organic compound was dissolved in 500 g of benzene. Calculate the molar mass of the compound (10 scores).(7.9a)4. The following picture is the phase diagram for silver and tin.(a) State what substances exist in each region and label each substance as solid, liquid or gas .(b) Sketch the cooling curves for the given systems a, b and c.(c) Is there any compound in the diagram? Is it stable or unstable? If itexists, what is the chemical formula?(d) What is the composition for the last drop of liquid if solution c is cooled below the triple line? (15 scores).5. The standard potential for the cell reaction:H2(g) + 2AgCl(s) = 2Ag + 2HCl(aq)at 101.325 kPa from 0 ~ 90℃has a relation to temperature:E⊖= a + b ( T–T0) + c ( T–T0) 2 + d ( T–T0) 3where a = 0.2369V, b = – 4.8564×10– 4 V/K, c = – 3.4205×10– 6 V/K2,d =5.869×10– 9 V/K3, T0 =273.15 K. Calculate Δr G m⊖,Δr S m⊖, and Δr H m⊖of the cell reaction at 10℃and 101.325 kPa. Given that F = 96485.(15 scores) (来自中文书)6. Consider the following mechanism for the thermal decomposition of R2:(1) R2→R + R(2) R + R2→P B + R′(3) R′→ P A + R(4) R + R→P A + P Bwhere R2, P A, P B are stable hydrocarbons and R and R′ are radicals. Find the dependence of the rate of decomposition of R2 on the concentration of R2. (15 scores)(26.6 b)跟例题类似7. N2 adsorbed on SiO2 surface to the extent of 1.242 cm3 g-1 at 350 kPa and 180 K, but at 240 K the same amount of adsorption was achieved only when the pressure was increased to 1.02 Mpa. What is the enthalpy of adsorption of N2 on SiO2 surface? (15 scores)(28.17 b)习题为28.17a。
2005-2006学年第一学期

《物理化学》 (上册)期末考试试卷
班级:
题号 满分 得分 一、选择题(将答案填在下面表中) 1.恒容下,一定量理想气体,当温度升高时热力学能将: A. 降低 B. 增加 C. 不变 D. 不能确定 2.一定量理想气体从同一始态出发,分别经(1)等温压缩、 (2)绝热压缩到具有相同压力的 终态,以 H1、H2 分别表示两个终态的焓值,则有: A. H1>H2 B. H1=H2 C. H1<H2 D. H1≥H2 3.气体的临界压力是指: A. 气体可以液化的最高压力; B. 气体可以液化的最低压力; C. 临界温度下气体液化的最高压力; D 临界温度下气体液化的最低压力。 4. 由水(1)和甲醇(2)组成的二元溶液,下列各式不是甲醇在此溶液中化学势的是: A. 一 12
c NH3 (H 2 O) c NH3 (CCl 4 )
6.已知某反应 300℃,低压下的 K Θ =3.8×10-3,当该反应在 300℃,高压下进行时 K Θ p = , (已知该反应的 Kφ=0.773) 。 三、已知 A 在 100℃,100kPa 下的摩尔蒸发焓∆vapHm(A)=40.0kJ·mol-1 ,现有 1molA(l) 在 100℃,100kPa 下可逆变为同温同压下的 A(g) ,再等温向真空膨胀到压力为 50kPa 的终态, (气体视为理想气体,液体体积与气体相比可以忽略) 求全过程的∆U,∆H,∆S,∆G,Q,W。 四、证明: (1)
姓名:
二 20 三 18
学号:
四 15 五 20
分数:
六 15 总计 100
∂H ∂n 2 ∂A ∂n 2
S , p , n1 T ,V , n1
【浙江大学】普通化学考试试卷
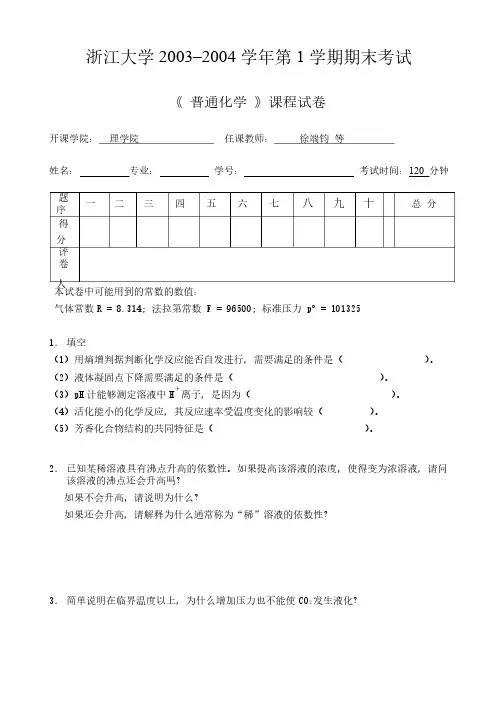
浙江大学20032003––2004学年第1学期期末考试 《 普通化学普通化学 》课程试卷开课学院:开课学院: 理学院理学院 任课教师:任课教师: 徐端钧徐端钧 等 姓名:姓名: 专业:专业: 学号:学号: 考试时间:120 分钟 题序一 二 三 四 五 六 七 八 九 十 总 分 得分 评卷人 本试卷中可能用到的常数的数值:本试卷中可能用到的常数的数值:气体常数R = 8.314; R = 8.314; 法拉第常数法拉第常数法拉第常数 F = 96500; F = 96500; F = 96500; 标准压力标准压力标准压力 p p ° = 1013251. 填空填空(1)用熵增判据判断化学反应能否自发进行,需要满足的条件是()用熵增判据判断化学反应能否自发进行,需要满足的条件是( ))。
(2)液体凝固点下降需要满足的条件是()液体凝固点下降需要满足的条件是( ))。
(3)pH 计能够测定溶液中H +离子,是因为(离子,是因为( ))。
(4)活化能小的化学反应,其反应速率受温度变化的影响较()活化能小的化学反应,其反应速率受温度变化的影响较( ))。
(5)芳香化合物结构的共同特征是()芳香化合物结构的共同特征是( ))。
2. 已知某稀溶液具有沸点升高的依数性。
如果提高该溶液的浓度,使得变为浓溶液,请问该溶液的沸点还会升高吗?该溶液的沸点还会升高吗?如果不会升高,请说明为什么?如果不会升高,请说明为什么?如果还会升高,请解释为什么通常称为“稀”溶液的依数性?如果还会升高,请解释为什么通常称为“稀”溶液的依数性?如果还会升高,请解释为什么通常称为“稀”溶液的依数性?3. 简单说明在临界温度以上,为什么增加压力也不能使CO 2发生液化?发生液化?4. 液体加热时经常会发生“暴沸”,为了防止液体暴沸,需要往液体中添加“沸石”。
试用热力学的观点简单解释这一现象,并说明添加沸石的理由。
物理化学2005-2006学年第二学期期末试卷B.doc含答案

………………………………密………………………封…………………………线………………………………………………学院2005-2006学年第二学期期末考试化学、应用化学专业03 级《物理化学》试卷(B)一、选择正确答案在括号内(每小题2分,共30分)1.以下叙述正确的是:( )(A)对于单分子反应理论和酶催化反应理论,反应物在高浓度时为一级反应,在低浓度时为二级反应;(B)对于单分子反应理论和酶催化反应理论,反应物在高浓度时为二级反应,在低浓度时为一级反应(C)对于单分子反应理论,反应物在高浓度时为一级反应,在低浓度时为二级反应;酶催化反应理论,反应物在高浓度时为一级反应,在低浓度时为二级反应(D)对于单分子反应理论,反应物在高浓度时为一级反应,在低浓度时为二级反应;酶催化反应理论,反应物在高浓度时为零级反应,在低浓度时为一级反应2.已知电极电位:φ (Cl2/Cl-) = 1.36 V,φ (Br2/Br-) = 1.07 V,φ (I2/I-) = 0.54 V,φ (Fe3+/Fe2+) = 0.77 V,标准状态下,Fe与卤素组成电池,下面判断正确的是:( )(A) Fe3+可氧化Cl- ;(B) Fe3+可氧化Br-;(C) Fe3+可氧化I-;(D) Fe3+不能氧化卤离子。
3.某反应只有一种反应物,其转化率达到75%的时间是转化率达到50%的时间的两倍,反应转化率达到64%的时间是转化率达到x%的时间的两倍,则x为:( )(A) 32 ;(B) 36 ;(C) 40 ;(D) 60 。
4.同一体系,比表面自由能和表面张力都用σ表示,它们:( )(A) 物理意义相同,数值相同; (B) 数值和单位完全相同;(C) 物理意义相同,单位不同; (D) 物理意义不同,数值相同。
5.用I=0.025A的电流通过Au(NO3)3溶液,当阴极上有1.20g Au(s)析出时,通过的电量为C ;阳极上放出氧气的摩尔数为mol;(已知Au的摩尔质量为197.0 g/mol)( )(A)1763、4.57×10-3(B)1763、1.83×10-2(C)588、1.14×10-3 (D)588、6.09×10-3………………………………密………………………封…………………………线………………………………………………6.对于浓差超电势,下列叙述不正确的是:( )(A) 浓差超电势的产生在于电极反应速率大于离子迁移速率 ; (B) 可用升温或搅拌的方法减小或消除浓差超电势 ; (C) 浓差超电势的大小与电流密度无关 ; (D) 电极极化程度与浓差超电势的大小有关 。
浙大作业物理化学习题集答案
浙江大学远程教育学院 《物理化学》课程作业(必做)姓名: 张倩倩 学 号: 714007222005 年级:2014年秋学习中心:温州—————————————————————————————第一章 热力学第一定律一、填空题1. 宏观上静止且无外力场存在的封闭2. 封闭系统在非体积功为0且等压3. 强度性质4. 小于二、简答题1. 什么是系统?什么是环境?答:将一部分物质从其他部分中划分出来,作为研究的对象,这一部分物质就称为系统; 系统之外与系统密切相关的部分称为环境。
2. 什么是热力学第一定律?答:将能量守恒与转化定律应用于宏观的热力学系统即为热力学第一定律。
三、计算题1. 答:(1)自由膨胀;0)(0)(1212e ===V V V V p W -⨯--因为理想气体的热力学能和焓都只是温度的函数,而理想气体自由膨胀过程温度不变,所以: ΔU =ΔH =f (T )=0 (2)等温可逆膨胀;因为理想气体的热力学能和焓都只是温度的函数,所以等温过程 ΔU=ΔH=0W=-nRTln(v2/v1)=-1x8.314x298ln(40/15)=-2430JQ=-w=2430J(3)在恒定外压为终态压力下等温膨胀。
ΔU=ΔH=0P=nRT/V=(1×8.314×298)/(40/1000)=61.94KPa W=-61.94 × (40-15) =-1548.5J Q=-w=1548.5J2. 答:2NaCl(s) + H2SO4(l) = Na2SO4(s) + 2HCl(g)△r H m ө=(∑H )产物-(∑H )反应物=(-1383-92.3*2)-(-411*2-811.3)=65.7KJ/mol第二章 热力学第二定律一、单选题1. 反应 NH 4Cl (s) = NH 3(g) + HCl (g)的△r S m өA 。
A .大于零B .小于零C .等于零D .不确定二、填空题1. 过程方向限度2. 大于3. 绝热可逆压缩4. 封闭系统等温等压和非体积功为零5.小于三、简答题1. 什么是热力学第二定律?答:热量由低温物体传给高温物体而不引起其他变化,是不可能的。
浙江大学物理化学考研试题及答案
2mol 2mol 300K 350K 100kPa 800kPaS∆−−→理想气体理想气体浙江大学硕士学位研究生入学考试物理化学(乙)参考答案一、填空:1. a b c d2.联系统计热力学与宏观热力学的桥梁,表明了熵的统计意义。
3.0.618min -1。
4.0.770V 。
5.00ln ()pp m RTRT V dp RTbdp RTbp pϕ=-==⎰⎰exp()bp ϕ= ,exp()f p p bp ϕ==。
6.n 2/n 1=0.32二、答:不矛盾。
当0p →时,任何气体符合理想气体模型,,1m pV RT Z ==。
在一定压力下,气体分子间距离较小,分子间的吸引力较大,使真实气体较气体易被压缩;同时,真实气体的分子又占一定体积,气体分子自由活动空间变小,使真实气体难被压缩。
这两种相反的作用因素对真实气体行为的影响在b 和b’点刚好抵消,数值上满足Z=1,,1m pV RT Z ==成立。
三、解:1.F =C -P +2=1-3+2=02.OA 线是冰的熔化曲线,OA 线斜率为负表示增大压力,冰的熔点下降。
根据克拉佩龙方程:**m mH dp dT T V ∆=∆,熔化过程,*m H ∆>0,***()()0m m m V V l V s ∆=-<,所以0dp dT <。
3.ln /b RT p p μμ=+ ,*ln /c RT p p μμ=+ , *p p >b c μμ∴>,说明同温度下过冷水(b )能自发地转变为冰(c ),过冷水与其饱和蒸气的平衡不是稳定平衡,但因为过冷水可以在一定时间内存在,所以称亚稳平衡。
四、提示:可以从以下几个方面展开,(1)2ln a E d kdT RT=,对于平行反应,活化能不同,反应速率受温度的影响不同,可以通过选择最适宜温度来控制反应物产率。
(2)催化剂具有选择性。
(3)选择适当波长的光,可以进一步提高反应的选择性。
浙江大学2009–2010学年 秋冬 学期 高物 期末卷
浙江大学2009–2010学年秋冬学期《高分子物理》课程期末考试试卷课程号:09120131 ,开课学院:___________考试试卷:√A卷、B卷(请在选定项上打√)考试形式:√闭、开卷(请在选定项上打√),允许带___计算器__入场考试日期: 2010 年 1 月 25 日,考试时间: 120 分钟诚信考试,沉着应考,杜绝违纪。
考生姓名:学号:所属院系: _一、选择题(多选题,每题2分,共20分)1. Among following four polymers, which is the most rigid? ( B )。
(A) poly (dimethyle siloxane) (B) polyacrylonitrile(C) polystyrene (D) polyethylene2. Among following methods, which can be used to measure crystallinity of polymers? ( A, B, C, D )。
(A) Density method (B) WAXD (C) DSC (D) IR3.下列相同分子量的聚合物,在相同条件下用稀溶液粘度法测得的特性粘数最大的为( D )(A)高支化度聚合物(B)中支化度聚合物(C)低支化度聚合物(D)线性聚合物4. For a solution under condition, which parameters are correct? ( B, C, D )(A) χ1=0 (B) ∆μE=0 (C) A2=0 (D) u(exclusive volume)=05. 下面有关玻璃化转变的描述,正确的是( A, B, D, E)(A)聚合物玻璃态与高弹态之间的转变(B)链段由运动到冻结的转变(C)分子链由冻结到运动的转变(D)自由体积由随温度下降而减少到不随温度发生变化的转变(E)链段由冻结到运动的转变6.韧性聚合物单轴拉伸至屈服点时,可看到剪切带现象,下列说法正确的是(B, C, D)。
浙江大学物理化学(乙)考研大纲
浙江大学《物理化学(乙)》教学大纲一、教学目的和教学要求通过本课程的学习使学生建立一个系统、完整的物理化学基本理论和基本方法的框架,掌握热力学、动力学、电化学、统计热力学中的普遍规律,学生学到有关知识的同时能学到探索问题的思路和方法,培养解决问题的能力。
二、教学内容1绪论气体的PTV性质2热力学第一定律基本概念,定律表述,热,内能,焓,热容,可逆体积功计算,节流膨胀,反应热3热力学第二定律:卡诺循环,过程可能性判据,热力学第二定律,熵及熵变计算,第三定律,吉布斯自由能与亥姆霍兹自由能及其改变量计算,热力学基本方程及麦克斯韦关系式,特性函数,克-克方程.4.多组分系统热力学:拉乌尔定律,偏摩尔量,化学势,理想稀溶液,稀溶液的依数性,逸度及系数,活度及系数,标准态5.化学平衡:标准平衡常数,化学反应等温方程,化学平衡及其平衡常数的计算方法,化学反应平衡移动原理.6.相平衡:相律,单组分体系相图,二组分体系相图,超临界状态,三组分系统.7.电化学电解质溶液,电导,电迁移,电化学热力学,电极电势,能斯特方程,可逆电池电动势及其应用,原电池设计,电解和极化8.统计热力学初步统计分布,统计平均,玻尔兹曼统计分布定律,熵的本质及玻尔兹曼公式,配分函数及其热力学函数的统计计算,统计热力学应用-平衡常数计算等9.表面现象(界面现象)及胶体化学表面自由能(表面张力),表面热力学,溶液与固体表面上的饿吸附作用,吸附等温式,表面活性剂,溶液的性质及其稳定性,高分子溶液10.化学动力学基础基本概念:化学反应速率,速率方程,简单级数反应动力学规律,反应级数测定,速率常数计算,复杂反应动力学,基元反应速率理论三、参考书1)《物理化学》(第四版)(上,下),天津大学物理化学教研室编,宋世谟,庄公惠,王正烈修订,高等教育出版社,19932)《物理化学》(第五版)(上、下),傅献彩、沈文霞、姚天扬、侯文华编,高等教育出版社,20063)《物理化学》第四版,(上,中,下),胡英主编, 高教社出版,2000。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浙江大学2005-2006学年冬季学期
《物理化学(乙)》课程期末考试试卷
开课学院:理学院,考试形式:闭卷,允许带___计算器 _入场
考试时间:2006年1月11日,所需时间: 120 分钟
考生姓名: ___ __学号:专业: ________
一、填空题(20分,每题2分)
1.一定量的理想气体从V1自由膨胀到V2后,其ΔU 0;
ΔA(或ΔF)0(请选择填入>、<、=、不确定)。
2.理想气体的焦耳-汤姆逊系数μJ-T0(请选择>、<、=、不确定)。
3.如果要确定一个“组成和总量都已知的均相多组分体系”的状态,我们至少还
必须知道该体系的其它个独立状态变量。
4.当隔离体系中发生某种变化(包括化学变化)后,该体系的ΔU 0(请
选择>、<、=、不确定)。
5.在恒温条件下,对理想气体进行恒压压缩时,该过程的体系熵变ΔS体系0,
ΔS体系+ΔS环境0(请选择填入>、<、=、不确定)。
6.以汞作为工作物质的可逆卡诺热机的热机效率为以理想气体作为工作物质的
可逆卡诺热机的热机效率的%。
7.零下5℃的过冷水变成同温同压下的冰时,该过程的体系熵变ΔS 0(请
选择填入>、<、=、不确定)。
8.已知某二元溶液对拉乌尔定律产生正偏差。
如果以x
B →0,γ
B
=1为标准态时,
其活度系数是(请选择填入:>1、<1、=1、不确定)。
9.当反应体系的总压一定时,加入惰性气体有利于气体物质的量的反应。
(请选择填入:增大、减小、不变、不确定)
10.I2(g)溶于互不相溶的水和CCl4(l)中并达到平衡,则该体系的组分数C=
;自由度数F=。
二、选择题(20分,每题2分)
1. 已知H2临界温度t c= -239.9°C, 临界压力p c = 1.297×103 kPa。
现有一氢气钢瓶,
在298 K时瓶中H2的压力为98.0×103 kPa,则H2的状态一定是
(a)气态(b) 液态(c) 气-液两相平衡(d)无法确定
2. 在一个绝热良好、抽成真空的容器中,灌满压力为101.325 kPa、温度为373 K
的纯水(容器内无气体存在),此时水的饱和蒸气压p*(H2O)
(a) > 101.325 kPa (b) < 101.325 kPa (c)= 101.325 kPa (d)无法确定
3. 被绝热材料包围的房间内放有一电冰箱,将电冰箱门打开的同时向电冰箱供给
电能而使其运行。
室内的温度将( ).
(a) 逐渐降低(b) 逐渐升高(c) 不变(d)无法确定
4. 在温度为T、压强为100 kPa时,反应(1) A = 2B,反应(2) 2A = C及反应(3) C =
4B的标准摩尔焓分别为∆r H mӨ(1)、∆r H mӨ(2)及∆r H mӨ(3),则∆r H mӨ(3)等于
(a) 2∆r H mӨ(1) + ∆r H mӨ(2) (b) ∆r H mӨ(2)-2∆r H mӨ(1)
(c) ∆r H mӨ(2) + ∆r H mӨ(1) (d) 2∆r H mӨ(1)-∆r H mӨ(2)
5. 一定量的某真实气体,经节流膨胀后使系统的温度下降,p、V之积变大,此过
程的Q( );∆H ( ); ∆U( ); ∆S( )。
(a)Q=0, ∆H =0, ∆U<0, ∆S>0 (b) Q=0, ∆H =0, ∆U=0, ∆S>0
(c) Q<0, ∆H =0, ∆U<0, ∆S>0 (d) Q=0, ∆H =0, ∆U=0, ∆S=0
6. 在273 K、100 kPa下,过冷的液态苯凝结成固态苯,则此过程的
(a) ∆S(系) > 0 (b) ∆S(环) < 0
(c)∆S(系) + ∆S(环) > 0 (d) ∆S(系) + ∆S(环) < 0
7. 在300K下,一个抽真空的容器中放入过量的A(s), 发生下列反应:
A(s) B(s) + 3D(g)
达到平衡时D(g)的压力p D* = 1.02 kPa。
此反应的标准平衡常数KӨ为
(a) 1.02 (b) 1.061×10-6 (c) 1.04×10-4(d) 3.06
8. 已知
反应(1) 2 A(g) + B(g) 2C(g)的lnK1Ө=3134 K/T-5.43
反应(2) C(g) + D(g) B(g)的lnK2Ө=-1638 K/T-6.02
反应(3) 2 A(g) + D(g) C(g)的lnK3Ө=A K/T + B
上式中A和B是量纲为1的量,其中A和 B 的值分别为( )。
(a) A=4772, B = 0.59 (b) A=1496, B =-11.45
(c) A=-4772, B =-0.59 (d) A=-542, B = 17.47
9. 在一定温度下,p B* > p A*,由纯液态物质A和B形成理想液态混合物,当气液
两相达到平衡时,气象组成y B总是( )液相组成x B。
(a) 大于(b) 小于(c) 等于(d) 正比于
10. 在一个抽真空容器中放有过量的NH4HCO3(s),并发生下列反应:
NH4HCO3(s) NH3(g) + H2O(g) + CO2(g)
此平衡系统的相数P、独立组分数C和自由度数F分别是( )
(a) P=2, C=1, F=1 (b) P=2, C=3, F=3
(c) P=2, C=2, F=2 (d) P=2, C=4, F=4
三、C6H5Cl(A)和C6H5Br(B)组成理想液态混合物,在136.7℃时A的饱和蒸气压为
115.1 kPa,B的蒸气压为60.4 kPa。
设蒸气可视为理想气体。
(1)有一溶液组成为x A=0.618,试计算136.7℃时气相组成y A和y B;
(2)136.7℃时,如果气相中两种物质的蒸气压相等,求溶液的组成;
(3)有一溶液的正常沸点为136.7℃,试计算此时液相及气相的组成。
(10分)
四、某A、B二组分凝聚系统相图如图所示。
(15分)
(1)分析各相区的稳定相;
(2)指出图中的三相线,在三相线上哪几个相成平衡?三者之间的相平衡关系如何?
(3)绘出图中状态点为a和b两个样品的冷却曲线。
22,
其余为惰性气体,求反应:
(g)SO (g)O 2
1
(g)SO 322⇔+
(a) 在298K 的标准平衡常数θK ;
(b) 在什么温度反应达平衡时有80%的SO 2被转化? (设反应∆r C p,m =0,气体为理想气体)(10分)
六、1mol单原子理想气体由0℃、506.5kPa分别经过
(1) 绝热可逆膨胀;
(2) 反抗恒定外压p amb=101.3kPa绝热膨胀,使两过程气体最后的压力皆为101.3kPa。
试求两种情况下的最终温度、系统与环境交换的功以及系统的熵变。
(15分)
七、在-59℃时, 过冷液态二氧化碳的饱和蒸气压为0.460 MPa, 同温度时固态CO2的饱和蒸气压为0.434 MPa, 问在上述温度时, 将1 mol过冷液态CO2转化为固态CO2时, ΔG为多少? 设气体服从理想气体行为。
(10分)。
