普化-第01章-热化学与能源
普化 第一章

Q W
状态2(U2)
能量守恒定律:U2=U1+Q+W
ΔU= U2 -U1=Q+W
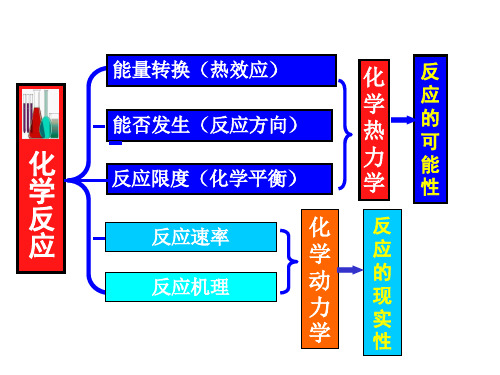
1.1.3 热化学(Thermochemistry) 3 热化学( )
1)反应热(Heat of reaction) 反应热(
化学反应,始终态温度相等,只做体积功时, 化学反应,始终态温度相等,只做体积功时,系统吸 收或放出的热称为反应热。 收或放出的热称为反应热。
1.1.1 热力学术语和基本概念 Thermodynamics terms and primary concepts (一)体系和环境 (System and Surrounding) (二)状态和状态函数 (State and State functions) (三)过程和途径 (Process and Path) 三 (四)热和功 (Heat and Work) (五)热力学能(内能) U (Thermodynamic energy) (六)标准状态 ( Standard state)
Notes: U 是体系的性质,与体系状态有关,是状态函数。 U 的绝对值至今尚无法知道,只能是在系统发生变化的过 程中,通过系统和环境之间热和功的传递来测定其变化 值,即∆U 。
∆U= U终 - U始 = U2 - U1
(六)标准状态 (Standard state)
热力学中为了表述状态函数和计算状态函数的变化,必须对各种物 热力学中为了表述状态函数和计算状态函数的变化, 质规定一个共同的基准状态,即热力学的标准状态,简称标准态。 质规定一个共同的基准状态,即热力学的标准状态,简称标准态。 用上标θ来表示。 国家标准: 标准压力 pθ =100 kPa 而非 101.325 kPa 标准浓度 mθ =1 mol·kg-1而非 1mol.L-1
《中国学科发展战略·电化学》

《中国学科发展战略·电化学》一、考试科目基本要求及适用范围概述本《普通化学(乙)》考试大纲适用于报考中国科学院大学非化学、化工类专业的硕士研究生入学考试。
普通化学对化学作一概括的阐述和研讨。
主要介绍化学的基本概念和方法,二、考试形式(TKT,笔试,考试时间分钟,总分分后)和试卷结构(题型)考试形式:闭卷,笔试,考试时间分钟,总分分。
试卷结构:选择题、填空题、判断题、问答题和计算题。
三、考试内容(一)热化学与能源1. 热力学基本概念(如状态函数、热力学标准态、反应进度、焓等)。
2. 定容热效应(qv)的测量原理和实验计算方法。
3. 热化学定律及其应用。
4. 反应的标准摩尔焓变小的近似计算。
5. 能源的概况和我国能源的特征,及可持续发展战略。
(二) 化学反应的基本原理与大气污染1. 熵变及吉布斯函数变的意义,化学反应 drgm 的近似计算,反应进行的方向的判别。
2. drgm 与k 的关系及有关排序,浓度、压力和温度对化学平衡的影响。
3. 浓度、温度与反应速率的定量关系。
4. 元反应和反应级数的概念。
5. 阿仑尼乌斯公式及其相关计算。
6. 活化能和活化分子的概念,浓度、温度、催化剂对化学反应速率的影响。
7. 链反应与光化学反应的一般概念。
8. 大气的主要污染物,温室效应、臭氧层空洞、酸雨及光化学烟雾等综合性大气污染及其掌控。
9. 清洁生产和绿色化学的概念。
(三) 水化学与水污染1. 溶液的通性。
2. 酸碱的近代概念,酸碱的离解均衡和缓冲溶液的概念。
3. 有关ph值的计算;了解配离子的解离平衡及其移动。
4. 结晶与熔化均衡。
5. 溶度积规则及其有关计算。
6. 胶体的聚沉、维护及表面活性剂的结构和应用领域。
7. 水体的主要污染物的来源及其危害。
(四) 电化学与金属腐蚀1. 原电池的组成、半反应式以及电极电势的概念。
2. 能够斯特方程。
3. 电极电势和原电池电动势的计算。
4. 浓度对电极电势的影响以及电极电势的应用领域:比较氧化剂还原剂的相对高低,推论水解还原成反应展开的方向和程度。
《普通化学》教学大纲

《普通化学》教学大纲计划学时:普通化学与实验A64(实验16),普通化学与实验B48(实验8)适用专业:非化学、化工类各专业一、本课程的教学内容第一章化学反应基本规律1.基本概念:系统、环境、相。
2.化学反应中的质量和能量守恒:化学反应的质量守恒定律,化学反应计量方程。
状态和状态函数,热力学能,热和功,热力学第一定律。
化学反应的反应热:定压反应热、定容反应热。
焓与焓变。
3.自发过程,混乱度和熵。
化学反应的ΔrHP和ΔrGP的计算。
吉布斯函数变与反应进行的方向。
4.标准平衡常数KP,有关化学平衡的计算。
KP与ΔrGP的关系。
多重平衡规则。
化学平衡的移动,吕·查德里原理。
5.化学反应速率的概念和表示方法。
反应速率理论。
活化能、基元反应、反应级数。
质量作用定律和阿伦尼乌斯公式。
浓度、温度、催化剂对反应速率的影响。
第二章溶液与离子平衡1.溶液浓度的几种表示方法。
稀溶液的通性:溶液的蒸汽压下降、沸点升高、凝固点下降和渗透压,拉乌尔定律。
溶液的依数性。
2.单相离子平衡中的同离子效应,缓冲溶液的缓冲作用。
3.多相离子平衡和溶度积。
多相离子平衡的移动和溶度积规则。
沉淀的生成和溶解。
4.一般配合物的组成、分类和命名,配合物中的化学键。
配合物的解离平衡和配合物的稳定常数,配位平衡的移动。
配合物的某些应用,螯合物。
第三章氧化还原反应电化学1.氧化和还原,氧化数。
2.原电池的组成和电极反应,电极电势。
影响电极电势的因素,能斯特方程式。
电极电势在氧化还原反应、原电池中的应用。
吉布斯函数变ΔrG与原电池电动势、ΔrGP与平衡常数的关系。
3.电解和金属腐蚀的基本原理。
金属腐蚀的防护。
第四章物质结构基础1.原子结构与周期系:原子核外电子运动的特性,量子化、波-粒二象性、统计性,波函数和原子轨道、电子云。
四个量子数的取值和意义。
s、p轨道和电子云的角度分布图。
多电子原子核外电子分布的一般规律和近似能级图。
核外电子排布式、外层电子构型。
大学化学教材

大学化学教材1、大学化学/普通高等教育“十一五”国家级规划教材2、大学化学教程——高等学校教材3、新大学化学(第二版)4、大学化学——面向21世纪课程教材5、化学功能材料概论——高等学校教材6、新编普通化学/21世纪高等院校教材7、大学基础化学/高等学校教材8、大学化学9、大学化学10、大学普通化学(第六版)11、大学化学教程——21世纪高等院校教材12、大学化学13、化学实验教程——高等学校教材14、大学化学(高等学校教学用书)15、大学化学原理及应用(上下)/高等学校教材16、大学化学教程/高等学校教材17、大学基础化学/新世纪高职高专教材18、新大学化学19、大学化学原理及应用·上下册20、普通化学(英文版)21、近代高分子科学22、绿色化学与环境23、普通化学简明教程24、大学化学(第二版)——高等学校教材1、大学化学/普通高等教育“十一五”国家级规划教材•作者:金继红主编•丛书名:•出版社:化学工业出版社•ISBN:9787502597221•出版时间:2007-1-1•版次:1•印次:1•页数:403•字数:679000•纸张:胶版纸•包装:平装•开本:16开•定价:39 元当当价:30.6 元折扣:78折节省:8.40元钻石vip价:30.60 元••共有顾客评论0条内容提要本书为普通高等教育“十一五”国家级规划教材。
本书在编写过程中注意与中学化学的衔接,力求理论联系实际,概念阐述准确,深入浅出,循序渐进,便于教师教学和学生自学。
本书包括物质的聚集状态、热力学第一定律、热力学第二定律、相平衡、化学平衡、水溶液中的离子平衡(含酸碱滴定、重量分析)、氧化还原和电化学基础(含氧化—还原滴定)、原子结构、分子结构、晶体结构、配位化合物(含配位滴定)、单质和无机化合物、表面与胶体、环境化学及材料化学等内容。
本书可供高等学校非化学化工类专业对化学要求较多的材料、地质、能源、环境、冶金、海洋等专业的基础化学教学使用。
普化各章联系题以及综合习题

9. 胶粒对溶液中离子的吸附过程: ΔG<0 ,ΔS<0 ,ΔH>0 ΔS>0 ,ΔH>0 ΔG<0 , ΔS<0 ,ΔH<0 ΔG=0 , ΔS>0 ,ΔH<0 ΔG=0 ,
10. 已知:(1)N (g)+3H (g)=2NH (g); (2)N (g)+H (g)=NH (g); (3)N (g)+H (g)=NH (g)的标准平衡 2 2 3 2 2 3 2 2 3 常数分别为K θ、K θ和K θ,它们的关系是: 1 2 3 K θ=K θ=K θ 1 2 3 1/2K θ=1/3K θ 2 3 K θ=(K θ)2 θ)3 1 2 =(K3 K θ= (K θ)1/2 θ)1/3 1 2 =(K3 θ= K1
4.4. 下列分子,属于直线构型的为: PbCl 2 OF 2 HCN H O 2
5. 下列分子,偶极矩等于 0 的为: NF 3 6.下列物质 (1) CaO ; (2) MgO ; (3) NH 3 (1)>(2)>(3)>(4) (1)>(2)>(4)>(3) 7. 分子间只存在色散力的物质为: CS 2 OF 2 PbCl 2 AsH 3 HCN SnCl 2 PCl 5
5 、1 、0 、 5 、
5 、1 、1 、1/2
6 6.下列离子的电子构型可以用[Ar]3d 表示的是: 2+ Mn Fe 3+ Co 3+ Ni 2+
7.某元素基态原子的电子构型为[Ar]3d 54s2,它在周期表中的位置是: s区,ⅡA s 区,ⅤA d区,ⅡB d 区,ⅦB
8. 第一电子亲和能最大的元素、最活泼的非金属单质分别是: 2 F、F Cl、Cl 2 Cl、 F 2 F、Cl 2
普通化学第一章

有:q= -{C(H2O)+Cb} ΔT = -{4.18.g-1.K-1ⅹ1210g+848J.K-1)(294.82K-293.18K)= -9690J= -9.69KJ. 而该反应的反应进度ξ为: ξ=[0-0.500g/32.0g.mol-1]/(-1) 故该反应的摩尔反应热为: qm= q/ ξ = -620KJ.mol-1
法确定。
q 为热,指系统与环境之间由于存在温度差而交换的能量。 规定系统吸热时,q为正值; 系统放热时,q为负值。 W为功,指系统与环境之间除热以外以其他形式传 递的能量。 规定环境对体系做功,功为正值; 系统对环境做功, 功为负值。 功和热均与过程有关,因此它们都不是状态函数。
想一想:(q+w)是不是状态函数?
功的分类
功可分为体积功和非体积功两种。 体积功——因体系体积变化反抗外力作用与环境交 换的能量。又称膨胀功。 非体积功:除体积功以外的一切功称为非体积功。 又叫其他功。如表面功、电功。
功与热的微观解释
功:大量质点以有序运动方式而传递的能量 如电子的有序运动而传递的电功 质点有序运动而传递的机械功。 热:大量质点以无序运动方式而传递的能量。(通过分子之间 的碰撞) 也即功是有序能,热是无序能。 因此从能的“品位”上来说,功的“品位”比热的高。
利用弹式热量计求反应热的公式: q = -{q(H2O)+qb} =-{C(H2O)ΔT+CbΔT}
其中:q为水吸收的热量, qb为金属容器等钢弹组件吸收的热量。
利用弹式热量计所测的反应热为 定容反应热!
例1.1
将0.500gN2H4(l)在盛有1210gH2O的弹式热量计的钢弹内(通 入氧气)完全燃烧尽。吸热介质的热力学温度由293.18K上 升至294.82K。已知钢弹组件在实验温度时的总热容Cb为 848J.K-1,水的比热容为4.18J.g-1.K-1。试计算在此条件下联氨 完全燃烧所放出的热量,并根据写出的化学方程式求出该反 应的摩尔反应热。 解:首先写出该反应的化学方程式: N2H4(l)+O2(g)═N2(g)+2H2O(l) 根据公式:对于0.500gN2H4的定容燃烧热q:
普通化学 第1章 热化学与能源

北京· 中国地质大学化学教研
10
状态函数的性质
状态函数是状态的单值函数。 当系统的状态发生变化时,状态函数的变化量只与系统 的始、终态有关,而与变化的实际途径无关。 以下例子说明:当系统由始态变到终态时,系统的状态函数 压力p和体积V的变化量与途径无关。
外压从3pº 变为p° 3pº
V T
解:用化学反应通式表示为:
0= - N2 - 3H2 + 2NH3
北京· 中国地质大学化学教研
15
• 对于同一个化学反应,化学计量数与化 学反应方程式的写法有关。
例: N2(g) + 3H2(g)=2NH3(g) v(N2)=-1, v(H2)=-3, v(NH3)=2
1/2N2(g) + 3/2H2(g)=NH3(g) v(N2)=-1/2, v(H2)=-3/2, v(NH3)=1
北京· 中国地质大学化学教研
14
5. 化学计量数
一般用化学反应计量方程表示化学反应中质量守恒 关系, 通式为:
0 B B
B
B 称为B 的化学计量数。 符号规定:反应物: B为负;产物:B为正。
例:应用化学反应通式形式表示下列合成氨的化学反应计 量方程式: N2 + 3H2 =2NH3
北京· 中国地质大学化学教研
2
难点:
(1)状态函数的性质。 (2)qp与反应焓变的关系、qV与热力学能变的关系。
北京· 中国地质大学化学教研
3
1.1 反应热的测量
化学反应发生时,伴随有能量的变化,通常多以 热的形式放出或吸收。燃料燃烧所产生的热量和 化学反应中所发生的能量转换和利用都是能源的 重要课题。 热化学? 研究化学反应中热与其它能量变化的定量关系的 学科。
大学化学普通化学第五版知识点归纳
3. 磁量子数 m
m = 0,±1,±2,……±l。 决定了原子轨道(或电子云)在空间的伸展方向。 l=0,m=0,亚层只有一个球形的s轨道,无方向性。 l=1,m=0﹑±1,p亚层有三个不同伸展方向的p轨道,常用pz, px,py表示这三个不同伸展方向。 l=2,m=0﹑±1﹑±2,d亚层有5个不同伸展方向的d轨道。 当n, l, m 都确定,就决定了是哪一个主层、什么形状的亚层、 某个伸展方向的轨道。
8. 电镀,电抛光,电解加工,阳极氧化
9. 金属腐蚀与防护:
(1)化学腐蚀 (2)电化学腐蚀
析氢腐蚀; 吸氧腐蚀;氧浓差腐蚀(水线腐蚀) (3)了解防护方法
应用 :1 计算电对的标准电极电势
A
E1 z1
B
E2 z2
C
E3 z3
D
E z
z E = z1E + z2 E + z3 E
E=
z1E + z2 E + z3 E z
4. 电动势E与△G的关系
-DrG =Welec,max
DrGm= --zFE 或 DrGmθ = --zFE θ
5.电极电势的应用
(1)氧化剂和还原剂相对强弱的比较 E(O/R) O氧化能力 R还原能力
(2)氧化还原方向的判断 电动势E > 0, DrGm< 0, 正向自发
(3)氧化还原反应进行的次序 反应首先发生在电极电势差值较大的两个电对之间
3.
ΔrGm(298.15K)=
∑
v
B
Δf
G
m
(B,298.15K)
4. ΔrS m (298.15K)=∑ v B S m (B,298.15K)
第三章 基本知识点及要求
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1章热化学与能源
一、判断题:
1、热的物体比冷的物体含有更多的热量。
()
2、热是一种传递中的能量。
()
3、同一体系同一状态可能有多个热力学能。
()
4、体系的焓值等于恒压反应热。
()
5、最稳定单质的焓值等于零。
()
6、由于C a C O3分解是吸热的,所以它的标准摩尔生成焓为负值。
()
7、体系的焓等于体系的热量()
8、实验测定得到的反应热数据都是恒压反应热。
()
二、选择题
1.下列过程是吸热反应的是( )
(A) △S>0 (B) △H>0 (C) △G<0 (D) △H<0
2.体系对环境作20 kJ的功,并失去10 kJ的热给环境,则体系内能的变化是( ) (A) 30 kJ (B) 10 kJ (C) -10 kJ (D) -30 kJ
三、计算题:
1、某汽缸中有气体1.20L,在97.3 kPa下气体从环境中吸收了800J的热量后,在恒压下体积膨胀
到1.50L,试计算系统的内能变化ΔU。
2、根据Δf H mΘ的值,计算下列反应的Δr H mΘ(298K ) 是多少:
(1)4NH3(g)+ 3 O2(g)= 2N2(g)+ 6 H2O(g);
(2)CH4(g) + H2O(g)= CO(g)+ 3 H2(g)。
3、(本小题10分) SiC 是高温半导体、金属陶瓷和磨料等不可缺少的原料。
现在以硅石(SiO2)和焦炭为原料制备 SiC,反应为:
(s)+3C(石墨)===SiC(s)+2CO(g)
SiO
2
已知298K时各物质的
(s) C(石墨) SiC(s) CO(g) SiO
2
△f H (298K)/kJ·mol-1 -910.94 0 -65.3 -110.525 S(298K)/ J·mol-1·K-1 41.84 5.74 16.61 197.6 (1)计算在298K时反应的△rG,并判断 298K时能否获得 SiC ?
(2)估算在标准状态下生产 SiC 最低温度。
