钠铝铁的有关反应方程式综述
高中化学方程式钠,铝,铁全部(精选课件)

高中化学方程式钠,铝,铁全部钠及其化合物的化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O2...文档交流仅供参考...2、钠在氯气中燃烧:2Na+Cl22NaCl...文档交流仅供参考...3、钠常温条件下和氧气反应:4Na+O22Na2O...文档交流仅供参考...4、钠和硫共热:2Na+SNa2S5、钠和水反应:2Na+2H2O2NaOH+H2↑...文档交流仅供参考...6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑...文档交流仅供参考...7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2ONa2SO4+Cu(OH)2↓+H2↑...文档交流仅供参考...8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑...文档交流仅供参考...9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑...文档交流仅供参考...10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti...文档交流仅供参考...二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOH2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO3...文档交流仅供参考...3、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2OCu(OH)2↓+Na2SO4...文档交流仅供参考...5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl...文档交流仅供参考...6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlC l3NaAlO2+3NaCl...文档交流仅供参考...三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑...文档交流仅供参考...2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑...文档交流仅供参考...3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaC l+2H2O+O2↑...文档交流仅供参考...4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuS O4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑...文档交流仅供参考...5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑...文档交流仅供参考...6、向氯化铝溶液中加过量的过氧化钠:2Na2O2+Al Cl3+2H2O NaAlO2+3NaCl+O2↑...文档交流仅供参考...7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑...文档交流仅供参考...四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑...文档交流仅供参考...2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2O...文档交流仅供参考...3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O...文档交流仅供参考...4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O...文档交流仅供参考...5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑...文档交流仅供参考...6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2O...文档交流仅供参考...7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O...文档交流仅供参考...8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3...文档交流仅供参考...9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH +SO2Na2SO3+H2O...文档交流仅供参考...10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+S O2NaHSO3...文档交流仅供参考...11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2O...文档交流仅供参考...12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O...文档交流仅供参考...13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2O...文档交流仅供参考...14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O...文档交流仅供参考...15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2O...文档交流仅供参考...16、盐酸和氢氧化钠溶液反应:HCl+NaOHNaC l+H2O...文档交流仅供参考...17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2O...文档交流仅供参考...18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2Na OHNa2S+2H2O...文档交流仅供参考...19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOHNaHS+H2O...文档交流仅供参考...20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOHNa2SO4+2H2O...文档交流仅供参考...21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2O...文档交流仅供参考...22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3 +NaOHNaAlO2+2H2O...文档交流仅供参考...23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+N aOH AgOH ↓+NaNO3...文档交流仅供参考...24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓...文档交流仅供参考...25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaO HFe(OH)3↓+3NaCl...文档交流仅供参考...26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOHAl(OH)3↓+3NaCl...文档交流仅供参考...27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2O...文档交流仅供参考...28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOHNaCl+NH3↑+H2O...文档交流仅供参考...29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOHNaHCO3+NH3↑+H2O ...文档交流仅供参考...30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2O...文档交流仅供参考...31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOHNa2CO3+H2O...文档交流仅供参考...32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2 +NaOHCaCO3↓+NaHCO3+H2O...文档交流仅供参考...33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O...文档交流仅供参考...34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2 +2NaOH Mg(OH)2↓+2NaHCO3...文档交流仅供参考...35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2 +4NaOH Mg(OH)2↓+Na2CO3+2H2O...文档交流仅供参考...五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3...文档交流仅供参考...2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑...文档交流仅供参考...3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑...文档交流仅供参考...4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑...文档交流仅供参考...六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOH...文档交流仅供参考...2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaCl...文档交流仅供参考...3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOH...文档交流仅供参考...4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HClNaHCO3+NaCl...文档交流仅供参考...5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2O...文档交流仅供参考...6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O...文档交流仅供参考...7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3...文档交流仅供参考...8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3...文档交流仅供参考...9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑...文档交流仅供参考...10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑...文档交流仅供参考...七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOH...文档交流仅供参考...2、碳酸氢钠溶液滴入盐酸:NaHCO3+HClNaCl+CO2↑+H2O...文档交流仅供参考...3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOHCH3COONa+CO2↑+H2O...文档交流仅供参考...4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑...文档交流仅供参考...5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeC l3Fe(OH)3↓+3NaCl+3CO2↑...文档交流仅供参考...6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O...文档交流仅供参考...7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2O...文档交流仅供参考...8、碳酸氢钠溶液中加入少量氢氧化钙溶液: 2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2O...文档交流仅供参考...9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O...文档交流仅供参考...铝及其化合物的化学方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O3...文档交流仅供参考...2、铝在氯气中燃烧:2Al+3Cl22AlCl3...文档交流仅供参考...3、铝和硫共热:2Al+3SAl2S3...文档交流仅供参考...4、铝与稀硫酸反应:2Al+3H 2SO4Al2(SO4)3+3H2↑...文档交流仅供参考...5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H 2O2N aAlO2+3H2↑...文档交流仅供参考...6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O...文档交流仅供参考...7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2O...文档交流仅供参考...8、铝和稀硝酸反应:Al+4HNO 3Al(NO3)3 +NO ↑+2H2O ...文档交流仅供参考...8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3Ag...文档交流仅供参考...9、铝与硫酸铜溶液反应:2Al+3CuSO 4Al2(SO4)3+3Cu...文档交流仅供参考...10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe...文档交流仅供参考...11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe ...文档交流 仅供参考...12、铝和氧化铜高温共热:2Al+3CuO Al 2O3+3Cu ...文档交流 仅供参考...13、铝和二氧化锰高温共热:4Al+3MnO 22Al 2O 3+3Mn ...文档交流 仅供参考...二、氧化铝1、氧化铝与稀硫酸反应:A l2O 3+3H2SO 4Al 2(SO 4)3 +3H 2O ...文档交流 仅供参考...2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaO H2NaA lO 2+H 2O...文档交流 仅供参考...3、电解氧化铝的熔融液:2Al 2O34Al+3O 2 ↑ 三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al (OH )3 +3H 2SO 4Al 2(SO 4)3 +6H 2O ...文档交流 仅供参考...2、氢氧化铝与氢氧化钠溶液反应:Al(O H)3 +NaO HNaAlO 2+2H 2O ...文档交流 仅供参考...3、加热氢氧化铝:2Al(OH )3Al 2O 3+3H 2O ...文档交流 仅供参考... 四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:A l2(SO 4)3 +3BaCl 22AlCl 3+3B aS O4 ↓...文档交流 仅供参考...2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O2Al (OH )3 +3H 2SO 4...文档交流 仅供参考...冰晶石 电解3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na 2SO4+2Al(OH)3↓...文档交流仅供参考...4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3 +8NaOH2NaAlO2+3Na2SO4+4H2O...文档交流仅供参考...5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaS O4↓...文档交流仅供参考...6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al 2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O...文档交流仅供参考...7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2 +2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4...文档交流仅供参考...8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2O...文档交流仅供参考...9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH 3·H2O2Al(OH)3↓+3(NH4)2SO4...文档交流仅供参考...10、向硫酸铝溶液中加入碳酸钠溶液:Al 2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑...文档交流仅供参考...11、向硫酸铝溶液中加入碳酸氢钠溶液:Al 2(SO4)3 +6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑...文档交流仅供参考...12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑...文档交流仅供参考...13、向硫酸铝溶液中加入硫氢化钠溶液:Al 2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3N a2SO4+6H2S ↑...文档交流仅供参考...14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓...文档交流仅供参考...15、向硫酸铝溶液中加入偏铝酸钠溶液:Al 2(SO4)3 +6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓...文档交流仅供参考...五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO 2+2H2O AI(OH)3+NaOH...文档交流仅供参考...2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl↓...文档交流仅供参考...3、向偏铝酸钠溶液加入足量盐酸:NaAlO 2+4HCl NaCl+AlCl3+2H2O...文档交流仅供参考...4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO3...文档交流仅供参考... 5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO 2+2H2O Al(OH)3 +NaHCO3...文档交流仅供参考...6、向偏铝酸钠溶液中加入硫酸铝溶液:Al 2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓...文档交流仅供参考...7、向偏铝酸钠溶液中加氯化铵:NaAlO2+NH4Cl +H 2O Al(OH)3↓+NaCl+NH3↑...文档交流仅供参考...8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO 2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl...文档交流仅供参考...铁及其化合物的化学方程式一、铁1、铁在氧气中燃烧:3Fe+2O2Fe3O4...文档交流仅供参考...2、铁在氯气中燃烧:2Fe+3Cl22FeCl3...文档交流仅供参考...3、常温条件下铁锈的形成:4Fe+3O 2+2H2O2[Fe2O3·H2O]...文档交流仅供参考...4、高温条件铁与氧气反应:2Fe+O22FeO...文档交流仅供参考...5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H2...文档交流仅供参考...7、铁与稀硫酸反应:Fe+H 2SO4FeSO4+H2↑...文档交流仅供参考...8、少量的铁与浓硫酸共热:2Fe+6H2SO4Fe2(SO4)3+3SO2↑+6H2O...文档交流仅供参考...9、过量的铁与浓硫酸共热:Fe+2H2SO4FeSO4+SO2↑+2H2O...文档交流仅供参考...10、少量的铁与浓硝酸共热:Fe+6HNO3Fe(NO3)3+3NO2↑+3H2O...文档交流仅供参考...11、过量的铁与浓硝酸共热:Fe+4HNO3Fe(NO3)2+2NO2↑+2H2O...文档交流仅供参考...12、少量的铁与稀硝酸反应:Fe+4HNO 3Fe(NO3)3 +NO↑+2H2O...文档交流仅供参考...13、过量的铁与稀硝酸反应: 3Fe+8HNO33Fe(NO3)2 +2NO ↑+4H2O...文档交流仅供参考...14、铁与硫酸铜溶液反应:Fe+CuSO 4FeSO4+Cu...文档交流仅供参考...15、铁与硝酸银溶液反应:Fe+2AgNO 3Fe(NO3)2+2Ag...文档交流仅供参考...16、铁与氯化铁溶液反应:Fe+2FeCl 33FeCl2...文档交流仅供参考...二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O22Fe3O4...文档交流仅供参考...2、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO2...文档交流仅供参考...3、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe...文档交流仅供参考...4、氧化亚铁与稀硫酸反应:FeO+H 2SO4FeSO4+H2O...文档交流仅供参考...5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O...文档交流仅供参考...6、氧化亚铁与浓硝酸反应:FeO+4HNO3Fe(NO3)3+NO2↑+2H2O...文档交流仅供参考...7、氧化亚铁与稀硝酸反应:3FeO+10HNO 33Fe(NO3)3+NO↑+5H2O...文档交流仅供参考...三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe...文档交流仅供参考...2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO2...文档交流仅供参考...3、四氧化三铁溶于稀盐酸:Fe 3O4+8HClFeCl2+2FeCl3+4H2O...文档交流仅供参考...4、四氧化三铁溶于浓硫酸:2Fe 3O4+10H2SO43Fe2(SO4)3+SO2↑+10H2O...文档交流仅供参考...5、四氧化三铁溶于浓硝酸:Fe 3O4+10HNO33Fe(NO3)3+NO2↑+5H2O...文档交流仅供参考...6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO 3)3+NO ↑+14H2O...文档交流仅供参考...6、四氧化三铁溶于氢碘酸:Fe 3O4+8HI3FeI2+I2+4H2O...文档交流仅供参考...四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe...文档交流仅供参考...2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe +3CO2...文档交流仅供参考...3、氧化铁溶液稀盐酸:Fe 2O3+6HCl2FeCl3+3H2O...文档交流仅供参考...4、氧化铁与氢碘酸反应:Fe 2O3+6HI2FeI2+I2+3H2O...文档交流仅供参考...五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O...文档交流仅供参考...2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4Fe2(SO4)3 +SO2↑+6H2O...文档交流仅供参考...3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3Fe(NO3)3+NO2↑+3H2O...文档交流仅供参考...4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3 +NO↑+8H2O...文档交流仅供参考...5、氢氧化亚铁在空气中被氧化:4Fe(OH)2 +O2+2H2O4Fe(OH)3...文档交流仅供参考...6、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O...文档交流仅供参考...7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O...文档交流仅供参考...六、氢氧化铁1、氢氧化铁与稀硫酸反应:2Fe(OH)3+3H2SO4Fe2(SO4)3+6H2O...文档交流仅供参考...2、氢氧化铁溶于氢碘酸:2Fe(OH)3+6HI2FeI2+I2+6H2O...文档交流仅供参考...3、加热氢氧化铁:2Fe(OH)3Fe2O3+3H2O...文档交流仅供参考...七、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl 22AlCl3+3Fe...文档交流仅供参考...2、锌与氯化亚铁反应:Zn+FeCl2ZnCl2+Fe...文档交流仅供参考...3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H 2O8FeCl3+4Fe(OH)3↓...文档交流仅供参考...4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O...文档交流仅供参考...5、氯化亚铁溶液中通入氯气:2FeCl 2+Cl22FeCl3...文档交流仅供参考...6、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl 3+2FeBr3...文档交流仅供参考...7、氯化亚铁溶液呈酸性:FeCl 2+2H2O Fe(OH)2 +2HCl...文档交流仅供参考...8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2↓+2NaCl...文档交流仅供参考...9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2OFe(OH)2↓+2NH4Cl...文档交流仅供参考...10、氯化亚铁溶液中加入偏铝酸钠溶液:FeCl 2+2NaAlO2+4H2O Fe(OH)2↓+2Al(OH)3↓+2NaCl...文档交流仅供参考...11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO 3Fe(NO3)2 +2AgCl↓...文档交流仅供参考...12、氯化亚铁溶液中加入硫化钠溶液:FeCl 2+Na2SFeS↓+2NaCl...文档交流仅供参考...13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4Fe2(SO4)3+SO2↑+2H2O...文档交流仅供参考...14、硝酸亚铁溶液与浓硝酸反应:Fe(NO 3)2+2HNO3Fe(NO3)3 +NO2↑+H2O...文档交流仅供参考...15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O...文档交流仅供参考...16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl 3+2H2O...文档交流仅供参考...17、过氧化钠与氯化亚铁溶液反应:4Na 2O2+4FeCl2+6H2O4Fe(OH)3↓+8NaCl+O2↑...文档交流仅供参考...18、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5Na Cl+4HClO...文档交流仅供参考...八、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl 32FeCl2+ZnCl2...文档交流仅供参考...2、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe...文档交流仅供参考...3、铁与氯化铁溶液反应:Fe+2FeCl 33FeCl2...文档交流仅供参考...4、铜和氯化铁溶液反应:Cu+2FeCl 32FeCl2+CuCl 2...文档交流仅供参考...5、向氯化铁溶液中通入二氧化硫:2FeCl3+SO 2+2H2O2FeCl2+H2SO4+2HCl...文档交流仅供参考...6、氯化铁溶液呈酸性:FeCl 3+3H2O Fe(OH)3+3HCl...文档交流仅供参考...7、氯化铁溶液中加入氢氧化钠溶液:FeCl 3+3NaOHFe(OH)3↓+3NaCl...文档交流仅供参考...8、向氯化铁溶液中加入氨水:FeCl 3+3NH3·H2O Fe(OH)3↓+3NH4Cl...文档交流仅供参考...9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑...文档交流仅供参考...10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑...文档交流仅供参考...11、向氯化铁溶液中加入偏铝酸钠溶液:FeCl3+3NaAlO2+6H2O Fe(OH)3↓+3Al(OH)3↓+3NaCl...文档交流仅供参考...12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2OFe(OH)3↓+3NaCl+3HClO...文档交流仅供参考...13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓+2HCl...文档交流仅供参考...14、向氯化铁溶液中加入氢碘酸:2FeCl 3+2HI2FeCl2+I2+2HCl...文档交流仅供参考...15、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓ +2NaCl...文档交流仅供参考...16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na 2S2FeS↓+S↓ +6NaCl...文档交流仅供参考...17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2F eCl2+I2+2KCl...文档交流仅供参考...18、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓+Fe(NO 3)3...文档交流仅供参考...19、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3 +3KCl...文档交流仅供参考...20、氧化镁投入到氯化铁溶液中: 3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)3...文档交流仅供参考...21、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2 +2FeCl 33MgCl2+2Fe(OH)3...文档交流仅供参考...21 / 21·····谢阅。
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
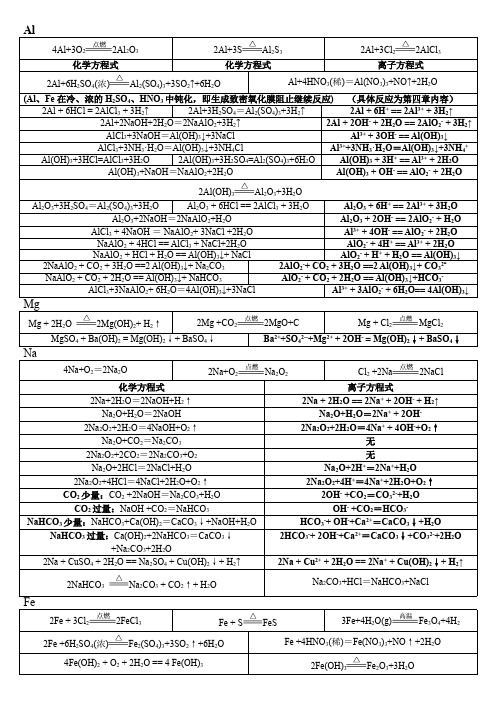
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
铁、钠、铝知识点和方程式总结

NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O+CO2↑★ 加热分解
2NaHCO3=Na2CO3+H2O+CO2↑★ 不反应
NaHCO3+NaOH=Na2CO3+H2O HCO3-+OH-=H2O+CO32-★
也能反应生成 CaCO3 沉淀
不反应 发酵粉、灭火剂、治疗胃酸过多(有胃
滴加酚酞,变红后又褪色。
(三)钠盐:Na2CO3 与 NaHCO3 的性质比较
Na2CO3
俗称
纯碱、苏打(纯碱不是碱,溶液显碱性)
NaHCO3 小苏打
水溶性比较 溶液酸碱性
碱性
Na2CO3 > NaHCO3
碱性
与酸反应剧烈程度
较慢(二步反应)
较快(一步反应)
与酸反应
热稳定性 与 CO2 反应 与 NaOH 溶液反应 与 Ca(OH)2 溶液反 应 与 CaCl2、溶液反应 用途
钠镁铝铁及其化合物方程式和离子方程式锦集

Na、Mg、Al、Fe及其化合物的化学方程式和离子方程式一、Na及其化合物的化学方程式和离子方程式(1)Na的反应1、钠和水反应:方程式: 2Na+2H2O=2NaOH+H2↑ 离子方程式: 2Na+2H2O=2Na+2OH-+H2↑2.钠分别和氧气、硫、氯气:2Na+O2点燃Na2O2 (或加热) 4Na+O2=2Na2O2Na+S=Na2S 2Na+Cl2点燃2NaCl3.钠分别和盐酸(或硫酸)、醋酸方程式: 2Na+2HCl=2NaCl+H2↑ 离子方程式: 2Na+2H+=2Na++H2↑方程式: 2Na+H2SO4=Na2SO4+H2↑ 离子方程式: 2Na+2H+=2Na++H2↑方程式:2Na+2CH3COOH=2CH3COONa+H2↑离子方程式: 2Na+2CH3COOH=2CH3COO-+2Na++H2↑4.钠分别和硫酸铜溶液、氯化铁溶液方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑离子方程式: 2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑方程式: 6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑离子方程式:6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑(2)Na的氧化物反应1.氧化钠分别与水、盐酸方程式: Na2O+H2O=2NaOH 离子方程式: Na2O+H2O=2Na++2OH-方程式: Na2O+2HCl=2NaCl+H2O 离子方程式: Na 2O+2H+=2Na++H2O2.过氧化钠分别与盐酸、水方程式: 2Na2O2+4HCl=4NaCl+2H2O+O2↑离子方程式: 2Na2O2+4H+ =4Na++2H2O+O2↑方程式: 2Na2O2+2H2O=4NaOH+O2↑离子方程式: 2Na2O2+2H2O=4Na++4OH-+O2↑3.过氧化钠分别与二氧化碳:2Na2O2+2CO2=2Na2CO3+O2(3)Na2CO3、NaHCO3盐的反应1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na2CO3、NaHCO3的方法)碳酸钠受热不分解2NaHCO3△Na2CO3+H2O+CO2↑2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应少量的盐酸时:Na2CO3+HCl=NaHCO3 +NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O过量的盐酸时:Na2CO3+2HCl=2NaCl+CO2↑+H2O CO32-+2H+=CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O3.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的醋酸反应少量的醋酸时:Na2CO3+CH3COOH=NaHCO3+CH3COONaCO32-+ CH3COOH=HCO3-+ CH3COO-NaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-过量的醋酸时:Na2CO3+2CH3COOH=2CH3COONa+ CO2↑+H2OCO32-+ 2CH3COOH=2CH3COO-+CO2↑+H2ONaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-4.二氧化碳通入到碳酸钠溶液中(或通入到饱和的碳酸钠溶液中)CO2+Na2CO3+H2O=2 NaHCO3CO2+CO32-+H2O=2 HCO3-或CO2+Na2CO3+H2O=2 NaHCO3↓ CO2+2Na++CO32-+H2O=2 NaHCO3↓5.碳酸钠溶液与澄清石灰水(或氢氧化钠溶液)混合方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式: CO32-+ Ca2+=CaCO3↓碳酸钠溶液与氢氧化钠溶液混合不发生反应6. 碳酸氢钠与少量(或过量)的澄清石灰水混合(类似:澄清石灰水可以改为氢氧化钡溶液)少量澄清石灰水:2NaHCO3+Ca(OH)2=2H2O+CaCO3↓+ Na2CO32 HCO3-+Ca2++2OH-=2H2O+CaCO3↓+ CO32-过量澄清石灰水:NaHCO3+Ca(OH)2=H2O+CaCO3↓+ NaOHHCO3-+Ca2++OH-=H2O+CaCO3↓7.碳酸氢钠与氢氧化钠溶液混合方程式: NaHCO3+ NaOH=Na2CO3+ H2O 离子方程式: HCO3-+OH-=H2O+CO32-8.电解熔融状态的氯化钠、电解饱和食盐水(注意电极反应式的书写)2NaCl(熔融)=Na+Cl2↑2NaCl+2H2O电解Cl2↑+H2↑+2NaOH2Cl-+2H2O电解Cl2↑+H2↑+2OH-9.碳酸钠溶液、碳酸氢钠溶液滴2滴酚酞试液都呈色,为什么?(用方程式或离子方程式表示) 溶液呈红色CO32-+H2O HCO3-+OH-溶液呈碱性HCO3-+H2O H2CO3 + OH-溶液呈碱性二、Mg 、Al 及其化合物的化学方程式和离子方程式 (1)Mg 的反应1.镁在空气中燃烧2Mg + O 2 2MgO 3Mg +N 2 Mg 3N 2 2Mg + CO 2 2MgO + C 2.镁能溶解在氯化铵溶液中Mg + 2NH 4Cl = MgCl 2 + H 2↑+ NH 3↑ Mg + 2NH 4+ = Mg 2+ + H 2↑+ NH 3↑ (2) Al 的反应3.铝是活泼金属,为什么可以直接存放在空气中,用简单的文字和方程式说明:4Al+3O 2=2Al 2O 3 在铝的表面形成致密的氧化铝薄膜,将铝和空气隔绝。
铁、钠、铝知识点和方程式总结

钠铝及重要化合物知识点小结(★为必背方程式)一、钠及其化合物(一)钠 Na1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。
★2、单质钠的化学性质: ① 钠与O 2反应常温下:4Na + O 2=2Na 2O ★(新切开的钠放在空气中容易变暗)加热时:2Na + O 2==Na 2O 2 ★(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na 2O 2。
)钠在空气中的变化过程:Na ―→Na 2O ―→NaOH ―→Na 2CO 3·10H 2O (结晶)―→Na 2CO 3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na 2O ),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH 易潮解),最终变成白色粉未(最终产物是Na 2CO 3)。
② 钠与H 2O 反应2Na +2H 2O =2NaOH +H 2↑ ★离子方程式:2Na ++2H 2O =2Na ++2OH -+H 2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH 遇酚酞变红”。
③ 钠与盐溶液反应如钠与CuSO 4溶液反应,应该先是钠与H 2O 反应生成NaOH 与H 2,再和CuSO 4溶液反应,有关化学方程式: 2Na +2H 2O =2NaOH +H 2↑ CuSO 4+2NaOH =Cu(OH)2↓+Na 2SO 4 总的方程式:2Na +2H 2O +CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K 、Ca 、Na 三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应④ 钠与酸反应:2Na +2HCl =2NaCl +H 2↑(反应剧烈) 离子方程式:2Na +2H +=2Na ++H 2↑3、钠的存在:以化合态存在。
2020金属及其化合物的常用化学方程式和对应离子方程式(钠镁铝铁)
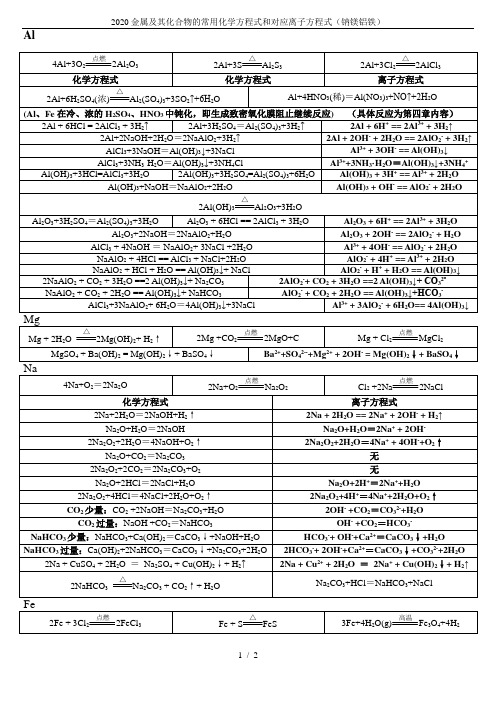
4Al+3O2 2Al2O3
2Al+3S Al2S3
2Al+3Cl2 2AlCl3
化学方程式
化学方程式
离子方程式
2Al+6H2SO4(浓) Al2(SO4)3+3SO2↑+6H2O
Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O
(Al、Fe在冷、浓的H2SO4、HNO3中钝化,即生成致密氧化膜阻止继续反应)(具体反应为第四章内容)
2HCO3-+2OH-+Ca2+=CaCO3↓+CO32-+2H2O
2Na + CuSO4+ 2H2O=Na2SO4+ Cu(OH)2↓+ H2↑
2Na + Cu2++ 2H2O=2Na++ Cu(OH)2↓+ H2↑
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+HCl=NaHCO3+NaCl
2FeCl3+Cu=2FeCl2+CuCl2(用于雕刻铜线路板)
2Fe3++ Cu == 2Fe2++ Cu2+
2FeCl3+2KI=2FeCl2+2KCl+I2
2Fe3++2I-=2Fe2++I2
2FeCl3+H2S=2FeCl2+2HCl+S↓
2Fe3++ H2S == 2Fe2++ S↓+ 2H+
Fe
2Fe + 3Cl2 2FeCl3
钠镁铝所有方程式总结【最全】

钠及其化合物的方程式总结一、Na 单质1、钠在空气中燃烧(黄色的火焰):2Na + O 2 Na 2O 22、钠块在空气中变暗 :4Na + O 2=2Na 2O3、Na 2O 在空气中加热(变黄):2Na 2O + O 2 2Na 2O 24、金属锂在空气中燃烧 :4Li + O 2 2Li 2O5、钠与水反应(浮、熔、游、响、红) 2Na + 2H 2O = 2NaOH + H 2 ↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2 ↑ 二、Na 2O 、Na 2O 2的相关反应:1、碱性氧化物Na 2O 与水的反应 :Na 2O +H 2O =2NaOH2、过氧化钠与水的反应(放热反应、Na 2O 2是强氧化剂,可用于漂白) 2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ 2Na 2O 2 + 2H 2O = 4Na ++ 4OH -+O 2↑3、碱性氧化物Na 2O 与CO 2的反应Na 2O + CO 2 = Na 2CO 34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、Na 2O + SO 2 = Na 2SO 3 Na 2O 2 + SO 2 = Na 2SO 46、Na 2O + 2HCl = 2NaCl + H 2O7、2Na 2O 2 +4HCl = 4NaCl + 2H 2O + O 2 ↑ 三、NaHCO 3与Na 2CO 31、小苏打受热分解: 2NaHCO 3Na 2CO 3 + H 2O +CO 2 ↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO 3 + NaOHNa 2CO 3 + H 2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO 3+NaOH = Na 2CO 3+H 2O HCO 3-+OH - = H 2O +CO 32- 4、向NaOH 溶液中通入少量CO 2 :2NaOH + CO 2 = Na 2CO 3 + H 2O△△△△5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑7、Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2 =CaCO3↓+2NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3+CaCl2 =CaCO3↓+2 Na ClNaHCO3溶液与CaCl2 不反应铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O6、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O 2NaAlO2+3H2↑2Al+2OH-+2H2O 2AlO2-+3H2↑7、铝和浓硝酸共热:Al+6HNO3 Al(NO3)3+3NO2↑+3H2O Al+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2O Al+4H++NO3-Al3++NO ↑+2H2O9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu 2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4 Al2(SO4)3+3H2O Al2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2O Al2O3+2OH-2AlO2-+H2O3、电解氧化铝的熔融液:2Al 2O 3 4Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应: 2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应: Al(OH)3 +NaOHNaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合: Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓ SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性: Al 2(SO 4)3+6H 2O2Al(OH)3 +3H 2SO 4 Al 3++3H 2OAl(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液: Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓ Al 3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH2NaAlO 2+3Na 2SO 4+4H 2O Al 3++4OH -AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH -2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液: Al 2(SO 4)3 +4Ba(OH)2Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O2Al 3++3SO 42-+3Ba 2++8OH -2AlO 2-+3BaSO 4 ↓+4H 2O7、向明矾溶液中加入少量的氢氧化钡溶液: 3Ba(OH)2 +2KAl(SO 4)22Al(OH)3 ↓+3BaSO 4 ↓+K 2SO 43Ba 2++6OH -+2Al 3++3SO 42-3BaSO 4 ↓+2Al(OH)3 ↓冰晶石电解8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O Al(OH)3+NaOH AlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl AlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O AlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓铁及其化合物的化学方程式和离子方程式一、Fe单质1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3 ·H2O]4、高温条件铁与氧气(Fe过量)反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2 ↑ Fe+2H+Fe2++H2 ↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2 ↑+6H2O9、少量的铁与浓硝酸共热:Fe+6HNO3(浓) Fe(NO3)3+3NO2 ↑+3H2O Fe+6H++3NO3-Fe3++3NO2 ↑+3H2O10、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑ +2H2O Fe+4H++NO3-Fe3++NO ↑+2H2O11、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O 3Fe+8H++2NO3-3Fe2++2NO +4H2O12、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu Fe+Cu2+Fe2++Cu13、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag Fe+2Ag+Fe2++2Ag14、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2 Fe+2Fe3+3Fe2+二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O2 2Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O FeO+2H+Fe2++H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3(浓)Fe(NO3)3+NO2 ↑+2H2O FeO+4H++NO3-Fe3++NO2 ↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O 3FeO+10H++NO3-3Fe3++NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O Fe3O4+8H+Fe2++2Fe3++4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO4(浓)3Fe2(SO4)3+SO2 ↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO3(浓)3Fe(NO3)3+NO2 ↑+5H2OFe3O4+10H++NO3-3Fe3++NO↑ +5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO3)3+NO ↑+14H2O3Fe3O4+28H++NO3-9Fe3++NO ↑+14H2O7、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O Fe3O4+8H+3Fe2++I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O Fe2O3+6H+2Fe3++3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O Fe2O3+6H++2I-2Fe2++I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O Fe(OH)2+2H+Fe2++2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3(浓)Fe(NO3)3+NO2 ↑+3H2OFe(OH)2+4H++NO3-Fe3++NO2 ↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑ +8H2O3Fe(OH)2+10H++NO3-3Fe3++NO↑ +8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe 2Al+3Fe2+2Al3++3Fe2、锌与氯化亚铁溶液反应:Zn+FeCl2ZnCl2+Fe Zn+Fe2+Zn2++Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3 ↓ 12Fe2++3O2+6H2O8Fe3++4Fe(OH)3 ↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O 4Fe2++O2+4H+4Fe3++2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-6、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-7、氯化亚铁溶液呈酸性:FeCl2+2H2O Fe(OH)2+2HCl Fe2++2H2O Fe(OH)2+2H+8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2 ↓+2NaCl Fe2++2OH-Fe(OH)2 ↓9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl Fe2++2NH3·H2O Fe(OH)2↓+2NH4+10、氯化亚铁溶液中加入四羟基铝酸钠溶液:FeCl2+2Na[Al(OH)4] Fe(OH)2 ↓+2Al(OH)3 ↓+2NaClFe2++2[Al(OH)4]-+4H2O2Al(OH)3 ↓+Fe(OH)2 ↓11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓Ag++Cl-AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl Fe2++S2-FeS↓13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4(浓)Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3(浓)Fe(NO3)3+NO2↑+H2OFe2++2H++NO3-Fe3++H2O+NO2↑15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O3Fe2++10H++NO3-3Fe3++NO↑ +5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O 2Fe2++H2O2+2H+2Fe3++2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3 ↓+8NaCl+O2 ↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O218、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO2Fe2++5ClO-+5H2O2Fe(OH)3↓+Cl-+4HClO19、硫酸酸化的酸性高锰酸钾与氯化亚铁溶液反应5FeCl2+KMnO4+4H2SO4=3FeCl3+Fe2(SO4)3+MnSO4 +KCl+4H2O5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O七、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl2Zn+2Fe3+2Fe2++Zn2+2、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe 3Zn+2Fe 3+3Zn 2++2Fe3、铁与氯化铁溶液反应:Fe +2FeCl 33FeCl2Fe+2Fe3+3Fe2+4、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+5、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl2Fe3++SO2+2H2O2Fe2++4H++SO42-6、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HCl Fe3++3H2O Fe(OH)3+3H+7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl Fe3++3OH-Fe(OH)3↓8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl Fe3++3NH3·H2O Fe(OH)3↓+3NH4+9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑2Fe3++3CO32-+3H2O2Fe(OH)3↓+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑Fe3++3HCO3-2Fe(OH)3↓+3CO2↑11、向氯化铁溶液中加入四羟基合氯酸钠溶液:FeCl3+3Na[Al(OH)4] Fe(OH)3↓+3Al(OH)3↓+3NaClFe3++3[Al(OH)4]-Fe(OH)3↓+3Al(OH)3↓12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClOFe3++3ClO-+3H2O Fe(OH)3↓+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓ +2HCl 2Fe 3++H 2S 2Fe 2++S ↓+2H +14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl 2Fe3++2I-2Fe2++I215、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓ +2NaCl 2Fe3++S2-2Fe2++S ↓16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓ +6NaCl 2Fe3++3S2-2FeS+S ↓17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl 2Fe3++2I-2Fe2++I218、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓ +Fe(NO3)3Ag++Cl-AgCl↓19、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl Fe3++3SCN-Fe(SCN) 320、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3。
高中化学金属及化合物方程式

高中化学方程式金属及其化合物重要方程式一、金属钠及其化合物的方程式1、铁与水蒸气反应:3Fe+4H2O(g)△Fe3O4+4H22、铝在氧气中受热:4Al+3O2△2Al2O33、钠在氯气中燃烧: 2Na+Cl2点燃2NaCl4、钠和水反应:2Na+2H2O=2NaOH+H2↑离子方程式:2Na+2H2O=2Na+2OH-+H2↑5、钠和盐酸反应:2Na+2HCl=2NaCl+H2↑离子方程式:2Na+2H+=2Na++H2↑6、钠投入到硫酸铜溶液:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑离子方程式:2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑7、氧化钠和水反应: Na2O+H2O=2NaOH8、过氧化钠和水反应:2Na2O2+2H2O=4NaOH+O2↑9、氧化钠和CO2反应:Na2O+CO2=Na2CO310、过氧化钠和CO2反应: 2Na2O2+2CO2=2Na2CO3+O211、氧化钠和盐酸反应:Na2O+2HCl=2NaCl+H2O12、Na2O2和盐酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑13、沉淀法鉴别碳酸钠和碳酸氢钠原理: CaCl2+Na2CO3=CaCO3↓+2NaCl离子方程式:Ca2++CO32-=CaCO3↓14、加热法鉴别固体Na2CO3、NaHCO3原理:2NaHCO3△Na2CO3+H2O+CO2↑15、碳酸钠溶液和足量盐酸反应:Na2CO3+2HCl=NaCl+H2O+CO2↑离子方程式:CO32-+2H+=H2O+CO2↑16、碳酸氢钠和盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑离子方程式:HCO3-+H+=H2O+CO2↑17、碳酸钠溶液和氢氧化钙溶液反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH离子方程式:Ca2++CO32-=CaCO3↓18、碳酸氢钠溶液和足量氢氧化钙溶液反应:Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O 19、碳酸氢钠溶液和少量氢氧化钙溶液反应:Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3 +2H2O离子方程式:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O二、金属铝及其化合物的方程式1、铝和盐酸反应:2Al+6HCl=2AlCl3+3H2↑离子方程式:2Al+6H+=2Al3++3H2↑2、铝和NaOH溶液反应: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑3、氧化铝和盐酸反应:Al2O3+6HCl=2AlCl3+3H2O4、氧化铝和氢氧化钠反应:Al2O3+2NaOH=2NaAlO2+H2O5、氢氧化铝和盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O6、氢氧化铝和氢氧化钠反应:Al(OH)3+NaOH=NaAlO2+2H2O7、氢氧化铝的制备:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+8、明矾净水原理: Al3++3H2O Al(OH)3(胶体)+3H+9、向氯化铝溶液中滴加氢氧化钠溶液至过量:Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2O10、向氢氧化钠溶液中滴加氯化铝溶液至过量:Al3++4OH-=AlO2-+2H2O3AlO2-+Al3++6H2O=4Al(OH)3↓11、向偏铝酸钠溶液中滴加盐酸至过量: AlO2-+H++H2O=Al(OH)3↓Al(OH)3+3H+=Al3++3H2O12、向盐酸中滴加偏铝酸钠溶液至过量:AlO2-+4H+=Al3++2H2O三、金属铁及其化合物的相互转化1、铁和水蒸气高温下反应:3 Fe+4H2O(g)高温Fe3O4+4H2铁在纯氧燃烧:3Fe + 2O2点燃Fe3O4铁在氯气中燃烧:2Fe+3Cl2 = 2FeCl3 铁和硫粉共热:Fe+S △FeS 2、铁和盐酸反应: Fe+2HCl= FeCl2+H2↑离子方程式: Fe+2H+= Fe2++H2↑铁和氯化铜反应:Fe+CuCl2= FeCl2+Cu 离子方程式: Fe+Cu2+= Fe2++Cu 3、氧化亚铁和盐酸反应:FeO+2HCl= FeCl2+H2O离子方程式:FeO+2H+= Fe2++H2O4、氧化铁和盐酸反应:Fe2O3+6HCl=2 FeCl3+3H2O离子方程式:Fe2O3+6H+= 2Fe2++3H2O5、氯化亚铁和氢氧化钠反应:FeCl2+2NaOH = Fe(OH)2↓+2NaCl离子方程式:Fe2++2OH-= Fe(OH) 2↓6、氢氧化亚铁和盐酸反应:Fe(OH)2 + 2HCl= FeCl2+2H2O离子方程式:Fe(OH)2+2H+= Fe2++2H2O7、氯化铁和氢氧化钠反应:FeCl3+3NaOH = Fe(OH)3↓+3NaCl离子方程式:Fe3++3OH-= Fe(OH) 3↓8、氢氧化铁和盐酸反应:Fe(OH) 3+3HCl= FeCl3+3H2O离子方程式:Fe(OH) 3+3H+=Fe3++3H2O)9、氯化亚铁和氯气反应:2FeCl2+Cl2=2FeCl3离子方程式:2Fe2++Cl2=2 Fe3++2Cl—10、铁和氯化铁反应:Fe+2FeCl3 = 3FeCl2离子方程式:Fe +2 Fe3+=3 Fe2+铜和氯化铁反应:Cu+2FeCl3=2FeCl2+CuCl2离子方程式:Cu+2 Fe3+=2 Fe2++Cu2+11、氢氧化铁受热分解:2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色(氢氧化亚铁转化为氢氧化铁)4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3铜及其化合物2Cu +O2==2CuO (红色变为黑色) 2Cu +S==Cu2SCu+ Cl2==CuCl2 (棕黄色烟) 2H2SO4(浓)+Cu==CuSO4+2H2O +SO2↑3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O2FeCl3+Cu===2FeCl2+CuCl2 (腐蚀铜线路板) 2AgNO3+Cu===2Ag+Cu(NO3)2CuO+2HCl=CuCl2+H2O CuO+H2==Cu+H2O(Cu的冶炼)CuO+CO==Cu+ CO2 3CuO+2NH3 3Cu + N2 + 3H2O Cu(OH)2+2HCl=CuCl2+2H2O Cu(OH)2 ==CuO + H2OCuCl2+H2S=CuS↓+2HCl CuCl2+2NaOH=Cu(OH)2↓+2NaClCuSO4+H2S=CuS↓+H2SO4 CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓CuSO4•5H2O===CuSO4+5H2O↑ CuSO4 + 5H2O=CuSO4•5H2O2Cu + O2 + H2O +CO2=Cu2(OH)2CO3 (铜绿的形成)Cu2(OH)2CO3 + 4HCl=2CuCl2 + 3H2O + CO2↑Cu 紫红色Cu2O 红色CuO 黑色CuSO4蓝色CuSO4•5H2O白色Cu2(OH)2CO3绿色Cu(OH)2蓝色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钠的有关反应方程式、
1、Na+O 2常温:
4Na+O 2==2Na 2O
2、Na+O 2加热:
2Na+O 2==Na 2O 2
3、Na 与Cl 2反应:
2Na +Cl 2===2NaCl
4、Na 与S 反应:
2Na+S=== Na 2S
5、Na 与水反应:
2Na+ 2H 2O== 2NaOH+H 2↑
6、Na 与HCl 反应: △
点燃
2Na+2HCl==2NaCl+H 2↑
7、Na 与CuSO 4溶液反应:
2Na+ 2H 2O+ CuSO 4==Cu (OH )2↓+Na 2SO 4+ H 2↑
8、Na 与FeCl 3溶液反应:
6Na+ 6H 2O+2FeCl 3==2Fe (
OH )3↓+6NaCl+ 3H 2↑ 9、Na 2O 与H 2O 反应:
Na 2O+H 2O==2NaOH
10、Na 2O 与CO 2反应:
Na 2O+CO 2== Na 2CO 3
11、Na 2O 在空气中加热 :
2Na 2O + O 2== 2Na 2O 2 △
△
12、Na2O2与H2O反应:
2Na2O2+2H2O==4NaOH+O2↑
13、Na2O2与CO2反应:
2Na2O2+2CO2== 2Na2CO3+ O2↑
14、Na2CO3溶液与少量HCl溶液反应:
Na2CO3+HCl(少量)=NaCl+ NaHCO3
15、Na2CO3溶液与过量HCl溶液反应:
Na2CO3+2HCl(过量)=2NaCl+ H2O+CO2↑16、Na2CO3溶液中通过量CO2气体:
Na2CO3 +CO2+H2O=2NaHCO3
17、Na2CO3溶液与CaCl2溶液:
Na2CO3+ CaCl2=CaCO3↓+2NaCl
18、Na2CO3溶液与Ba(OH)2溶液反应:
Na2CO3+ Ba(OH)2= BaCO3↓+2NaOH
19、NaHCO3溶液与HCl溶液反应:
HCO3-+H+=CO2↑+H2O
20、NaHCO3溶液与NaOH溶液:
NaHCO3+NaOH= Na2CO3+ H2O
21、NaHCO3溶液与少量Ba(OH)2溶液反应:
2NaHCO3+ Ba(OH)2少=Na2CO3+BaCO3↓+2H2O 22、NaHCO3与过量Ba(OH)2溶液:
NaHCO3+ Ba(OH)2过=NaOH+BaCO3↓+H2O
23、NaHCO 3受热分解:
2NaHCO 3=== Na 2CO 3 +CO 2↑+H 2O
24、Ca (HCO 3)2与少量NaOH 溶液反应:
Ca (HCO 3)2+NaOH (少)=CaCO 3↓+NaHCO 3+H 2O
25、Ca (HCO 3)2与过量NaOH 溶液反应:
Ca (HCO 3)2+2NaOH (多)=CaCO 3↓+Na 2CO 3+2H 2O
26、Mg 在CO 2气体中燃烧:
2Mg+ CO 2==== C+2MgO
27、Mg 与沸水反应:
Mg+2H 2O=== Mg (OH )2+H 2↑
铝及其化合物的反应方程式: △
点燃 △
1、Al 与O 2反应:4Al +3O 2=2Al 2O 3
2、Al 与Cl 2反应:2Al +3Cl 2==2AlCl 3
3、Al 与Fe 3O 4高温下反应:
8Al+3 Fe 3O 4===9 Fe+4Al 2O 3
4、Al 与沸水反应: 2Al +6H 2O===2 Al (OH )3+3H 2↑
5、Al 与盐酸反应:2Al +6HCl==2AlCl 3+3H 2↑
6、Al 与NaOH 溶液反应
2Al+2NaOH+2H 2O==2NaAlO 2+3H 2↑
7、Al 与Ba (OH )2溶液:
2Al+ Ba (OH )2 +2H 2O=Ba (AlO 2)2 +3H 2↑
8、Al 2O 3与盐酸反应:
Al 2O 3+6HCl=2AlCl 3+ 3H 2O
9、Al 2O 3与NaOH 溶液反应:
高温 点燃 △
Al2O3+2NaOH=2NaAlO2+ H2O
10、Al2O3与Ba(OH)2溶液反应:
Al2O3+ Ba(OH)2=Ba(AlO2)2+ H2O 11、Al(OH)3与盐酸溶液反应:
Al(OH)3+3H+=Al3++ 3H2O
12、Al(OH)3与NaOH溶液反应:
Al(OH)3+OH-=AlO2-+2H2O
13、Al(OH)3受热分解:
△
2Al(OH)3=== Al2O3+ 3H2O
14、AlCl3溶液与少量的NaOH溶液:
Al3++3OH-(少量)=Al(OH)3↓
15、AlCl3溶液与过量NaOH溶液反应:
Al3++4OH-(过量)== AlO2-+2H2O
16、Al2(SO4)3与过量氨水:
Al3++3NH3·H2O =Al(OH)3↓+3NH4+
17、Al2(SO4)3溶液与少量的Ba(OH)2溶液反应:
Al2(SO4)3+3Ba(OH)2(少量)= 2Al(OH)3↓+3BaSO4↓18、Al2(SO4)3溶液与过量的Ba(OH)2溶液反应
Al2(SO4)3+4Ba(OH)2(过量)= Ba(AlO2)2+3 BaSO4↓+4H2O 19、KAl(SO4)2溶液与少量的Ba(OH)2溶液反应2KAl(SO4)2+3Ba (OH)2(少量)=K2SO4+3BaSO4↓+2Al(OH)3↓
20、KAl(SO4)2溶液与过量的Ba(OH)2溶液反应
KAl(SO4)2+2Ba(OH)2(过量)=KAlO2+2BaSO4↓+2H2O
铁及其化合物的有关化学方程式:
1、Fe 在O 2中燃烧:
3Fe+2O 2====Fe 3O 4
2、Fe 在Cl 2中燃烧:
2Fe+3Cl 2====2FeCl 3
3、Fe 与S 反应:
Fe+S===FeS
4、Fe 与高温水蒸气反应:
3Fe+4H 2O(g)====Fe 3O 4+4H 2
5、Fe 与盐酸溶液反应:
Fe+2HCl=FeCl+H 2↑
6、Fe 与CuSO 4溶液反应: 点燃
点燃 高温
Fe+CuSO 4=FeSO 4+Cu
7、Fe 与AgNO 3溶液反应:
Fe+2AgNO 3 =Fe (NO 3)2+2Ag
8、Fe 与FeCl 3溶液反应: Fe+2FeCl 3=3FeCl 2
9、FeO 在空气中受热发生反应:
6FeO+O 2===2Fe 3O 4
10、FeO 与CO 高温加热:
FeO+CO====Fe+CO 2↑
11、FeO 与H 2高温加热:
FeO+H 2==== Fe+H 2O
12、FeO 与Al 高温加热: △ △
高温 高温
3FeO+2Al====Al 2O 3+3Fe
13、Fe 2O 3与CO 高温加热
14、Fe 2O 3与H 2高温加热
15、Fe 2O 3与Al 高温加热
16、Fe 3O 4与CO 高温加热
17、Fe 3O 4与H 2高温加热
18、Fe 3O 4与Al 高温加热:
3Fe 3O 4+8Al====4Al 2O 3+9Fe
19、FeO 与盐酸溶液反应:
FeO+2HCl==FeCl 2+H 2O
20、Fe 2O 3与盐酸溶液反应: 高温 高温
Fe2O3+6H+==2Fe3++3H2O
21、Fe(OH)2在空气中被氧化:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
22、Fe(OH)3受热分解:
△
2Fe(OH)3=== Fe2O3+3H2O
23、Fe(OH)3与盐酸反应:
Fe(OH)3+3H+==Fe3++3H2O
24、FeCl3溶液与NH3·H2O溶液反应:
Fe3++3NH3·H2O== Fe(OH)3↓+3NH4+
25、Fe2(SO4)3溶液与NaOH溶液反应:
Fe2(SO4)3+6 NaOH==2Fe(OH)3↓+3Na2SO4
26、FeCl3溶液与氢硫酸(H2S水溶液)的反应:
2FeCl3+H2S==2FeCl2+2HCl+S↓
27、FeCl3溶液与KI溶液反应:
2FeCl3+2KI==2FeCl2+2KCl+I2
28、Fe2(SO4)3溶液与Na2SO3溶液反应:
Fe2(SO4)3+ Na2SO3+ H2O==2FeSO4+ Na2SO4+ H2SO4 29、FeCl3溶液与Fe粉反应:
2FeCl3+Fe== 3FeCl2
30、Fe2(SO4)3溶液与过量的Cu粉反应:
Fe2(SO4)3+Cu==2FeSO4+CuSO4
31、FeCl3溶液与过量的Zn粒反应:
2FeCl3+3Zn===3ZnCl2+2Fe
32、Fe2(SO4)3溶液与金属Na的反应:
Fe2(SO4)3+6Na+ 6H2O == 2Fe(OH)3↓+ 3Na2SO4+3 H2↑33、FeCl3溶液与KSCN溶液的反应:
FeCl3+3KSCN===Fe(SCN)3+3KCl
34、FeCl2溶液与过量的NaOH溶液反应:
FeCl2+2NaOH== Fe(OH)2↓+2NaCl
35、FeSO4溶液与过量的氨水反应:
FeSO4+2NH3·H2O== Fe(OH)2↓+(NH4)2 SO4
37、FeCl2溶液中滴加氯水(Cl2的水溶液):
2FeCl2+ Cl2===2FeCl3。
