进口药材申请表
中草药进口配额申请书

尊敬的[管理部门名称]:我司[公司名称],是一家专注于中草药研发、生产和销售的企业,为满足我国中医药市场的需求,保障中医药产品的质量和供应,现向贵部门申请[年份]年度中草药进口配额。
以下为具体申请内容:一、申请理由1. 市场需求:随着我国人民生活水平的提高和健康意识的增强,对中草药的需求日益增长。
据统计,我国中草药市场规模已超过千亿,且呈现持续增长态势。
然而,我国中草药资源有限,部分珍贵药材依赖进口。
2. 产品质量:为保障中草药产品质量,我司一直致力于引进国外优质中草药资源,提高我国中草药产品的整体质量。
进口配额的申请有助于我司更好地满足市场需求。
3. 促进产业发展:引进国外优质中草药资源,有助于推动我国中草药产业的健康发展,提高我国在国际市场的竞争力。
二、申请品种及数量本次申请进口配额的中草药品种包括:1. 人参:100吨2. 黄芪:50吨3. 当归:30吨4. 茯苓:20吨5. 三七:10吨总计:200吨三、申请理由及优势1. 产品质量:引进的国外中草药品种,经过严格筛选,具有优良的品质和稳定的药效,符合我国相关标准和规定。
2. 供应链稳定:与国外供应商建立了长期稳定的合作关系,能够保证中草药资源的稳定供应。
3. 价格优势:通过进口配额,可以降低进口成本,提高我司产品的市场竞争力。
4. 技术支持:引进国外中草药资源,有助于我司在技术研发、产品创新等方面取得突破。
四、进口配额使用计划1. 严格按照我国相关法律法规,确保进口中草药的质量和安全。
2. 在规定的时间内,将进口的中草药用于生产,满足市场需求。
3. 加强与国内中草药种植企业的合作,推动我国中草药产业的发展。
4. 定期向贵部门汇报进口配额的使用情况,接受监督。
综上所述,我司真诚希望贵部门能够批准本次中草药进口配额申请。
我们将严格按照相关法律法规,确保进口中草药的质量和安全,为我国中医药事业的发展贡献力量。
特此申请!申请人:[公司名称]法定代表人:[姓名]联系电话:[电话号码]电子邮箱:[电子邮箱]申请日期:[日期]。
国家食品药品监督管理局药品补充申请-境外申请人用表

国家食品药品监督管理局药品补充申请-境外申请人用表国家食品药品监督管理局药品补充申请-境外申请人用表声明我们保证:①本申请遵守《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《药品注册管理办法》等法律、法规和规章的规定;②申请表内容及所提交资料、样品均真实、来源合法,未侵犯他人的权益,其中试验研究的方法和数据均为本药品所采用的方法和由本药品得到的试验数据;③一并提交的电子文件与打印文件内容完全一致。
如查有不实之处,我们承担由此导致的一切法律后果。
其他特别申明事项:申请事项1 本申请属于:进口注册2 药品分类:〇中药〇天然药物〇化学药物〇按药品管理的体外诊断试剂〇治疗用生物制品〇预防用生物制品〇药用辅料3 是否OTC:〇处方药〇非处方药4 原申请品种状态:〇已上市〇已批准临床〇在审评或审批中5 申请事项分类:〇报国家食品药品监督管理局审批的补充申请事项:□持有新药证书的药品生产企业申请该药品的批准文号; □使用药品商品名称; □增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症; □变更用法用量或者变更适用人群范围但不改变给药途径;□变更药品规格;□变更药品处方中已有药用要求的辅料;□改变影响药品质量的生产工艺;□修改药品注册标准;□替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材; □进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;□使用新型直接接触药品的包装材料或者容器; □申请药品组合包装;□新药技术转让; □修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目;□改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等;□改变进口药品的产地;□改变进口药品的国外包装厂; □进口药品在中国国内分包装; □其他;〇报省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项:□改变国内药品生产企业名称; □国内药品生产企业内部改变药品生产场地; □变更直接接触药品的包装材料或者容器(除上述第10事项外);□改变国内生产药品的有效期; □改变进口药品制剂所用原料药的产地; □变更进口药品外观,但不改变药品标准的; □根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书; □补充完善进口药品说明书安全性内容; □按规定变更进口药品包装标签; □改变进口药品注册代理机构; □进口药品分包装;□其他〇报省级食品药品监督管理部门备案的补充申请事项:□根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书; □补充完善国内生产药品说明书安全性内容; □按规定变更国内生产药品包装标签; □变更国内生产药品的包装规格; □改变国内生产药品制剂的原料药产地; □变更国内生产药品外观,但不改变药品标准的; □进口药品分包装; □其他;本表必须使用SFDA制发的申请表填报软件填写、修改和打印。
Application form for Imported Drug Supplementary Registretion 进口药品补充申请表格

20 Supplementary contents:
21Rationalto propose this supplementary:
22Initialapproved registration contentsandrelevant information:
〇Supplemental applications to be filed for record at PDA:□Amendment of insert sheet of the domestic drugs according tonational drug standards or required by SFDA.□Supplementing and perfecting of the domestic drug safety part of theinsert sheet.□Modification of design of packing and label of the domestic drugsaccording to the regulation.□Change of the packing specification of domestic drugs.□Change of manufacture location of domestic drugs□Change of appearance of the domestic drug without change of drugstandards.□others
Accepted No
Manufacturer
ImplementationStandards
Variationor not
Variationapprovedstatus and approved institution
进口药材申请流程

1。
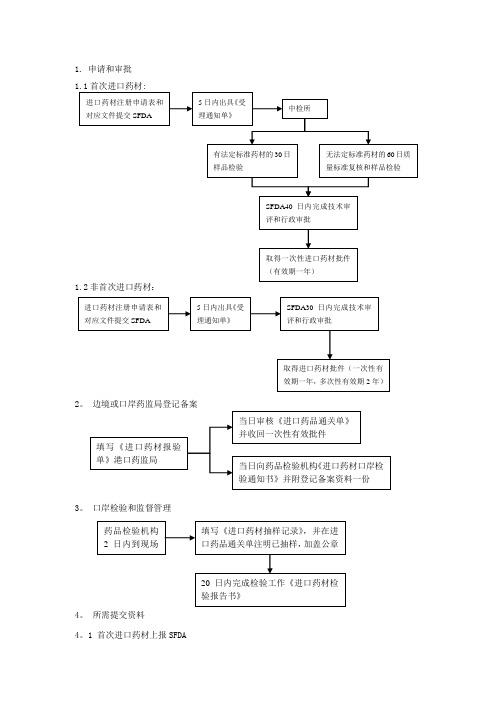
申请和审批1.1首次进口药材:1.2非首次进口药材:3. 口岸检验和监督管理4。
所需提交资料4.1 首次进口药材上报SFDA4.1.1物料部申请人需报送下列资料一式两份,分别提交国家食品药品监督管理局和中国药品生物制品检定所.(一)《进口药材申请表》。
(二)本公司《药品经营许可证》或《药品生产许可证》、《营业执照》(复印件)。
(三)供货方合法登记证明文件(如《营业执照》等)(复印件)。
(四)购货合同(复印件)。
(五)药材质量标准及其来源。
(六)药材基源研究证明资料(研究证明资料应由中国境内具有动、植物基源鉴定资质的机构提供)。
4.1。
2如进口药材的质量标准来源于省、自治区、直辖市药材标准,物料部申请人除报送上述资料外,还应根据具体情况,对该标准作相应的提高工作,并报送有关研究资料;如进口药材无法定标准,物料部申请人除报送上述资料外,还应报送下述资料:(一)药材生态环境、生长特征、形态描述、栽培或者培植(培育)技术、产地加工等。
(二)药材质量标准起草说明。
(三)药理毒理研究资料综述。
(四)主要药效学试验资料及文献资料.(五)一般药理研究的试验资料及文献资料。
(六)急性毒性试验资料及文献资料。
(七)我国批准的中成药处方中含有该药材的证明资料。
4。
2 非首次进口药材上报SFDA物料部申请人需报送下述资料一式一份:(一)《进口药材申请表》.(二)本公司《药品经营许可证》或者《药品生产许可证》、《营业执照》(复印件)。
(三)供货方合法登记证明文件(如《营业执照》等)(复印件)。
(四)购货合同(复印件)。
(五)药材质量标准及其来源。
4。
3 登记备案上报口岸药监局物料部申请人需报送下列资料一式两份:(一)《进口药材批件》复印件(和《进口药材补充申请批件》复印件)。
(二)本公司《药品经营许可证》或者《药品生产许可证》复印件。
(三)原产地证明复印件.(四)购货合同复印件。
(五)装箱单、提运单和货运发票复印件。
进口药材申请表

相关证件:1.《营业执照》编号:****许可证》编号:****
法定代表人:****职位:****
注册地址:****邮政编码:****
生产地址:****邮政编码:****
注册申请负责人:****签名:****职位:****
电话(含区号及分机号):****传真:****
21.机构(国外加工企业):****□本机构负责缴费
名称:****
组织机构代码:****
相关证件:《营业执照》编号:****
法定代表人:****职位:****
注册地址:****邮政编码:****
生产地址:****邮政编码:****
联系人:****电话:****
XXXXXX
申明
22.我们保证:①本申请遵守《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《进口药材管理办法》等法律、法规和规章的规定;②申请表内容及所提交资料、样品均真实、来源合法,未侵犯他人的权益,其中试验研究的方法和数据均为本药品所采用的方法和由本药品得到的试验数据;③一并提交的电子文件与打印文件内容完全一致。
8.出口地(国家):****
9.申请进口数量(公斤):****
10.包装材料:****
11.包装规格:****
12.合同号:****
13.检验标准:〇中国药典版
〇进口药材质量标准,标准来源
〇部颁药材标准,标准来源
〇省、自治区、直辖市药材标准,标准来源____________
〇自拟药材质量标准(仅限于无法定标准进口药材)
国家食品药品监督管理局
进口药材申请表
申请编号:XXXXXXXXX
申请事项
1.申请分类:〇首次进口药材:〇已有法定标准药材〇无法定标准药材
进口药材申请流程
1. 申请和审批1.1首次进口药材:1.2非首次进口药材:23。
口岸检验和监督管理4。
所需提交资料4。
1 首次进口药材上报SFDA4。
1。
1物料部申请人需报送下列资料一式两份,分别提交国家食品药品监督管理局和中国药品生物制品检定所。
(一)《进口药材申请表》。
(二)本公司《药品经营许可证》或《药品生产许可证》、《营业执照》(复印件)。
(三)供货方合法登记证明文件(如《营业执照》等)(复印件)。
(四)购货合同(复印件)。
(五)药材质量标准及其来源.(六)药材基源研究证明资料(研究证明资料应由中国境内具有动、植物基源鉴定资质的机构提供)。
4。
1。
2如进口药材的质量标准来源于省、自治区、直辖市药材标准,物料部申请人除报送上述资料外,还应根据具体情况,对该标准作相应的提高工作,并报送有关研究资料;如进口药材无法定标准,物料部申请人除报送上述资料外,还应报送下述资料:(一)药材生态环境、生长特征、形态描述、栽培或者培植(培育)技术、产地加工等。
(二)药材质量标准起草说明。
(三)药理毒理研究资料综述。
(四)主要药效学试验资料及文献资料。
(五)一般药理研究的试验资料及文献资料。
(六)急性毒性试验资料及文献资料。
(七)我国批准的中成药处方中含有该药材的证明资料。
4.2 非首次进口药材上报SFDA物料部申请人需报送下述资料一式一份:(一)《进口药材申请表》。
(二)本公司《药品经营许可证》或者《药品生产许可证》、《营业执照》(复印件)。
(三)供货方合法登记证明文件(如《营业执照》等)(复印件)。
(四)购货合同(复印件)。
(五)药材质量标准及其来源。
4.3 登记备案上报口岸药监局物料部申请人需报送下列资料一式两份:(一)《进口药材批件》复印件(和《进口药材补充申请批件》复印件)。
(二)本公司《药品经营许可证》或者《药品生产许可证》复印件。
(三)原产地证明复印件。
(四)购货合同复印件.(五)装箱单、提运单和货运发票复印件.(六)经其他国家或者地区转口的进口药材,应当同时提交从原产地到各转口地的全部购货合同、装箱单、提运单和货运发票。
中华人民共和国进口货物许可证申请表

领证人姓名:
领证人驻京电话物许可证申请表
对外贸易经济合作部监制
1.我国对外成交单位及编码
(成交单位或指标单位盖章)
3.进口许可证编号:
4.许可证有效期:
至______年____月____日止
2.收货单位:
5.贸易方式:
8.进口国别.(地区):
6.外汇来源:
9.商品原产地:
7.到货口岸:
10.商品用途:
11.商品名称:
商品编码
12.商品规格.型号
13.单位
14.数量
15.单价(币制)
16.总值
17.总值折美元
18.总计
填表须知:1.本申请表一式两联,由领证人填写,未经盖章本表无效,申领许可证时两联均需交给发证机关。
2.“商品名称”栏,每份申请表只能填写一种商品,或同一品种不同型号的商品。
3.商品用途:指自用、生产用、内销、维修、样品、外销。
4.外汇来源:指中央、留成、贷款、外资、调剂、劳务、赠送、索赔、无偿援助、不支付外汇。
进口药材申请表

11.包装规格:
12.合同号:
13.检验标准:〇中国药典版
〇进口药材质量标准,标准来源
〇部颁药材标准,标准来源
〇省、自治区、直辖市药材标准,标准来源_______________________
〇自拟药材质量标准(仅限于无法定标准进口药材)
14.到货口岸:
15.口岸或边境口岸(食品)药品监督管理局:
16.是否属濒危物种〇是〇否
17.是否为本企业首次进口品种〇是〇否, 已进口次数: 已进口总量(公斤):
原批件号:
18.申请进口理由:
XXXXXX
申请人
19.机构:□本机构负责缴费
名称:
组织机构代码:
相关证件:1.《营业执照》编号:
2.〇《药品生产许可证》编号:
〇《药品经营许可证》编号:
法定代表人:职位:
如查有不实之处,我们承担由此导致的一切法律后果。
23.其他特别申明事项:
24.申请人机构名称公章法定代表人签名签名日期:
XXXXXX
注册地址:邮政编码:
生产地址:邮政编码:
注册申请负责人:签名:职位:
电话(含区号及分机号):传真:
电子信箱:
联系人:电话:
其他相关情况
20.机构(出口商或出口企业):□本机构负责缴费
名称:
组织机构代码:
相关证件:《营业执照》编号:
法定代表人:职位:
注册地址:邮政编码:
生产地址:邮政编码:
联系人:电话:
国家食品药品监督管理总局
进口药材申请表
申请编号:XXXXXXXXX
申请事项
1.申请分类:〇首次进口药材:〇已有法定标准药材〇无法定标准药材
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
进口药材申请表
申请编号:XXXXXXXXX
申请事项
1.申请分类:〇首次进口药材:〇已有法定标准药材〇无法定标准药材
〇非首次进口药材
2.批件分类: 〇一次性有效批件〇多次使用批件
进口药材情况
3.中文名:****
4.拉丁学名:****
5.英文名:****
6.别名:****
7.产地(国家):****
8.出口地(国家):****
9.申请进口数量(公斤):****
10.包装材料:****
11.包装规格:****
12.合同号:****
13.检验标准:〇中国药典版
〇进口药材质量标准,标准来源
〇部颁药材标准,标准来源
〇省、自治区、直辖市药材标准,标准来源____________
〇自拟药材质量标准(仅限于无法定标准进口药材)
21.机构(国外加工企业):****□本机构负责缴费
名称:****
组织机构代码:****
相关证件:《营业执照》编号:****
法定代表人:****职位:****
注册地址:****邮政编码:****
生产地址:****邮政编码:****
联系人:****电话:****
XXXXXX
申明
22.我们保证:①本申请遵守《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《进口药材管理办法》等法律、法规和规章的规定;②申请表内容及所提交资料、样品均真实、来源合法,未侵犯他人的权益,其中试验研究的方法和数据均为本药品所采用的方法和由本药品得到的试验数据;③一并提交的电子文件与打印文件内容完全一致。
电子信箱:****
联系人:****电话:****
其他相关情况
20.机构(出口商或出口企业):****□本机构负责缴费
名称:****
组织机构代码:****
相关证件:《营业执照》编号:****
法定代表人:****职位:****
注册地址:****邮政编码:****
生产地址:****邮政编码:****
联系人:****电话:****
14.到货口岸:****
15.口岸或边境口岸(食品)药品监督管理局:****
16.是否属濒危物种 〇是 〇否
17.是否为本企业首次进口品种
〇是 〇否, 已进口次数: 已进口总量(公斤):
原批件号:****
18.申请进口理由:
****
XXXXXX
申请人
19.机构:****□本机构负责缴费
名称:****
组织机构代码:****
相关证件:1.《营业执照》编号:****
2.〇《药品生产许可证》编号:****
〇《药品经营许可证》编号:****
法定代表人:****职位:****
注册地址:****邮政编码:****
生产地址:****邮政编码:****
注册申请负责人:****签名:****职位:****电话(Βιβλιοθήκη 区号及分机号):****传真:****
如查有不实之处,我们承担由此导致的一切法律后果。
23.其他特别申明事项:****
24.申请人机构名称公章法定代表人签名签名日期:****
XXXXXX
