化工热力学第二章 PVT
合集下载
化工热力学-流体的 p-V-T 关系

Z
Z
Z
1
q
Z
或
Z
0.026196
Z
Z
0.026196
1.026196 Z 6.6060 0.026196
将 Z= 代入上式右边,迭代计算后得到收敛值Z=0.04331。
V l ZRT 0.043318.314350 133.3 cm3mol1
p
0.9457
为了比较计算结果,在例2/5-1的情况下,运用四种立方型状态 方程所计算得到的V v及V l 值列表如下:
第二章 流体的 p-V-T 关系
(一)纯流体的三维相图
自由度与相律
(二)纯流体的二维相图
异戊烷的p-V图
p-T相图
T-V图
(三)纯流体 pVT 行为的模型化
→ 什么是状态方程?
f p,V,T 0
dV
V T
p
dT
V p
T
dp
V=V(T,p)
p=p(T,V )
(四)理想气体
只有在Zc相等的条件下,对比态原理才能成立
以ω为第三参数的对应状态原理
Z f pr ,Tr ,
偏心因子
Pitzer: 物质对比饱和蒸汽压的对数,与对比温度的倒数呈 下列线性关系
log
prS
a 1
1 Tr
prS
pS pc
球形分子虽然临界参数相差很大,但在Tr=0.7时,对比蒸气压 logprS = -1 。
ZC 3/8 1/3 1/3 0.30740
临界压缩因子Zc
VDW: 3/8 RK/SRK: 1/3 PR: 0.3047
立方型状态方程的数值求解
p
RT
V b
V
化工热力学第2章 流体的PVT关系和状态方程

P
RT V b
V
a
V
b
a
ac
T
0.42748
R 2Tc2 Pc
T
b 0.08664 RTc Pc
T
1
0.48
1.574
0.176
2
1
T 0.5 r
2
在临界点: T 1
优点
➢ 与RK方程相比,SRK方程大大提高了表达纯物质汽液平 衡的能力,使之能用于混合物的汽液平衡计算,故在工 业上获得了广泛的应用。
6.734m3
/ kmol
V1
6.814
4.2486.734 6.7346.734
0.08058 0.08058
6.198
V2
6.814
4.2486.198 6.1986.198
0.08058 0.08058
6.146
V3 6.141 V4 6.140 V 6.140m3 / kmol
( 2 ) SRK方程
Thiesen, 1885年提出 Onnes, 1901年改进
pV a(1 b' p c' p2 d ' p3 .....) 原型 p 0 理想气体
Z pV 1 Bp Cp2 Dp3 RT
Z pV 1 B C D
RT
V V2 V3
B B RT
C C B2 R2T 2
8.3142 408.12.5
a 0.42768 3.648 103
2.725104 kPa m6 K 0.5 / kmol2
b 0.08664 8.314 408.1 0.08058m3 / kmol 3.648 103
RT
a
P V b T1/2V V b
化工热力学第2章流体的PVT关系
时,这种流体就处于对比状态。
例如:H2 和N2这两种流体
对于H2
状态点记为1,P1 V1 T1
Tr1 =T1/TcH2
Pr1=P1/PcH2
对于N2
状态点记为2,P2 V2 T2
Tr2 =T2/TcN2
Pr2=P2/PcN2
当Tr1=Tr2 ,Pr1=Pr2 时,此时就称这两种流体处
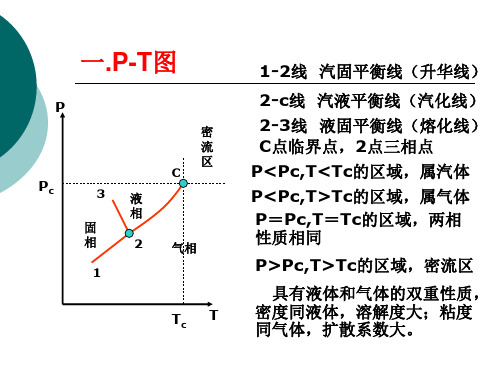
一.P-T图
P
Pc
3液
相
固
相
2
1
密 流 区 C
气相
Tc T
1-2线 汽固平衡线(升华线)
2-c线 汽液平衡线(汽化线) 2-3线 液固平衡线(熔化线) C点临界点,2点三相点 P<Pc,T<Tc的区域,属汽体 P<Pc,T>Tc的区域,属气体 P=Pc,T=Tc的区域,两相 性质相同
P>Pc,T>Tc的区域,密流区
压缩因 子,方 程的计 算值和 实测值 的符合 程度是 判断方 程的优 劣标志 之一。
2. R-K Equation (1949年,Redlich and Kwong)
(1) R-K Eq的一般形式:
P
RT V-b
-
a T0.5V(V
b)
(2-11)
① R-K Equation中常数值不同于范德华方程中的a、b值, 不能将二者混淆。 在范德华方程中,修正项为a/V2,没有考虑温度的影响 在R-K方程中,修正项为,考虑了温度的影响。 ② R-K Equation中常数a、b值是物性常数,具有单位。
为表征物质分子的偏心度,既非球型分子偏离球对称的 程度,简单流体为0
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
例如:H2 和N2这两种流体
对于H2
状态点记为1,P1 V1 T1
Tr1 =T1/TcH2
Pr1=P1/PcH2
对于N2
状态点记为2,P2 V2 T2
Tr2 =T2/TcN2
Pr2=P2/PcN2
当Tr1=Tr2 ,Pr1=Pr2 时,此时就称这两种流体处
一.P-T图
P
Pc
3液
相
固
相
2
1
密 流 区 C
气相
Tc T
1-2线 汽固平衡线(升华线)
2-c线 汽液平衡线(汽化线) 2-3线 液固平衡线(熔化线) C点临界点,2点三相点 P<Pc,T<Tc的区域,属汽体 P<Pc,T>Tc的区域,属气体 P=Pc,T=Tc的区域,两相 性质相同
P>Pc,T>Tc的区域,密流区
压缩因 子,方 程的计 算值和 实测值 的符合 程度是 判断方 程的优 劣标志 之一。
2. R-K Equation (1949年,Redlich and Kwong)
(1) R-K Eq的一般形式:
P
RT V-b
-
a T0.5V(V
b)
(2-11)
① R-K Equation中常数值不同于范德华方程中的a、b值, 不能将二者混淆。 在范德华方程中,修正项为a/V2,没有考虑温度的影响 在R-K方程中,修正项为,考虑了温度的影响。 ② R-K Equation中常数a、b值是物性常数,具有单位。
为表征物质分子的偏心度,既非球型分子偏离球对称的 程度,简单流体为0
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
化工热力学第二章-----流体的PVT关系 [兼容模式]
![化工热力学第二章-----流体的PVT关系 [兼容模式]](https://img.taocdn.com/s3/m/83ffab71a26925c52cc5bf48.png)
24
MH方程
方程情况 ( 1 ) MH 方程是 1955 年 Martin 教授和我国学者候虞钧 教授提出的。首次发表在杂志AIChE J(美国化学工程 师会刊)上。有9个参数。 (2)为了提高该方程在高密度区的精确度,Martin于 1959年对该方程进一步改进。 (3)1981年候虞钧教授等又将该方程的适用范围扩展 到液相区,改进后的方程称为MH-81型方程。
0.5 r 2
k 0.3746 1.54226 0.26992 2
a( T )=a( T )=f (Tc,pc, Tr ,ω)
15
P-R方程
方程使用情况: (1)RK方程和SRK方程在计算临界压缩因子Zc和液 体密度时都会出现较大的偏差,PR方程弥补这 一明显的不足; (2)它在计算饱和蒸气压、饱和液体密度等方面有更 好的准确度; (3)是工程相平衡计算中最常用的方程之一。
8
van der Waals方程
1873年van der Waals(范德华) 首次提出了能表达从气态 到液态连续性的状态方程 :
•参数: (1)a/V2—分子引力修正项。 由于分子相互吸引力存在,分子撞击器壁的力减小,造成压力 减小。 (2)b —分子本身体积的校正项。 分子本身占有体积,分子自由活动空间减小,由V变成V-b。 分子自由活动空间的减小造成分子撞击器壁的力增大。b增大, 造成压力增大。
2
一、纯物质的P-T关系
1-2线 汽固平衡线(升华线)
P
A
Pc
C
超临 界流 体区
2-c线 汽液平衡线(汽化线) 2-3线 液固平衡线(熔化线) C点临界点,2点三相点 P<Pc, T<Tc的区域,属汽体 P<Pc, T>Tc的区域,属气体
化工热力学第二章 流体的pVT关系

化工热力学
第二章 流体的PVT关系
第2章 流体的p-V-T关系
流体指除固体以外的流动相的总称。均 匀流体一般分为液体和气体两类。
南阳理工学院 生化学院
化工热力学
第二章 流体的PVT关系
重点内容
纯物质的p-V-T关系
状态方程 立方型状态方程 多参数状态方程 对应态原理及其应用 流体的蒸气压、蒸发焓和蒸发熵
方程形式: p RT a(T )
V b V (V b)
Soave 是把R-K 方程中的常数a 看作是温度的函数,在SRK 方程中,a 不仅是物性的函数,而且还是温度的函数,只有在特 定的温度下,对于某一物质而言, a 才能为定值。
方程常数:
a(T
)
ac
(Tr
,)
0.42748
混合规则与混合物的p-V-T关系 液体的p-V-T关系
南阳理工学院 生化学院
化工热力学
第二章 流体的PVT关系
本章要求:
1.了解纯物质的P-T图和P-V图 2.正确、熟练地应用R-K方程、两项维里方程计 算单组分气体的P-V-T关系 3.正确、熟练地应用三参数普遍化方法计算单组 分气体的P-V-T关系 4.了解计算真实气体混合物P-V-T关系的方法, 并会进行计算。
化工热力学
第二章 流体的PVT关系
V T
p
V
V V p T
dV dT dp V
对于液体,由于其具有不可压缩性,体积膨胀系数和等温 压缩系数是温度和压力的弱函数,其数值可以从文献或工具书 中查到。因此,在液体的温度和压力变化不大时,可以将体积 膨胀系数和等温压缩系数当作常数,则
第二章 流体的PVT关系
第2章 流体的p-V-T关系
流体指除固体以外的流动相的总称。均 匀流体一般分为液体和气体两类。
南阳理工学院 生化学院
化工热力学
第二章 流体的PVT关系
重点内容
纯物质的p-V-T关系
状态方程 立方型状态方程 多参数状态方程 对应态原理及其应用 流体的蒸气压、蒸发焓和蒸发熵
方程形式: p RT a(T )
V b V (V b)
Soave 是把R-K 方程中的常数a 看作是温度的函数,在SRK 方程中,a 不仅是物性的函数,而且还是温度的函数,只有在特 定的温度下,对于某一物质而言, a 才能为定值。
方程常数:
a(T
)
ac
(Tr
,)
0.42748
混合规则与混合物的p-V-T关系 液体的p-V-T关系
南阳理工学院 生化学院
化工热力学
第二章 流体的PVT关系
本章要求:
1.了解纯物质的P-T图和P-V图 2.正确、熟练地应用R-K方程、两项维里方程计 算单组分气体的P-V-T关系 3.正确、熟练地应用三参数普遍化方法计算单组 分气体的P-V-T关系 4.了解计算真实气体混合物P-V-T关系的方法, 并会进行计算。
化工热力学
第二章 流体的PVT关系
V T
p
V
V V p T
dV dT dp V
对于液体,由于其具有不可压缩性,体积膨胀系数和等温 压缩系数是温度和压力的弱函数,其数值可以从文献或工具书 中查到。因此,在液体的温度和压力变化不大时,可以将体积 膨胀系数和等温压缩系数当作常数,则
化工热力学第二章.

第2章流体的p-V-T关系
主要内容
1) 流体的压力p、摩尔体积V 和温度T是物质最基
本的性质;
2)p、V、T 性质可以通过实验直接测量;
3)pVT+c p ig能推算其它不能直接从实验测量的热力
学性质如H、S、U、G等。
1
)
c
A B
对任何气体,
根据气体的临界参数,即可求出Z
计算常数需要
同时适用于汽液两相,
(1)
(2) EOS
(3)
与立方型状态方程相比,多参数状态方程的优多参数方程的基础是
能同时适用于汽、液两相
在计算和关联烃类混合物时极有价值;计算结果明显高于立方型状态方程;
该方程的数学规律性较弱,给方程的求解。
化工热力学第二章 PVT

有了p-V-T关系,热力学的大多数问题均可得到解 决。
2
第二章 内容
§2.1 纯流体的p-V-T相图 §2.2 气体状态方程(EOS) §2.3 对应态原理和普遍化关联式 §2.4 液体的p-V-T性质 §2.5 真实气体混合物p-V-T关系
§2.6 状态方程的比较和选用
3
§2.1 纯流体的p-V-T相图
48.1
49.7 71.7 41.9 37.5 37.5
32.2
9.2 36.5 96.6 196.6 135.0
0.203
0.218 0.450 0.217 0.232 0.228
31
超临界流体萃取过程简介
将萃取原料装入萃取釜。采用CO2为超临界溶剂。 CO2气体经热交换器冷凝成液体; 用加压泵把压力提升到工艺过程所需的压力(应高于CO2的 pc),同时调节温度 ,使其成为超临界CO2流体。 CO2流体作为溶剂从萃取釜底部进入,与被萃取物料充分接 触,选择性溶解出所需的化学成分。 含溶解萃取物的高压CO2流体经节流阀降压到低于CO2的pc 以下进入分离釜,由于CO2溶解度急剧下降而析出溶质,自 动分离成溶质和CO2气体二部分,前者为过程产品,定期从 分离釜底部放出,后者为循环CO2气体,经过热交换器冷凝 成CO2液体再循环使用。 整个分离过程是利用CO2流体在超临界状态下对有机物有极 高的溶解度,而低于临界状态下对有机物基本不溶解的特性, 将CO2流体不断在萃取釜和分离釜间循环,从而有效地将需 32 要分离提取的组分从原料中分离出来。
1)由于刚性容器体积保持不变, 因此加热过程在等容线上变化,到 达B1时,汽液共存相变为液相单相; 继续加热,当T>Tc,则最终单相为 超临界流体,即C1点。
热力化学第二章 流体P-V-T性质

是用于烃类气体的计算精度很高;
0.5 1 m1 Tr0.5
用计算机多用SRK方程,手算多用RK方程。
Tr—对比温度, Tr=T/TC ; ω—物质的偏心因子
m 0.480 1.574 0.176 2
2.2 流体的状态方程
3. 立方型方程——PR方程 RT a 方程形式: p V b V V b bV b 式中a、b为常数: 2 RTC a 0.45724 pc 普遍化关联式:
3. 立方型方程——RK方程
说明: a、b的物理意义与vdW方程相同,数值不同。 vdW方程,a/V2没有考虑温度;RK方程,考虑了温 度的影响。所以, RK 方程中 a 、 b 是物性常数,具有 单位。 计算精度高于 vdW 方程,尤其适用于非极性和弱 极性的化合物。 RK方程较成功用于气相p-V-T的计算,但液相效果 较差,也不能预测纯流体的蒸汽压(即汽液平衡)。
2 2 2 2
2.3 对比态原理及其应用
1. 普遍化EOS
P22,例题2-4
定义:用对比参数代入EOS得到的方程式。 普遍化RK方程
1 4.934 h Z - 1.5 (1) 1 h Tr 1 h
0.08664 Pr h ZTr
Z pV RT
(2)
2) 1) Z 0 1 式( 普遍化 h 0 式( Z1 Z1 - Z0 pVT EOS 特点:
华北科技学院
化工热力学
Chemical Engineering Thermodynamics
第二章 流体的p-V-T 性质
2.1 纯物质的p-V-T 行为
1. 纯物质的p-V图 p
T4 T5 液 T3
T2 T1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲烷:Tc= -82.62℃,pc=4.536 MPa, 。
问:室温下能否通过加压使天然气变成LNG ? 气体“液化”的先决条件是物质T<Tc。
22
临界点——最重要的性质
23
2. 制冷剂的选择
在选择氟里昂替代品时,离不开p-V-T数 据。 制冷剂工作特点:低压饱和蒸汽室温下饱 和液体交替变化。 对制冷剂的要求:
§2.1.1 T -V图 §2.1.2 P-V图 §2.1.3 P-T图 §2.1.4 P-V-T立体相图 §2.1.5 纯流体P-V-T关系的应用
21
§2.1.5 纯流体p-V-T关系的应用
1.气体液化和低温技术 流体p-V-T关系的最大应用就是气体的液化。 如空气液化、天然气液化。 为了便于储运,一般需将天然气制成液化天然气 (LNG)。
1)由于刚性容器体积保持不变, 因此加热过程在等容线上变化,到 达B1时,汽液共存相变为液相单相; 继续加热,当T>Tc,则最终单相为 超临界流体,即C1点。
2)当水慢慢加热后,则状态从位 于汽液共存区的A2,变为汽相单相 B2,继续加热,当T>Tc,则最终 单相为临界流体C2。
20
§2.1 纯流体的P-V-T相图
1)临界温度要高,否则在常温或普通低温范 围内不能被液化; 2) 在冷凝温度下的蒸汽压也不宜过高; 3)为了使蒸发压力高于大气压力。
制冷剂的选择离不开p-V-T数据。
24
3.液化气成分的选择 【例2-4】液化气是理想的气体燃料。对家庭用液化气 的要求是加压后变成液体储于高压钢瓶里,打开减压阀 后即汽化,以便燃烧。请你根据对液化气储存和使用的 要求来选择液化气成分。
溶液+萃取质A 原料A+B 萃取质A
萃取
萃取残质B
循环萃取剂
分离
新鲜萃取剂
33
§2.2 状态方程(EOS)
§2.2.1 状态方程(EOS)的定义 §2.2.2 理想气体的状态方程 §2.2.3 气体的非理想性 §2.2.4 真实气体的状态方程 §2.2.4.1 van der Waals范德华状态方程 §2.2.4.2 Redlich-Kwong状态方程 §2.2.4.3 Soave- Redlich-Kwong状态方程 §2.2.4.4 Peng-Robinson状态方程 §2.2.4.5 Virial(维里)状态方程 §2.2.5 状态方程的小结
恒温线
9
临界点—p-V-T中最重要的性质
1)Tc、pc 是纯物质能够呈现汽液平衡时的最高温度 和最高压力。 要使气体液化温度绝对不能超过Tc 。 气体“液化”的先决条件是T<Tc,否则无论施加多大 的压力都不可能使之液化。 2)临界等温的数学特征:等于临界温度的等温线在 临界点出现水平拐点。 P V TC 0 在C点 重要! 10 2 P V 2 TC 0 在C点
8
§2.1.2 P-V图
临界点
P
T 1点、2线、 2 2
V 0
P V
在C点 4区 T 0 在C点
④
超临界流体区 (T>Tc和P>Pc)
①过冷液体区L
③汽液两相平衡区 F=C-P+2=1
②过热蒸汽区
什么是正 常沸点?
①饱和液相线
(泡点线)
②饱和汽相线 (露点线 )
30
各种溶剂的临界特性
流体名称 分子式 临界压力 (bar) 临界温度 (℃) 临界密度 (g/cm3)
二氧化碳
水 氨
CO2
H2 O NH3
72.9
217.6 112.5
31.2
374.2 132.4
0.433
0.332 0.235
乙烷
乙烯 氧化二氮 丙烷 戊烷 丁烷
C2H6
C 2 H4 N2O C 3 H8 C5H12 C4H10
如何描述两相共存区不同的状态点?
纯物质从饱和液体点D到饱和蒸汽点E,
T和P保持不变的,只有体积在变化。
x
V Vl 1 x Vg x
( x — 干度。 x 1 0 指饱和蒸汽在湿蒸汽
Vg V
11
·
Vl
中所占的mol或wt )
·
—系统所处两相状态点。
§2.1.3 P-T图
有了p-V-T关系,热力学的大多数问题均可得到解 决。
2
第二章 内容
§2.1 纯流体的p-V-T相图 §2.2 气体状态方程(EOS) §2.3 对应态原理和普遍化关联式 §2.4 液体的p-V-T性质 §2.5 真实气体混合物p-V-T关系
§2.6 §2.1.1 T –V 图 §2.1.2 p-V 图 §2.1.3 p-T 图 §2.1.4 p-V-T 立体相图 §2.1.5 纯流体p-V-T关系的应用及思考
4
§2.1.1 T –V 图
在常压下加热水
T 5
2 1
3 4
5
v
6
临界点
§2.1.1 T -V图
气体
液体
液体和蒸汽
饱和液相线 (泡点线) 饱和汽相线 (露点线)
表1 各种气体的Tc、pc以及正常沸点Tb
物质 Tc , ℃ pc ,atm Tb , ℃ 燃烧值,kJ/g
甲烷 乙烷 丙烷 正丁烷 正戊烷 正己烷
-82.62 32.18 96.59 151.9 196.46 234.4
45.36 48.08 41.98 37.43 33.32 29.80
-161.45 -88.65 -42.15 -0.5 36.05 68.75
具有气体一样的低粘度和高扩散系数。 在临界状态附近 ,溶质在超临界流体中的溶解度
对T、P的变化很敏感 ;
T、P微小变化会导致溶解度有几个数量级的突变 ;
超临界流体技术正是利用了这一特性,通过对T、
P的调控来进行物质的分离。
29
3)超临界萃取技术的工业应用: 超临界流体包括 : CO2 、H2O、甲苯、甲醇、乙醇等。 只有CO2 应用最多。价廉、易得、无毒,具有惊人的溶解 能力。 临界条件温和:Tc=31.1 ℃ ;pc =7.4MPa。
34
§2.2.1 状态方程(EOS)的定义
EOS是计算热力学性质最重要的模型之一。 为何?
1. EOS是物质P-V-T关系的解析式.即用一个EOS
即可精确地代表相当广泛范围内的P、V、T实验数据, 借此可精确地计算所需的P、V、T数据。 2. 用EOS可计算不能直接从实验测定的其它热力学 性质——(H,S,G)数据。
体分子本身的体积可忽略不计。
•理想气体EOS是f(P,V,T) =0 中最简单的一种形式。
36
研究理想气体的实际意义
1 在较低压力和较高温度下可用理想气体方程 进行计算。
例如:在大气环境下的空气、氮气以及常压高温
条件下的燃烧烟气等均可视为理想气体。
2 为真实气体状态方程计算提供初始值。
3 判断真实气体状态方程的极限情况的正确程 度,当 P 0 或者 V 时,任何的状 态方程都还原为理想气体方程。
5 4 1
3(T降低)
2
17
V
【例2-2】
: 现有一过程,从pV 图的状态点 a( 过 热蒸气 ) 出发,到达 状态点d(过冷液 体)可以有两种途 径:①均相途径 (a→b→c→d) ; ② 非 均 相 途 径 (a→b’→ c’→d) 。 请在 p-T 图上画出 对应的路径。
18
【例2-2】
7
§2.1.2 P-V图
P 0.2Mpa P 1Mpa T =150 C
o
P 0.4762Mpa T =150oC
P 0.4762Mpa T =150 C
o
P 0.4762Mpa T =150oC
T =150oC
P s (T1 ) P s (T2 )
T Tc Tc T1 Tc T2 Tc
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀 4)饱和液体恒容加热; 5) 在临界点进行的恒温膨胀
16
P
C
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀; 4)饱和液体恒容加热; 5)在临界点进行的恒温膨胀
甲烷 乙烷 丙烷
Ⅹ 32.18 ℃ Ⅹ
151.9℃
室内压力 1atm
27
4. 超临界流体萃取技术
1)定义:在T>Tc和P>Pc区域内,气体、液体变得不可区 分,形成的一种特殊的流体,称为超临界流体。
超临界流体区
(T>Tc和P>Pc)
28
2)特点:超临界流体兼具气体和液体两者的优点。
具有液体一样的溶解能力和密度等 ;
汽化曲线、熔化曲线、升华曲线
三相点(Tt,Pt)和临界点(Tc,Pc,Vc) 等容线
临界等容线V=Vc、V>Vc、V<Vc
13
§2.1.4 P-V-T立体相图
P-V-T立体相图
14
§2.1.4 P-V-T立体相图
水的P-V-T立体相图
15
【例2-1】 将下列纯物质经历的过程表示在 p-V图上:
2点、3线、
4区
临界等容线
液固平衡线
超临界流体区 液体区
(T>Tc和P>Pc)
临界点 固体区
汽液平衡线
气体区
三相点F=C-P+2=0
12
汽固平衡线
水的三相点:0.0098℃
P-T图的特征、相关概念
问:室温下能否通过加压使天然气变成LNG ? 气体“液化”的先决条件是物质T<Tc。
22
临界点——最重要的性质
23
2. 制冷剂的选择
在选择氟里昂替代品时,离不开p-V-T数 据。 制冷剂工作特点:低压饱和蒸汽室温下饱 和液体交替变化。 对制冷剂的要求:
§2.1.1 T -V图 §2.1.2 P-V图 §2.1.3 P-T图 §2.1.4 P-V-T立体相图 §2.1.5 纯流体P-V-T关系的应用
21
§2.1.5 纯流体p-V-T关系的应用
1.气体液化和低温技术 流体p-V-T关系的最大应用就是气体的液化。 如空气液化、天然气液化。 为了便于储运,一般需将天然气制成液化天然气 (LNG)。
1)由于刚性容器体积保持不变, 因此加热过程在等容线上变化,到 达B1时,汽液共存相变为液相单相; 继续加热,当T>Tc,则最终单相为 超临界流体,即C1点。
2)当水慢慢加热后,则状态从位 于汽液共存区的A2,变为汽相单相 B2,继续加热,当T>Tc,则最终 单相为临界流体C2。
20
§2.1 纯流体的P-V-T相图
1)临界温度要高,否则在常温或普通低温范 围内不能被液化; 2) 在冷凝温度下的蒸汽压也不宜过高; 3)为了使蒸发压力高于大气压力。
制冷剂的选择离不开p-V-T数据。
24
3.液化气成分的选择 【例2-4】液化气是理想的气体燃料。对家庭用液化气 的要求是加压后变成液体储于高压钢瓶里,打开减压阀 后即汽化,以便燃烧。请你根据对液化气储存和使用的 要求来选择液化气成分。
溶液+萃取质A 原料A+B 萃取质A
萃取
萃取残质B
循环萃取剂
分离
新鲜萃取剂
33
§2.2 状态方程(EOS)
§2.2.1 状态方程(EOS)的定义 §2.2.2 理想气体的状态方程 §2.2.3 气体的非理想性 §2.2.4 真实气体的状态方程 §2.2.4.1 van der Waals范德华状态方程 §2.2.4.2 Redlich-Kwong状态方程 §2.2.4.3 Soave- Redlich-Kwong状态方程 §2.2.4.4 Peng-Robinson状态方程 §2.2.4.5 Virial(维里)状态方程 §2.2.5 状态方程的小结
恒温线
9
临界点—p-V-T中最重要的性质
1)Tc、pc 是纯物质能够呈现汽液平衡时的最高温度 和最高压力。 要使气体液化温度绝对不能超过Tc 。 气体“液化”的先决条件是T<Tc,否则无论施加多大 的压力都不可能使之液化。 2)临界等温的数学特征:等于临界温度的等温线在 临界点出现水平拐点。 P V TC 0 在C点 重要! 10 2 P V 2 TC 0 在C点
8
§2.1.2 P-V图
临界点
P
T 1点、2线、 2 2
V 0
P V
在C点 4区 T 0 在C点
④
超临界流体区 (T>Tc和P>Pc)
①过冷液体区L
③汽液两相平衡区 F=C-P+2=1
②过热蒸汽区
什么是正 常沸点?
①饱和液相线
(泡点线)
②饱和汽相线 (露点线 )
30
各种溶剂的临界特性
流体名称 分子式 临界压力 (bar) 临界温度 (℃) 临界密度 (g/cm3)
二氧化碳
水 氨
CO2
H2 O NH3
72.9
217.6 112.5
31.2
374.2 132.4
0.433
0.332 0.235
乙烷
乙烯 氧化二氮 丙烷 戊烷 丁烷
C2H6
C 2 H4 N2O C 3 H8 C5H12 C4H10
如何描述两相共存区不同的状态点?
纯物质从饱和液体点D到饱和蒸汽点E,
T和P保持不变的,只有体积在变化。
x
V Vl 1 x Vg x
( x — 干度。 x 1 0 指饱和蒸汽在湿蒸汽
Vg V
11
·
Vl
中所占的mol或wt )
·
—系统所处两相状态点。
§2.1.3 P-T图
有了p-V-T关系,热力学的大多数问题均可得到解 决。
2
第二章 内容
§2.1 纯流体的p-V-T相图 §2.2 气体状态方程(EOS) §2.3 对应态原理和普遍化关联式 §2.4 液体的p-V-T性质 §2.5 真实气体混合物p-V-T关系
§2.6 §2.1.1 T –V 图 §2.1.2 p-V 图 §2.1.3 p-T 图 §2.1.4 p-V-T 立体相图 §2.1.5 纯流体p-V-T关系的应用及思考
4
§2.1.1 T –V 图
在常压下加热水
T 5
2 1
3 4
5
v
6
临界点
§2.1.1 T -V图
气体
液体
液体和蒸汽
饱和液相线 (泡点线) 饱和汽相线 (露点线)
表1 各种气体的Tc、pc以及正常沸点Tb
物质 Tc , ℃ pc ,atm Tb , ℃ 燃烧值,kJ/g
甲烷 乙烷 丙烷 正丁烷 正戊烷 正己烷
-82.62 32.18 96.59 151.9 196.46 234.4
45.36 48.08 41.98 37.43 33.32 29.80
-161.45 -88.65 -42.15 -0.5 36.05 68.75
具有气体一样的低粘度和高扩散系数。 在临界状态附近 ,溶质在超临界流体中的溶解度
对T、P的变化很敏感 ;
T、P微小变化会导致溶解度有几个数量级的突变 ;
超临界流体技术正是利用了这一特性,通过对T、
P的调控来进行物质的分离。
29
3)超临界萃取技术的工业应用: 超临界流体包括 : CO2 、H2O、甲苯、甲醇、乙醇等。 只有CO2 应用最多。价廉、易得、无毒,具有惊人的溶解 能力。 临界条件温和:Tc=31.1 ℃ ;pc =7.4MPa。
34
§2.2.1 状态方程(EOS)的定义
EOS是计算热力学性质最重要的模型之一。 为何?
1. EOS是物质P-V-T关系的解析式.即用一个EOS
即可精确地代表相当广泛范围内的P、V、T实验数据, 借此可精确地计算所需的P、V、T数据。 2. 用EOS可计算不能直接从实验测定的其它热力学 性质——(H,S,G)数据。
体分子本身的体积可忽略不计。
•理想气体EOS是f(P,V,T) =0 中最简单的一种形式。
36
研究理想气体的实际意义
1 在较低压力和较高温度下可用理想气体方程 进行计算。
例如:在大气环境下的空气、氮气以及常压高温
条件下的燃烧烟气等均可视为理想气体。
2 为真实气体状态方程计算提供初始值。
3 判断真实气体状态方程的极限情况的正确程 度,当 P 0 或者 V 时,任何的状 态方程都还原为理想气体方程。
5 4 1
3(T降低)
2
17
V
【例2-2】
: 现有一过程,从pV 图的状态点 a( 过 热蒸气 ) 出发,到达 状态点d(过冷液 体)可以有两种途 径:①均相途径 (a→b→c→d) ; ② 非 均 相 途 径 (a→b’→ c’→d) 。 请在 p-T 图上画出 对应的路径。
18
【例2-2】
7
§2.1.2 P-V图
P 0.2Mpa P 1Mpa T =150 C
o
P 0.4762Mpa T =150oC
P 0.4762Mpa T =150 C
o
P 0.4762Mpa T =150oC
T =150oC
P s (T1 ) P s (T2 )
T Tc Tc T1 Tc T2 Tc
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀 4)饱和液体恒容加热; 5) 在临界点进行的恒温膨胀
16
P
C
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀; 4)饱和液体恒容加热; 5)在临界点进行的恒温膨胀
甲烷 乙烷 丙烷
Ⅹ 32.18 ℃ Ⅹ
151.9℃
室内压力 1atm
27
4. 超临界流体萃取技术
1)定义:在T>Tc和P>Pc区域内,气体、液体变得不可区 分,形成的一种特殊的流体,称为超临界流体。
超临界流体区
(T>Tc和P>Pc)
28
2)特点:超临界流体兼具气体和液体两者的优点。
具有液体一样的溶解能力和密度等 ;
汽化曲线、熔化曲线、升华曲线
三相点(Tt,Pt)和临界点(Tc,Pc,Vc) 等容线
临界等容线V=Vc、V>Vc、V<Vc
13
§2.1.4 P-V-T立体相图
P-V-T立体相图
14
§2.1.4 P-V-T立体相图
水的P-V-T立体相图
15
【例2-1】 将下列纯物质经历的过程表示在 p-V图上:
2点、3线、
4区
临界等容线
液固平衡线
超临界流体区 液体区
(T>Tc和P>Pc)
临界点 固体区
汽液平衡线
气体区
三相点F=C-P+2=0
12
汽固平衡线
水的三相点:0.0098℃
P-T图的特征、相关概念
