热量衡算2
热量衡算——精选推荐

第二章 能量衡算2.1 能量衡算概述物料衡算完成后,对于没有传热要求的设备,可以由物料处理量,物料的性质及工艺要求进行设备的工艺设计,以确定设备的型式,台数,容积以及重要尺寸。
对于有传热要求的设备则必须通过能量衡算,才能确定设备的主要工艺尺寸。
无论进行物理过程的设备或是化学过程的设备,多数伴有能量传递过程,所以必须进行能量衡算。
2.2 能量衡算目的对于新设计的生产车间,能量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小,所处理物料的性质及工艺要求在选择传热面的型式,计算传热面积,确定设备的主要尺寸。
传热所需要的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
对于有些伴有热效应的过程,其物料衡算也要通过与能量衡算的联合求解才能得出最后的结果。
2.3 能量衡算依据能量衡算的主要依据是能量守恒定律。
能量守恒定律是以车间物料衡算的结果为基础而进行的。
2.4 能量衡算过程 2.4.1 反应釜的热量衡算反应工段的热量衡算主要体现在反应釜和夹套。
对于有传热要求的的设备,其热量衡算为:654321Q Q Q Q Q Q ++=++;式中 1Q —物料带入到设备的热量kJ ; 2Q —加热剂传给设备的热量kJ ; 3Q —物理变化及化学反应的热效应kJ ; 4Q —物料离开设备所带走的热量kJ ; 5Q —消耗于提高设备本身温度的热量kJ ; 6Q —设备向环境散失的热量kJ 。
物料热量衡算以天为单位。
1Q 与4Q 的计算1Q 与4Q 均可按照下式计算:()tkJ mc Q Q p ∑=41 式中m —输入或输出设备的物料量,kgp c —物料的平均比热容,()C kg kJ ︒⋅/t —物料的温度,℃。
该式的计算标准是标准状态,即Pa C 3101013.10⨯︒及为计算标准。
固体和液体的比热容可以采用下式计算:Mn c c p ∑⋅=α184.4; []1式中:αc —元素的原子比热容,()C kg kJ ︒⋅/ ;n —分子中同一原子的原子数;M —化合物的分子量,kmol kg /。
热量衡算

热量衡算1计算方法与原则1.1热量衡算的目的及意义热量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小、所处理物料的性质及工艺要求再选择传热面的形式、计算传热面积、确定设备的主要工艺尺寸。
传热所需的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
1.2热量衡算的依据及必要条件热量衡算的主要依据是能量守恒定律,其数学表达式为Q1+ Q2+Q3=Q4+Q5+Q6 式1其中:Q1——物料带入到设备的热量,kJQ2——加热剂或冷却剂传给设备和所处理物料的热量,kJQ3——过程热效应,kJQ4——物料离开设备所消耗的热量,kJQ5——加热或冷却设备所消耗的热量,kJQ6——设备向环境散失的热量,kJQ1(Q4)=Σ mC P(t2- t0) kJ式2m——输入或输出设备的物料质量,kgC P——物料的平均比热容,kJ/(kg•℃)t2——物料的温度,℃t0——基准温度,℃Q5=Σ C P M (t2-t1) kJ式3M——设备各部件的质量,kgC P——设备各部件的比热容,kJ/(kg•℃)t1——设备各部件的初始温度,℃t——设备各部件的最终温度,℃2Q5+Q6=10%Q总式4热量衡算是在车间物料衡算的结果基础上而进行的,因此,车间物料衡算表是进行车间热量衡算的首要条件。
其次还必须收集有关物质的热力学数据,例如比热容,相变热,反应热等。
本设计还将涉及到的所有物料的热力学数据汇总成表4,以便于后期的计算。
1.3热量衡算基准因为物料衡算计算的是各个岗位的天处理量,所以热量衡算计算的也是某个设备天换热介质消耗量,同时温度基准采用的是0℃做基准。
当然,进行传热面积校核时,是根据批处理量计算。
2全车间物料热力学数据的估算2.1所用纯化合物比热的推算0i i pMc n C ∑=式 5式中M ——化合物分子量;n i ——分子中同种元素原子数; c i ——元素的原子比热容,kJ/(kg•℃)查《制药工程工艺设计》P111,得到原子的摩尔热容相关数据,见表1表1 元素原子的摩尔热容单位:kcal/( kmol•℃)(当物质为固体时,各原子的C a 取值近似值)原子 C a 原子 C a 原子 C a 碳C 2.8 氧O 6.0 氮N 2.6 氢H4.3硫S7.4其他8.0(当物质为液体时,各原子的C a 取值近似值)而在实际生产的过程中遇到的物质大多是混合物,极少数的混合物有实验测定的热容数据,一般都是根据混合物内各种物质的热容和组成进行推算的,其中杂质的含量极少,热效应可以忽略不计。
热量衡算

热量衡算与热交换计算热量衡算与热交换计算一、热量衡算传热计算根据总传热方程进行:Q=KA△tm对于一个热交换器,传热计算的内容有两种,一为设计计算,即根据给定的传热量,确定热交换器的几何尺寸和结构参数;二为校核计算,即对某些热交换器,根据它的尺寸和结构进行校核,看其能否满足传热量的要求。
这两种计算的关键都在于传热面积是否合适,计算的基本依据是总传热方程以及与之相关的热量衡算式,在第四节中,已对总传热方程进行了较为详细的讨论,下面介绍热交换中的热量衡算式。
当热损失为零时,对热交换器作热量衡算可得到单位时间的传热量,此传热量又叫热负荷,即式3-20中的传热速率Q。
热负荷分为两种,即工艺热负荷和设备热负荷,工艺热负荷是指工艺上要求的在单位时间内需要对物料加入或取出的热量,用QL表示,单位为W。
设备热负荷是热交换器所具备的换热能力,所以设备热负荷也就是热交换器的传热速率Q。
当热损失不可忽略时,为满足工艺要求,Q应大于QL。
由热量衡算得到的是工艺热负荷QL。
如果流体不发生相变化,比热取平均温度下的比热,则有:QL=whcph(T1-T2)=wccpc(t2-t1) ( 3-29)式中w----流体的质量流量,kg/s;cp----流体的平均定压比热,kJ/(kg•K);T----热流体温度,K;t----冷流体温度,K;(下标h和c分别表示热流体和冷流体,下标1和2表示热交换器的进口和出口)式3-29是热交换器的热量衡算式,也称为热平衡方程。
若流体在换热过程中有相变,例如饱和蒸汽冷凝成同温度冷凝液时,则有:QL=whr=wccpc(t2-t1) (3-30)式中wh----饱和蒸汽的冷凝速率,kg/s;r----饱和蒸汽的冷凝潜热,kJ/kg;当饱和蒸汽在热交换器中冷凝后,冷凝液液温度继续下降到T2,两部分热量(即潜热和显热)要加起来计算,这时:QL=wh[r+cph(Ts-T2)]=wccpc(t2-t1)式中cph-----冷凝液的比热,kJ/kg•K;Ts------冷凝液饱和温度,K。
热量衡算
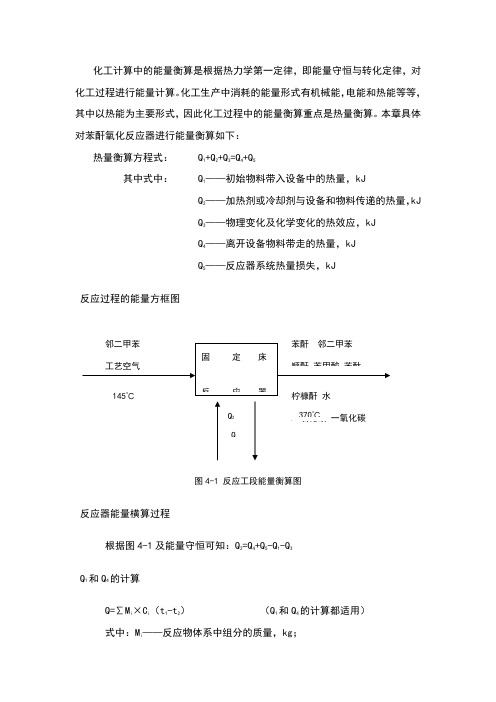
化工计算中的能量衡算是根据热力学第一定律,即能量守恒与转化定律,对化工过程进行能量计算。
化工生产中消耗的能量形式有机械能,电能和热能等等,其中以热能为主要形式,因此化工过程中的能量衡算重点是热量衡算。
本章具体对苯酐氧化反应器进行能量衡算如下:热量衡算方程式: Q1+Q2+Q3=Q4+Q5其中式中: Q1——初始物料带入设备中的热量,kJQ2——加热剂或冷却剂与设备和物料传递的热量,kJQ3——物理变化及化学变化的热效应,kJQ4——离开设备物料带走的热量,kJQ5——反应器系统热量损失,kJ反应过程的能量方框图图4-1 反应工段能量衡算图反应器能量横算过程根据图4-1及能量守恒可知:Q2=Q4+Q5-Q1-Q3Q1和Q4的计算Q=∑Mi×Ci(t1-t2)(Q1和Q4的计算都适用)式中:Mi——反应物体系中组分的质量,kg;C i ——组分i 在0-T℃时的平均比热容,KJ/; t 1,t 2——反应物系在反应前后的温度,℃。
物料进入设备时的温度为145℃,热量衡算的基准为145℃,△T=0,则: Q 1=0查得各物项平均比热容数据: (kJ/kg.℃)表4-1 各物相平均比热容所以: ()21i i 4t C M Q t -=∑=××(370-145)+××225+××225+××225+××225+××225+××225+××225+××225+××225+××225=.4kJ 过程Q 3的计算过程热效率可以分为两类:一类是化学过程的热效率即化学反应速率;另一类是物理过程热效率。
物料化学变化过程,除化学反应外,往往伴随着物料状态变化热效率,但本工艺流程中物理过程热效率较低,可以忽略不计,该过程皆为放热反应,则过程热效率可以由下式计算:主反应:C 8H 10+3O 2→C 8H 4O 3+3H 2O + Q 3-1=×103×=×103kJ/h副反应:CH 3C 6H 4CH 3+→C 4H 2O 3(顺酐)+4CO 2+4H 2O + Q 3-2=×103×=×103kJ/hCH 3C 6H 4CH 3+3O 2→C 6H 5COOH (苯甲酸)+CO 2+2H 2O +Q3-3=×103×=×103kJ/hCH3C6H4CH3+2O2→C8H6O2(苯酞)+2H2O +Q3-4=×103×=×103kJ/hCH3C6H4CH3+→C5H5O3(柠槺酐)+3CO+3H2O +Q3-5=×103×=×103kJ/hCH3C6H4CH3+→8CO+5H2O +Q3-6=×103×=×103kJ/hCH3C6H4CH3+→8CO2+5H2O +Q3-7=×103×=×103kJ/h 继而得到:Q 3 = Q3-1+Q3-2+Q3-3+Q3-4+Q3-5+Q3-6+Q3-7 =×103kJ/hQ5的计算该反应中的热损失按5%计算,即:Q 5=5%×(Q1+Q3)=5%×(0+×103)=×103kJ/hQ2的计算Q2为熔岩移出反应器的热量,由反应器热量守恒可知:Q 2=Q4+Q5-Q1-Q3=.8kJ/h反应器能量衡算表根据以上计算列出氧化反应工段能量衡算表格如下:表4-2 反应工段能量衡算表(吸收热量为“+”,释放热量为“-”)。
热量衡算

热量衡算1计算方法与原则1.1热量衡算的目的及意义热量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小、所处理物料的性质及工艺要求再选择传热面的形式、计算传热面积、确定设备的主要工艺尺寸。
传热所需的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
1.2热量衡算的依据及必要条件热量衡算的主要依据是能量守恒定律,其数学表达式为Q1+ Q2+Q3=Q4+Q5+Q6 式1其中:Q1——物料带入到设备的热量,kJQ2——加热剂或冷却剂传给设备和所处理物料的热量,kJQ3——过程热效应,kJQ4——物料离开设备所消耗的热量,kJQ5——加热或冷却设备所消耗的热量,kJQ6——设备向环境散失的热量,kJQ1(Q4)=Σ mC P(t2- t0) kJ式2m——输入或输出设备的物料质量,kgC P——物料的平均比热容,kJ/(kg•℃)t2——物料的温度,℃t0——基准温度,℃Q5=Σ C P M (t2-t1) kJ式3M——设备各部件的质量,kgC P——设备各部件的比热容,kJ/(kg•℃)t1——设备各部件的初始温度,℃t——设备各部件的最终温度,℃2Q5+Q6=10%Q总式4热量衡算是在车间物料衡算的结果基础上而进行的,因此,车间物料衡算表是进行车间热量衡算的首要条件。
其次还必须收集有关物质的热力学数据,例如比热容,相变热,反应热等。
本设计还将涉及到的所有物料的热力学数据汇总成表4,以便于后期的计算。
1.3热量衡算基准因为物料衡算计算的是各个岗位的天处理量,所以热量衡算计算的也是某个设备天换热介质消耗量,同时温度基准采用的是0℃做基准。
当然,进行传热面积校核时,是根据批处理量计算。
2全车间物料热力学数据的估算2.1所用纯化合物比热的推算0i i pMc n C ∑=式 5式中M ——化合物分子量;n i ——分子中同种元素原子数; c i ——元素的原子比热容,kJ/(kg•℃)查《制药工程工艺设计》P111,得到原子的摩尔热容相关数据,见表1表1 元素原子的摩尔热容单位:kcal/( kmol•℃)(当物质为固体时,各原子的C a 取值近似值)原子 C a 原子 C a 原子 C a 碳C 2.8 氧O 6.0 氮N 2.6 氢H4.3硫S7.4其他8.0(当物质为液体时,各原子的C a 取值近似值)而在实际生产的过程中遇到的物质大多是混合物,极少数的混合物有实验测定的热容数据,一般都是根据混合物内各种物质的热容和组成进行推算的,其中杂质的含量极少,热效应可以忽略不计。
化工中物料衡算和热量衡算公式

化工中物料衡算和热量衡算公式一、物料衡算公式1.物料总量计算公式物料总量计算公式可以根据物质的密度(ρ)和体积(V)来计算。
公式如下:物料总量=密度×体积2.物料质量计算公式物料质量计算公式可以根据物质的密度(ρ)、体积(V)和物质的质量(m)之间的关系得出。
公式如下:质量=密度×体积3.物料浓度计算公式物料浓度计算公式可以根据溶质的质量(m)和溶液的体积(V)来计算。
公式如下:浓度=质量/体积4.溶液的重量和体积之间的关系溶液的重量可以根据溶液的密度(ρ)和溶液的体积(V)相乘得到。
公式如下:重量=密度×体积1.热量传递计算公式热量传递计算公式可以用于计算传热功率(Q)和传热面积(A)之间的关系。
公式如下:Q=h×A×ΔT其中,h为传热系数,ΔT为温差。
2.物料的热量计算公式物料的热量计算公式可以根据物料的质量(m)、比热容(Cp)和温度变化(ΔT)来计算。
公式如下:热量=质量×比热容×温度变化3.水的蒸发热计算公式水的蒸发热计算公式可以根据水的质量(m)和蒸发热(ΔHvap)来计算。
热量=质量×蒸发热三、补充说明1. 密度(ρ)是物质单位体积的质量,常用的单位有千克/立方米(kg/m^3)或克/立方厘米(g/cm^3)。
2. 比热容(Cp)是物质单位质量的热容量,表示单位质量物质温度升高1℃所需的热量,常用的单位是千焦/千克·℃(kJ/kg·°C)或焦/克·℃(J/g·°C)。
3.传热系数(h)是衡量热传导性能的参数,表示单位面积上的热量流入或流出的速率,常用的单位是瓦特/平方米·℃(W/m^2·°C)。
4.温度变化(ΔT)是物质的温度差,常用的单位是摄氏度(℃)或开尔文(K)。
5. 蒸发热(ΔHvap)是物质从液态转变为气态所需的热量,常用的单位是焦耳/克(J/g)或千焦/千克(kJ/kg)。
物料衡算和热量衡算

3 物料衡算和热量衡算计算基准年产 4500 吨的二氯甲烷氯化吸取,年工作日 330 天,每天工作 24 小时,每 小时产二氯甲烷:物料衡算和热量衡算反响器的物料衡算和热量衡算本反响为强放热反响,如不把握反响热并移走,温度会急剧上升,产生猛烈的燃烧反响, 是氯化物发生裂解反响。
由此可以通过参与过量的甲烷得到循环气,以之作为稀释剂移走反 应热。
〔一〕 计算依据〔1〕 二氯甲烷产量为: kg/h ,即: kmol/h ; 〔2〕 原料组成含: Cl 2 96%,CH 495%;(3) 进反响器的原料配比〔摩尔比〕: Cl 2:CH 4:循环气=1: (4) 出反响器的比例: CH 2Cl 2:CHCl 3=1:〔质量比〕(CHCl 3+CCl 4)/CH 2Cl 2=〔摩尔比〕;(5) 操作压力: 〔表压〕;(6) 反响器进口气体温度 25o C ,出口温度 420o C 。
〔二〕 物料衡算反Cl 2应CH 3Cl CH 2Cl 2 CHCl 3CH 4CCl 4 HCl假设循环气不参与反响,只起到带走热量的作用。
则设进口甲烷为 X kmol/h ,=h出反响器的一氯甲烷Y kmol/h,氯化氢Z kmol/h。
由进反响器的原料配比〔摩尔比〕Cl2:CH4:循环气=1:原料组成含: Cl2 96%,CH495%。
由CH2Cl2:CHCl3=1:〔质量比〕可得CHCl3每小时产量为:×=h由(CHCl3+CCl4)/CH2Cl2=〔摩尔比〕可得CCl4的量为×-=h用元素守衡法则:Cl 元素守衡=Y+×2+×3+×4+Z ①H 元素守衡4X=3Y+×2++Z ②C 元素守衡X=Y+++ ③解方程①①③得X=hY=hZ=h (1)所以反响器进口原料中各组分的流量:Cl2: ×=h=h 〔纯〕=h=h 〔含杂质〕CH4: h=h 〔纯〕=h=h 〔含杂质〕循环气流量:3×= kmol/h= Nm3/h其中:CH3Cl:kmol/hN2:×4%+×3%= kmol/hCO2:×2%= kmol/h可知:= 得进口Cl2为kmol/h3 CH 4:---= kmol/h进口气体总量: ++= kmol/h(2) 反响器出口中各组分流量:CH 3Cl : kmol/h CH 2Cl 2: kmol/h CHCl 3 : kmol/h CCl 4: kmol/h HCl : kmol/h 循环气: kmol/h出口气体总量:++++= kmol/h(3) 出口气体中各组分的含量:CH 3Cl : ×100%=%CH 2Cl 2:×100%=%CHCl : ×100%=% CCl 4: ×100%=% HCl : ×100%=% N 2:×100%=%CO 2: ×100%=% CH 4: ×100%=%表 3—1 反响器物料平衡组分kmol/h反响器进口组成%〔mol 〕 kg/h反响器出口kmol/h组成%〔mol 〕 kg/hCH 4 Cl 2 CH 3Cl CH 2Cl 22 2CHCl 3 CCl 4 HClN 2 CO 2 总计100 100〔三〕 热量衡算以 25℃为基准温度由《氯碱工业理化常数手册》查得如下数据:420℃时,由《氯碱工业理化常数手册》查得如下数据:物质n(kmol)CH 3ClCH 2Cl 2CHCl 3CCl 4HClN COΔt = 420-25=395℃输入焓:∑输入H = 0表 3—2 反响物料标准摩尔生成焓Δf/〔kJ/mol 〕 物质输入 输出CH 4Cl 2CO 2CH 3Cl CH 2Cl 2 CHCl 3 CCl 4HCln(kmol) Δf0 -100Δ f =∑ 生成物 n Δ H θ-∑ f m 反响物n Δ H θ=-×106 kJ f m 表 3—3 生成物的标准摩尔定压热容/(J ﹒K -1﹒mol -1)输出焓:∑ 输出 H = ∑nΔt = ×106 kJ℃时,由《氯碱工业理化常数手册》查得如下数据:物质n(kmol) CH4CH3Cl N2CO2考虑4%热损失,则×106×〔1-4%〕=则Q = Q放出带出循环气能带走的热量恰好为反响气放出的热量,是反响温度保持在420℃左右可以维持反响顺当进展。
第二节热量平衡计算.

Q6=15%(Q6+Q6) 4.把上述结果代码(5-17)式可得出麦汁煮沸
总耗热
Q6=115%(Q6+Q6) =12537830(kJ)
(七)糖化一次6 总耗热量Q总
Q总 Qi 21043661 (kJ) i1
=3.67〔kJ/(kg·K)〕
(4)故Q4=26.7%G混合C混合(100-70) =559860(kJ)
2.二次煮沸过程蒸汽带走的热量Q4 煮沸时间为10min,蒸发强度5%,则蒸发水分 量为:
V2=26.7%G混合5%1060 =42.4(kg)
故Q4=IV2=2257.242.4 =95705.3(kJ)
4.确定合适的计算基准
在热量衡算中,取不同的基准温度,算出的 (5-8)式中各项数据就不同。所以必须选准 一个设计温度,且每一物料的进出口基准态必 须一致。通常,取0℃为基准温度可简化计算。
此外,为使计算方便、准确,可灵活选取 适当的基准,如按100kg原料或成品、每小时 或每批次处理量等作基准进行计算。
5.进行具体的热量计算 (1)物量带入的热量Q1和带出热量Q4可按下式
计算,即: Q=ΣGct
式中 G——物料质量(kg) c——物料比热容〔kJ/(kg·K)〕 t——物料进入或离开设备的温度(℃)
(2)过程热效应Q3 过程的热效应主要有生物合 成热QB、搅拌热QS和状态热(例如汽化热、溶 解热、结晶热等):
=4680041(kJ)
(六)麦汁煮沸过程耗热量Q6 Q6=Q6+Q6+Q3
1.麦汁升温至沸点耗热量Q6 2.煮沸过程蒸发耗热量Q6 3.热损失 Q3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H m ,HCHO g H
0 f ,HCHO
C P ,HCHO dT 113.65kJ/mol
298
423
输出: H m ,CO g H
2
0 f ,CO 2
C P ,CO 2 dT 388.77kJ/mol
298
423
H m ,H2Og H
3.3.4 化学反应过程的热量衡算
150℃ HCHO(g) 30mol CH4 10mol CO2 10mol H2O(g) 50mol O2 50mol N2 376mol
C pm ,H2O g 34.05 C pm ,CH4 38.98
查得各组分摩尔热容为:单位 J/(mol· K)
H mi C pi dT
298 T
适用条件:用于单一反应。
1.基准态的选取
3.3.4 化学反应过程的热量衡算
第二种基准态:298K、101.3kPa,组成各反应物 及产物的元素稳定态单质状态。对于非反应物质可 另选适当的温度。
热平衡式:
H ni H mi 输出 ni H mi 输入
3.3.4 化学反应过程的热量衡算
• 当发生化学反应时,应将反应热列入总平衡式。 • 热平衡式的形式取决于焓的基准态。 1.基准态的选取 第一种基准态:298K、101.3kPa的各反应物及产 物状态。对于非反应物质可另选适当的温度。 热平衡式:
H rm Q H n AR ni H mi 出 - ni H mi 入 A
15393 .737 kJ/h
10 388.7 50 237.94 100 74.85 100 2.2245
1.基准态的选取
3.3.4 化学反应过程的热量衡算
作业:
工业上用一氧化碳和水反应生产氢,反应方程式为
CO(g) H 2 O(g) CO 2 (g) H 2 (g)
4 4
H m,O2 g CP,O2 dT 0.02966 373 298 2.2245 kJ/mol
373 298
H m , N 2 g 0
输出:
H m ,CH 4 g H
0 f ,CH 4
C P ,CH 4 dT 74.85 0.03898 423 298 -69.98kJ/m ol
热平衡式
5 6 nO 2 (g) 400 200 150 mol/h 200 300 mol/h 4 4 H rm Q H n AR ni H mi 出 - ni H mi 入
A
各组分焓值的计算 输入: H m,NH g 0
3
H m,O2 g 0
CH4(g)+O2 = HCHO(g)+H2O(g) CH4(g)+2O2 = CO2+2H2O(g) 甲烷于25℃进入反应器,空气于100℃进入反应器, 要保持出口产物为150℃,需从反应器取走多少热量? 以100mol进反应器的甲烷为计算基准,物料衡算结果 如图所示。
1.基准态的选取
例5
25℃ CH4 100mol 100℃ N2 376mol O2 100mol
1.基准态的选取
例4
NH3 200mol∙h-1 25℃ O2 400mol∙h-1
3.3.4 化学反应过程的热量衡算
NO 200mol∙h-1 H2O 300mol∙h-1 O2 150mol∙h-1 300℃
查得25~300℃各组分摩尔热容为:单位 J/(mol· K)
C pm,O2 30.50
C pm ,H2O g 34.80
Cp,NO 29.50 0.8188102 T 0.2925105T 2 0.3652109 T 3
解:以题中所给进料为计算基准,选择第一种基准态。 物料衡算: 出口物料中 nNO(g) 200mol/h
nH 2O(g)
如要求生产能力为20kmolH2/h,水蒸汽和一氧化碳 于150℃进入反应器,反应产物于500℃放出,水蒸 汽以50%过量加入,反应进行完全。计算应传给反 应器或从反应器传出多少热量?已知热力学数据如 下表所示。画出衡算简图。 组分 H 0 f /(kJ/mol) C P /(J/mol· K) CO2 (g) -393.7 45.08 H2O(g) -242.2 34.9 CO (g) -110.6 29.35 H2(g) -29.29
H mi 298
适用条件:多用于多个反应,且反应过程详情不 知的情况。
1.基准态的选取
例4 氨氧化反应式为
3.3.4 化学反应过程的热量衡算
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) 0 此反应在25℃,1atm的反应热为H rm = - 904.6kJ/mol, 现有25℃的200molNH3/h和400molO2/h连续进入反应器, 氨在反应器内全部反应,产物于300℃呈气态离开反应 器。如操作压力为0.1013MPa,计算反应器输入或输出 的热量。
423 298
0 f ,H 2O
C P ,H2O dT 237.94kJ/mol
298
423
H m ,O2 g C P ,O2 dT 3.7325 kJ/mol
H m ,N2 g C P ,N2 dT 1.463kJ/mol
298
423
于是 Q 60 69.98 50 3.7325 3761.463 30 113.65
输出: H m,NO g 298 CP,NO(g) dT 9020.16J/mol 9.0202kJ/mol
Hm,H2Og CPm,H2O(g) 573 298 9570J/mol 9.57kJ/mol
Hm,O2 g CPm,O2 (g) 573 298 8387.5J/mol 8.3875 kJ/mol
573
于是
200 904 .6 Q H 150 8.3875 200 9.0202 300 9.57 0 0 4
39297 kJ/h
1.基准态的选取
3.3.4 化学反应过程的热量衡算
例5 甲烷在连续反应器中用空气氧化生产甲醛,副 反应是甲烷完全氧化生成CO2和H2O。
C pm,O2 29.66 C pm,N2 29.26 C pm ,CO2 39.44
C p ,HCHO 22.79 4.075102 T 0.711105 T 2 8.964109 T 3
解:以25℃、101.3kPa组成反应物和产物的元素稳定 态单质为基准态,非反应物质N2以100℃、101.3kPa为 基准态。 热平衡式 Q H ni H mi 出 - ni H mi 入 各组分焓值计算 Hm,CH g H 0 输入: f ,CH 0 74.85kJ/mol
