标准摩尔反应熵
化学反应的熵变计算

化学反应的熵变计算熵(entropy)是描述系统无序程度或混乱程度的物理量,在化学反应中起着重要的作用。
熵变(ΔS)是指化学反应发生后系统总的熵的变化。
通过计算熵变可以了解反应过程中的熵变化情况,从而得出反应是否倾向于发生或者反应速度的大小。
计算熵变的方法主要包括以下几个步骤:确定化学反应方程式、查找反应物和生成物的标准摩尔熵、计算熵变。
1. 确定化学反应方程式首先,我们需要确定化学反应的方程式。
以A和B反应生成C和D为例,反应方程式可以表示为:A +B →C + D2. 查找反应物和生成物的标准摩尔熵在计算熵变之前,我们需要查找反应物和生成物的标准摩尔熵(S°)。
标准摩尔熵是在标准状态下,物质的摩尔熵值。
这个值可以通过参考资料或者热力学手册获得。
假设反应物A和B的标准摩尔熵分别为S°(A)和S°(B),生成物C 和D的标准摩尔熵分别为S°(C)和S°(D)。
3. 计算熵变熵变的计算公式为:ΔS = ΣS°(生成物) - ΣS°(反应物)根据上述公式,我们可以得到反应的熵变。
例如,假设反应物A和B的标准摩尔熵分别为100 J/mol·K和150J/mol·K,生成物C和D的标准摩尔熵分别为200 J/mol·K和250J/mol·K,则反应的熵变为:ΔS = (S°(C) + S°(D)) - (S°(A) + S°(B))= (200 + 250) - (100 + 150)= 200 J/mol·K通过计算可以得知,在该化学反应中,系统的熵增加了200 J/mol·K。
熵变的正负也可以表明反应的方向性。
如果ΔS > 0,则表示反应过程中系统的熵增加,即反应是自发进行的;如果ΔS < 0,则表示反应过程中系统的熵减少,即反应是不可逆进行的;如果ΔS = 0,则表示反应过程中系统的熵不发生变化,即反应处于平衡状态。
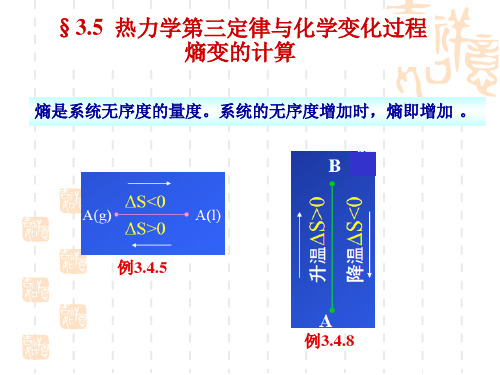
热力学第三定律与化学变化过程熵变的计算
V2 V1
A (U TS) U TS
G (H TS) H TS
答案:(c); (a); (b); (b)
例: 已知1000K时:
反应1: C(石墨)+O2(g)=CO2(g), ΔrGm(1) = –396 kJ·mol–1 反应2: CO(g)+ 1/2O2(g)=CO2(g), ΔrGm (2) = –196 kJ·mol–1 求: 1000K时反应3: C(石墨)+1/2O2(g)=CO (g), ΔrGm(3) = ?
恒温恒压 或 恒温恒容 、 W′=0的过程, 方向与限度?
1. 亥姆霍兹函数
由热力学第二定律 dS
δQ 不可逆 T 可逆
恒温、恒容且 W
dS
0 δQV dU
dU 不可逆 T 可逆
不可逆 dU TdS 0 可逆
A 亥姆霍兹函数
因T 恒定
d U TS
不可逆 0 可逆
(1)定义
A def U TS
——A称为亥姆霍兹(Helmholtz)函数
Sm T f (T)
4. 标准摩尔反应熵
恒T,反应物、产物均处于p 时1mol反应的熵变,
即为标准摩尔反应熵: Δr Sm T
aA(α) T+
标准态
bB(β)
T 标准态Leabharlann r Sm T 假想过程
yYγ
T
+
标准态
zZ(δ)
T 标准态
Δr Sm T νBSm B
B
298.15K时各物质的Sm 可以通过化工手册查到
▪ (b)在绝热密闭的耐压钢瓶中进行一化学反应,应采 。
▪ (c) 将1mol 温度为100℃、压力为101.325kPa的液体水投入一 密封的真空容器中,并完全蒸发为同温同压下的水蒸气,判
第5节:标准摩尔反应熵热三定律讲解

• 不能用于rC在p,m温度范围内有物质呈不同相态的情r况Sm.
•当
很小或温度范围很小时, 可认为 与温度无关.
00-7-30
9
由相变前的标准熵求相变后的标准 熵 例 已知CO2在194.67 K时的摩尔升华焓为 25.30 kJ·mol 1, 固
体CO2在194.67 K时的标准摩尔熵为68.8J ·K 1 ·mol 1 , 求气体 CO2在194.67 K的标准摩尔熵.
rSm ySm(Y) zSm(Z) aSm(A) bSm(B) 由于绝大部分化学反应无法做到可逆地进行, 所以用可 逆热温商来计算化学反应的熵变缺乏可行性.
基于热力学第三定律, 人们能够赋予物质的标准摩尔熵
一个规定值, 从而按照上述定义式就能计算标准摩尔反应熵.
00-7-30
1
能斯特热定理
Tb
C
p,m
(l) dT
vap Hm
T
C
p,m
(g
) dT
Tf
Tf T
Tb
Tb T
其中升温步骤的S 可由实测的
Cp,m/T~T 曲线用图解积分法获得.
0K附近的Cp, m可用德拜公式计算: C p,m CV ,m aT 3 (非金属)
C p,m CV ,m aT 3 bT (金属)
Sm (B,298.15K )通常可以查到.
6
标准摩尔熵规定值的获得
以0K时完美晶体的熵为零作为起点, 计算出1mol纯物质B 在温度为T 的标准态时的熵. 如对某气态物质,
Sm(g, T )
15K aT 3 dT
0T
Ttrs
C
p,m
(cr) dT
trs Hm
15K T
[精品]标准摩尔反应熵
![[精品]标准摩尔反应熵](https://img.taocdn.com/s3/m/b67bd023f02d2af90242a8956bec0975f465a4e2.png)
[精品]标准摩尔反应熵
标准摩尔反应熵(Standard Molar Reaction Entropy,SMRE)是用来度量物质的标准统一反应熵的一个常数。
它是以标准统一熵来定义反应熵的一个重要参数,它的大小决定了热力学等值面多高,进而也影响着热力学反应平衡的位置。
摩尔反应熵可分为标准状态反应熵(Standard State Reaction Entropy)和标准摩尔反应熵(Standard Molar Reaction Entropy)两部分。
标准摩尔反应熵可表示为$ΔS^0 = (Δm^0/M)*ΔH^0/T_0$,这里$Δm^0$为反应物质的相应的摩尔量,$M$为标准摩尔量,$H^0$为反应的标准化能,$T_0$为标准化的温度,$ΔS^0$为标准状态反应熵。
通过计算摩尔数混合物的摩尔反应熵,可以根据反应的过程分析出物质的相变和变性情况,因此标准摩尔反应熵是反应熵热力学分析中不可或缺的参数之一。
标准摩尔反应熵可以通过物理或化学实验测量,但是可以用来确定的反应有限,无法应用于一般的反应系统的分析。
因此,使用经典分子束法(Classical molecular beam)和费米子散射(Fermi scattering)技术结合实验测量的方法来得出反应机理的标准摩尔反应熵的数据,以此来解决问题。
标准摩尔反应熵的测量及应用大大改善了反应熵热力学分析的可用性,使传统的实验方法焕发了新的生机。
标准摩尔反应熵是热力学反应反应走势及计算方式的有力参考,是物质及物质变化的有用参数,对于科学研究及工程应用具有重要的意义。
标准摩尔反应熵

标准摩尔反应熵摩尔反应熵是化学反应中一个非常重要的物理量,它描述了一个化学反应中物质的混乱程度或者无序程度。
标准摩尔反应熵是指在标准状态下,单位摩尔物质在反应中所产生的熵变。
在化学反应中,熵的变化可以帮助我们理解反应的方向性和速率,对于研究化学平衡和热力学过程都有着重要的意义。
在标准状态下,摩尔反应熵的计算可以通过以下公式得到:ΔS° = ∑S°(产品) ∑S°(反应物)。
其中,ΔS°代表标准摩尔反应熵的变化,S°(产品)代表生成物的标准摩尔熵,S°(反应物)代表反应物的标准摩尔熵。
根据这个公式,我们可以通过生成物和反应物的标准摩尔熵来计算反应的熵变。
对于气体的标准摩尔反应熵,我们可以利用摩尔反应熵的性质来简化计算。
根据熵的性质,气体的标准摩尔反应熵与气体的摩尔数成正比,这意味着气体的标准摩尔反应熵与气体的摩尔数成正比。
这一性质在研究气体反应的熵变时非常有用,可以帮助我们快速计算反应的熵变。
另外,在化学反应中,摩尔反应熵的正负值也与反应的方向性有着密切的关系。
当ΔS°为正值时,表示反应的混乱程度增加,反应是自发进行的;而当ΔS°为负值时,表示反应的混乱程度减少,反应是不自发进行的。
这一性质可以帮助我们预测反应的方向性,对于化学平衡和反应速率的研究有着重要的意义。
总之,标准摩尔反应熵是化学反应中一个重要的物理量,它描述了反应中物质的混乱程度或者无序程度。
通过计算反应的熵变,我们可以帮助我们理解反应的方向性和速率,对于研究化学平衡和热力学过程都有着重要的意义。
同时,摩尔反应熵的正负值也与反应的方向性有着密切的关系,可以帮助我们预测反应的方向性。
因此,深入理解和熟练运用摩尔反应熵的概念和计算方法,对于化学研究和工程应用都有着重要的意义。
标准摩尔反应熵

标准摩尔反应熵摩尔反应熵是指在一定条件下,摩尔反应的熵变。
在化学反应中,熵变是评价反应过程中混乱程度变化的指标,而摩尔反应熵则是指单位摩尔物质参与反应时的熵变。
了解摩尔反应熵对于研究化学反应过程和理解热力学性质具有重要的意义。
在标准状态下,摩尔反应熵可以通过热力学数据来计算。
标准状态是指气体在1个大气压下,液体和固体在1摄氏度下的状态。
在标准状态下,摩尔反应熵的计算可以通过反应物和生成物的标准摩尔熵之差来得到。
对于化学反应aA + bB → cC + dD,反应的摩尔反应熵ΔrS°可以用以下公式来计算:ΔrS° = ΣnS°(C) ΣmS°(A) 。
其中,n和m分别为生成物和反应物的摩尔数,S°(C)和S°(A)分别为生成物和反应物的标准摩尔熵。
标准摩尔熵是指在标准状态下,1摩尔物质的熵。
通过实验测定,我们可以得到不同物质在标准状态下的标准摩尔熵值。
标准摩尔熵的单位是焦耳每摩尔每开尔文(J/(mol·K))。
对于理想气体来说,其标准摩尔熵与温度无关,而对于液体和固体来说,其标准摩尔熵则会随着温度的变化而变化。
这是因为理想气体的熵仅与分子的自由度有关,而液体和固体的熵还受到分子间相互作用力的影响。
在计算摩尔反应熵时,我们需要注意反应物和生成物的状态。
对于气体、液体和固体来说,它们的标准摩尔熵值是已知的,而对于溶液来说,其标准摩尔熵值则需要通过其他方法来计算。
摩尔反应熵的正负值可以反映出反应过程中混乱程度的变化。
当ΔrS°> 0时,反应过程中混乱程度增加,系统的熵增加,反应是自发进行的;当ΔrS° < 0时,反应过程中混乱程度减少,系统的熵减少,反应是不自发进行的。
摩尔反应熵的计算可以帮助我们预测化学反应的进行方向,了解反应过程中的熵变情况,为研究热力学性质提供重要的参考。
通过对摩尔反应熵的深入研究,可以更好地理解化学反应的热力学特性,为化学工程和材料科学领域的研究提供重要的理论支持。
标准摩尔反应熵
标准摩尔反应熵在化学领域,摩尔反应熵是描述化学反应熵变化的重要参数之一。
它可以帮助我们理解化学反应中物质的混乱程度以及反应的进行方向。
标准摩尔反应熵是指在标准状态下,每一种反应物和生成物的摩尔反应熵之差。
下面我们将详细介绍标准摩尔反应熵的计算方法和应用。
首先,我们来看一下标准状态的定义。
在化学领域,标准状态通常指的是气体在1大气压下,液体和固体在1摄氏度下的状态。
在标准状态下,物质的摩尔反应熵可以通过实验数据或者热力学计算得到。
对于化学反应aA + bB → cC + dD,其标准摩尔反应熵ΔrS°的计算公式为:ΔrS° = ΣnS°(C) ΣnS°(A) ΣnS°(B)。
其中,ΔrS°表示反应的标准摩尔反应熵,ΣnS°(C)表示生成物的标准摩尔反应熵之和,ΣnS°(A)和ΣnS°(B)分别表示反应物的标准摩尔反应熵之和。
在实际应用中,我们可以通过查表或者计算得到各种物质在标准状态下的摩尔反应熵,然后代入上述公式进行计算。
通过计算得到的标准摩尔反应熵可以帮助我们判断化学反应的进行方向,以及预测反应的熵变情况。
另外,标准摩尔反应熵还可以用来计算化学反应的标准生成焓ΔrH°。
根据热力学第二定律,化学反应的标准生成焓ΔrH°与标准摩尔反应熵ΔrS°之间存在以下关系:ΔrG° = ΔrH° TΔrS°。
其中,ΔrG°表示反应的标准生成自由能,T表示温度。
通过这个关系式,我们可以利用标准摩尔反应熵来计算化学反应的标准生成焓,进一步了解反应的热力学性质。
总之,标准摩尔反应熵是化学反应熵变化的重要参数,它可以帮助我们理解化学反应的进行方向,预测反应的熵变情况,以及计算化学反应的标准生成焓。
通过对标准摩尔反应熵的研究和应用,我们可以更深入地理解化学反应的热力学性质,为化学反应的控制和应用提供理论基础。
标准摩尔反应熵
标准摩尔反应熵摩尔反应熵是热力学中一个重要的概念,它描述了化学反应中物质的混乱程度和无序度的变化。
在标准条件下,摩尔反应熵可以通过摩尔反应熵变的计算来确定。
摩尔反应熵变是一个与化学反应有关的物理量,它能够帮助我们理解化学反应中的熵变过程。
在本文中,我们将深入探讨标准摩尔反应熵的相关概念和计算方法。
首先,我们需要了解什么是标准摩尔反应熵。
标准摩尔反应熵是指在标准状况下,化学反应中物质的摩尔反应熵变。
标准状况是指温度为298K(25摄氏度),压强为1个大气压。
在这种条件下,我们可以通过化学反应中物质的摩尔反应熵变来计算标准摩尔反应熵。
摩尔反应熵变的计算方法如下,ΔS° = ΣnS°(products) ΣmS°(reactants),其中ΔS°表示标准摩尔反应熵变,ΣnS°(products)表示生成物的摩尔反应熵,ΣmS°(reactants)表示反应物的摩尔反应熵。
通过这个公式,我们可以计算出化学反应中物质的摩尔反应熵变,进而得到标准摩尔反应熵。
标准摩尔反应熵对于化学反应的研究具有重要意义。
它可以帮助我们了解化学反应中物质的混乱程度和无序度的变化,从而揭示了化学反应的熵变过程。
通过对标准摩尔反应熵的计算和分析,我们可以更深入地理解化学反应的热力学性质,为化学反应的研究和应用提供重要参考。
除了计算标准摩尔反应熵,我们还可以通过摩尔反应熵的变化来预测化学反应的方向。
根据熵变的正负可以判断反应是否趋向于更加混乱或有序。
当ΔS° > 0时,反应趋向于更加混乱;当ΔS° < 0时,反应趋向于更加有序。
这对于化学反应的研究和应用具有重要的指导意义。
总之,标准摩尔反应熵是化学热力学中一个重要的概念,它描述了化学反应中物质的混乱程度和无序度的变化。
通过对标准摩尔反应熵的计算和分析,我们可以更深入地理解化学反应的热力学性质,为化学反应的研究和应用提供重要参考。
标准摩尔反应熵
标准摩尔反应熵摩尔反应熵是化学反应中一个非常重要的概念,它描述了反应在熵变化方面的特性。
在热力学中,熵是一个描述系统无序程度的物理量,而摩尔反应熵则是指单位摩尔物质参与反应时,系统熵的变化量。
在化学反应中,摩尔反应熵可以帮助我们了解反应的趋势和特性,对于研究反应的热力学过程和进行工程设计都具有重要意义。
首先,我们来看一下摩尔反应熵的计算方法。
对于一个化学反应aA + bB → cC + dD,其摩尔反应熵的计算公式为ΔrS° =ΣνS°(products) ΣνS°(reactants),其中νS°表示物质的摩尔反应熵,products和reactants分别表示生成物和反应物。
根据这个公式,我们可以通过已知物质的摩尔反应熵,计算出整个化学反应的摩尔反应熵。
摩尔反应熵的正负值代表了反应过程中熵的增加或减少。
当ΔrS° > 0时,表示反应过程中系统的无序程度增加,也就是熵增;而当ΔrS° < 0时,表示反应过程中系统的无序程度减少,也就是熵减。
这些信息可以帮助我们预测反应的进行方向和速率。
另外,摩尔反应熵还可以用来判断反应的自由能变化。
根据热力学第二定律,一个系统在恒温恒压下,其自由能变化ΔG与摩尔反应熵ΔrS°之间存在着如下的关系,ΔG = ΔH TΔS,其中ΔH 表示反应的焓变,T表示温度。
当ΔG < 0时,表示反应是自发进行的;而当ΔG > 0时,表示反应是不自发进行的。
因此,通过摩尔反应熵的计算,我们可以判断反应是否会自发进行。
此外,摩尔反应熵还可以用来比较不同反应的趋势。
通过比较不同反应的摩尔反应熵,我们可以了解反应的无序程度变化情况,从而判断反应的相对趋势。
这对于选择合适的反应条件和优化反应过程具有指导意义。
总之,摩尔反应熵是化学反应中一个重要的热力学参数,它可以帮助我们了解反应的熵变化特性、预测反应的进行方向和速率、判断反应的自由能变化,以及比较不同反应的趋势。
c2h6标准摩尔生成熵
c2h6标准摩尔生成熵熵是热力学中一个重要的概念,用于描述系统的无序程度。
而在化学反应中,生成熵则是指在标准状态下,一摩尔物质从其组成元素的标准状态生成的过程中所产生的熵变。
本文将以乙烷(C2H6)的标准摩尔生成熵为例,探讨其背后的原理和计算方法。
乙烷是一种常见的烷烃,由两个碳原子和六个氢原子组成。
在标准状态下,乙烷的生成熵可以通过以下步骤进行计算:首先,我们需要知道乙烷的标准生成焓(ΔH°f)。
标准生成焓是指在标准状态下,一摩尔物质从其组成元素的标准状态生成的过程中所产生的焓变。
对于乙烷而言,其标准生成焓为-84.7 kJ/mol。
其次,我们需要知道乙烷的标准生成熵(ΔS°f)。
标准生成熵是指在标准状态下,一摩尔物质从其组成元素的标准状态生成的过程中所产生的熵变。
对于乙烷而言,其标准生成熵为229.5 J/(mol·K)。
最后,我们可以使用以下公式计算乙烷的标准摩尔生成熵(ΔG°f):ΔG°f = ΔH°f - TΔS°f其中,ΔG°f表示乙烷的标准摩尔生成熵,ΔH°f表示乙烷的标准生成焓,ΔS°f表示乙烷的标准生成熵,T表示温度(单位为开尔文)。
通过以上计算,我们可以得到乙烷的标准摩尔生成熵。
这个值可以用来评估乙烷在标准状态下生成的随机性和无序程度。
较高的生成熵值意味着反应过程中产生了更多的无序,而较低的生成熵值则表示反应过程中产生了较少的无序。
乙烷的标准摩尔生成熵的计算方法可以应用于其他化学物质的熵计算。
通过熵的计算,我们可以更好地理解化学反应中的热力学性质,为化学工程和材料科学等领域的研究提供理论基础。
总之,乙烷的标准摩尔生成熵是描述乙烷在标准状态下生成过程中无序程度的一个重要参数。
通过计算乙烷的标准生成焓和标准生成熵,我们可以得到乙烷的标准摩尔生成熵,并进一步了解化学反应中的热力学性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Θ 常见错误: 将标准熵写成 S m 00-7-30
×
铂的Cp,m/T~T 曲线
4
如对反应
0 = aA bB + yY+zZ
Θ Θ Θ Θ Θ r Sm = ySm ( Y ) + zSm ( Z ) aSm ( A ) bSm ( B )
由于绝大部分化学反应无法做到可逆地进行, 所以用可 逆热温商来计算化学反应的熵变缺乏可行性. 基于热力学第三定律, 人们能够赋予物质的标准摩尔熵 动画“化学变化的ห้องสมุดไป่ตู้逆性” 一个规定值, 从而按照上述定义式就能计算标准摩尔反应熵.
15K aT 3
Ttrs
其中升温步骤的S 可由实测的 Cp,m/T~T 曲线用图解积分法获得.
0K附近的Cp, m可用德拜公式计算: C p ,m ≈ CV ,m = aT 3 (非金属 )
C p ,m ≈ CV ,m = aT 3 + bT ( 金属 )
Θ S m ( B,298.15K )通常可以查到 .
∑
00-7-30
3
标准摩尔熵规定值的获得
以0K时完美晶体的熵为零作为起点, 计算出1mol纯物质B 在温度为T 的标准态时的熵. 如对某气态物质,
Θ Θ C Θ,m (crΙ ) Tf C p,m (crII) trs H m p Θ dT + ∫ dT + +∫ dT Sm (g, T ) = ∫ 0 15K trs T T Ttrs T Θ Θ Θ Θ vap H m Tb C p,m (l ) T C p,m (g ) H + fus m + ∫ dT + +∫ dT Tf Tb Tf T Tb T
00-7-30 1
能斯特热定理
能斯特热定理: 凝聚系统在恒温化学变化过程中的熵变随着 绝对温度趋于0K而趋于零.(1906年)
T → 0K
lim r S (T ) = 0 或
r S ( 0K ) = 0
那么在任一温度T 下反应 0 = ΣB νBB 的标准摩尔反应熵:
Θ Θ Θ r S m (T ) = r S m (T ) r S m ( 0K )
标准摩尔熵和标准摩尔反应熵
Θ 物质的标准摩尔熵 Sm (B) : 处于标准态的物质B 的摩尔熵, 与物质本性和温度有关. 是物质的重要特性.
Θ 标准摩尔反应熵 r Sm : 在一定温度T 下, 反应物和生成 物都处于标准态时, 单位反应进度的反应引起的熵变.
Θ r Sm
def
Θ ν B Sm (B ) ∑B
= =
Θ Θ ν B S m ( B, T ) ∑ B ν B S m ( B, 0K ) ∑B Θ Θ ν B S m ( B, T ) S m ( B, 0K ) ∑B
[
]
Walter Nernst (1864—1941) Walter Nernst (1864—1941) 上式方括号内是 1mol物质Bphysicist and aaGerman physicist and German 从 0K升温至T 的熵变, 其间可能 chemist known especially for 包括一系列恒压升温和可逆相变, 对于纯物质B, 这两种过程 chemist known especially for his work related to the third his work related to the third 的熵变可以分别根据定压热容和相变焓等热数据求出, 从而计 law of thermodynamics. law of thermodynamics. 算出任一温度下的标准摩尔反应熵.
00-7-30 2
热力学第三定律
Θ 式 r S m (T ) =
Θ Θ ν B S m ( B, T ) S m ( B, 0 K ) 可进一步简化 . ∑B
[
]
水的3种相态中, 水的3种相态中, 普朗克假设:凝聚态纯物质在0K时的熵值为零. (1912年) 熵的相对大小是 熵的相对大小是 S ( 0K ) = 0 与其分子无序程 与其分子无序程 度的高低一致的, 度的高低一致的, 热力学第三定律: 0K时纯物质完美晶体的熵为零. 其中固体的熵和 其中固体的熵和 无序度最小.随着 S ( 0K, 完美晶体无序度最小.随着 )=0 固体温度的一步 固体温度的一步 步降低至绝对零 0K时完美晶体中所有分子, 步降低至绝对零 度, 可以预期在 原子或电子的运动都处于最低能 度, 可以预期在 Max Larl Ernst Ludwig 温度尺度上熵将 Max Larl Ernst LudwigPlank (1858—1947). Plank (1858—1947). 级, 空间排列只有一种方式, 所以 温度尺度上熵将 The deep interest in thermodynamics led him 降低至最小值. The deep interest in thermodynamics led him 从微观上看只在一种状态, 熵值 降低至最小值. and to eventually to the “ultraviolet catastrophe” and to eventually to the “ultraviolet catastrophe” 定为零, 可算是“有序之极”了. his revolutionary hypothesis. The discovery was his revolutionary hypothesis. The 晶体的两种点缺陷 discovery was Θ Θ 得到 r Sannounced two Bweeksbefore Christmas in 1900, m (T ) = announced Bν weeksB, T ) Christmas in 1900, two S m ( before and he was awarded the Nobel Prize in 1918. 该式中的标准摩尔熵已演变为以 0K为基准的相对值. and he was awarded the Nobel Prize in 1918.
