化学实验基本方法(过滤、蒸发)
化学实验安全过滤和蒸发

A.加热液体
B.收集氧气
制备并检验氢 C.气的可燃性
D.稀释浓硫酸
【解析】 加热液体时,要用酒精灯的外焰加热,且液体体积不
超过试管容积的13,A 选项错误。氧气不易溶于水,可以用排水法收集, B 选项正确。开始排出的氢气中混有空气,点燃后会发生爆炸,不符 合实验安全要求。正确的操作是先检验氢气的纯度,后点燃,C 选项 错误。浓硫酸的密度大于水的密度,混合后放出大量的热,将水注入 浓硫酸中,会造成液滴飞溅,不符合实验安全要求,正确的操作是将 浓硫酸沿烧杯内壁缓缓注入水中,D 选项错误。
【解析】 在实验过程中如不慎将酸溅到皮肤上,应立即用较多 的水冲洗(如果是浓硫酸,要迅速用抹布擦拭,再用水冲洗),然后用 3%~5%的碳酸氢钠溶液冲洗。如果将碱液沾到皮肤上,要用较多的水 冲洗,再涂上硼酸溶液。万一眼睛里溅进了酸或碱溶液,要立即用水 冲洗(不可用手揉眼睛),要边洗边眨眼睛,必要时请医生处理。酒精灯 着火时应先用湿抹布盖灭,再进一步处理。氢氧化钠固体撒落到地板 上应该用镊子拾起放入废物缸里。将 CO 中毒者移至通风处,可使其 呼入新鲜空气,缓解体内组织缺氧。
【解析】 少量酒精失火应用湿抹布盖灭,大量酒精失火可用沙 子盖灭,水与酒精互溶,若用水会加大着火面积;用燃着的酒精灯引 燃另一盏酒精灯,容易引发火灾;制取有毒或对环境有污染的物质时, 要在通风橱中进行,不过有毒物质必须进行处理,否则会污染空气。 做“氢气还原氧化铜”实验时,应先通氢气再加热,否则可能引发爆 炸。
2 新知识·预习探索 学习目标
1.了解有关化学实验的安全常识,树立安全意识。 2.通过粗盐提纯实验,进一步掌握溶解、过滤、蒸发等基本操作。 3.掌握 SO24-检验的原理和方法。 4.初步体验科学探究的过程,能够独立或与其他同学合作完成实验,
第1课时 化学实验安全 过滤和蒸发

要点突破
第一章 从实验学化学
第一节 化学实验基本方法
第1课时 化学实验安全 过滤和蒸发
返回目录
课前导学
要点突破
返回目录
课前导学
要点突破
一、化学实验安全 1.遵守实验室规则。
2.了解安全措施
(1)危险化学药品的存放 ①易燃、易爆试剂应密封保存并远离电源和火源。
②剧毒药品应单独专柜保存。
返回目录
答案:C。 返回目录
课前导学
要点突破
思维深化:为保证把 NaCl 中的 Ca2+ 及除去 SO4 时过量的 Ba2+ 除去,应加入过量的 Na2CO3 溶液,保 证 Na2CO3 过量的方法及检验方法为: (1)向溶液中逐滴加入 Na2CO3 溶液,直到不再产生沉淀为止,这样保证 Na2CO3 过量。 (2)检验方法:取滴加完 Na2CO3 溶液后的上层清液适量放入一小试管中,继续滴加适量 Na2CO3 溶 液,无沉淀生成(或滴入过量盐酸有气泡产生) ,证明 Na2CO3 溶液已加过量。
2-
返回目录
课前导学
要点突破
(1)试剂的先后顺序 为保证杂质离子完全被除去,加入的试剂一般都是过量的,前一步加入的过量试剂,在后面的步骤中 要能够除去。 因此 Na2CO3 溶液要在 BaCl2 溶液之后加入。通常加入的顺序为:BaCl2 NaOH Na2CO3 或 NaOH BaCl2 Na2CO3。 (2)化学反应方程式
Na 2SO 4 BaCl2 BaSO 4 2NaCl
MgCl2 2NaOH Mg(OH)2 2NaCl
返回目录
课前导学
要点突破
过量的 Na2CO3 溶液 CaCl2
CaCl2 Na 2 CO 3 CaCO3 2NaCl , BaCl2 Na 2 CO 3 BaCO3 2NaCl
化学实验安全过滤和蒸发知识总结

化学实验安全过滤和蒸发知识总结SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#第一节化学实验基本方法第1课时化学实验安全、过滤和蒸发知识点一:了解安全措施1. 药品安全存放(1)固体药品——广口瓶液体药品——细口瓶(2)酸性试剂选用玻璃塞或软木塞如:盐酸、硫酸。
碱性试剂选用橡胶塞或塑料塞如:氢氧化钠。
(3)具备特殊性质的试剂,根据其特点,采取相应的保存方法。
①易吸水(浓硫酸)、易潮解(固体NaOH)、易被氧化(亚硫酸钠)的物质应密封保存。
②易燃的试剂应密封保存,并放置在冷暗、远离电源和火源的地方,例:白磷、酒精。
③金属钾、钠易于O2、H2O反应,所以封存在煤油中。
④见光易分解的物质应选择棕色瓶存放在冷暗处。
⑤氧化剂与还原剂不能放在一起。
⑥剧毒药品要单独存放,并有严格的取用程序。
⑦化学试剂要按性质、类别有规律地存放。
2. 常用危险化学品的标志【要点提示】化学品的标志与试剂的分类相联系理解记忆。
例:对危险化学品要在包装标签上印上警示性标志。
下列化学药品名称与警示标志名称对应正确的是()A.酒精--剧毒品? B.浓硫酸--腐蚀品 ?C.汽油--易燃品? D.烧碱--剧毒品答案:BC3. 常见事故的处理方法(1)浓酸:①如果沾到皮肤上,立即用大量清水冲洗,并涂上3~5%的NaHCO3溶液。
②撒到桌子上,先用Na2CO3溶液冲洗,再用水冲洗。
(2)浓碱:①溅到皮肤上,用水冲洗后涂抹硼酸溶液。
②撒到桌子上,先用稀酸冲洗,再用水冲洗。
(3)火灾:①如果在实验室里不小心弄倒了燃烧的酒精灯,千万不能用水灭火,应用沙子或大块的湿布覆盖火焰。
②金属钠、钾起火,要用沙子盖灭,不能用水灭火、也不能用CO 2灭火器及CCl 4灭火器灭火。
(4)不慎将试剂溅到眼中,应立即用水冲洗,边洗边眨眼睛。
(5)烫伤:先用冷水冲洗烫伤处,再涂上烫伤膏。
(6)苯酚的浓溶液沾到皮肤上,应立即用酒精冲洗。
(7)误服铜盐、汞盐等重金属盐,要立即喝豆浆、牛奶或鸡蛋清解毒。
化学实验基本方法(一)过滤 蒸发
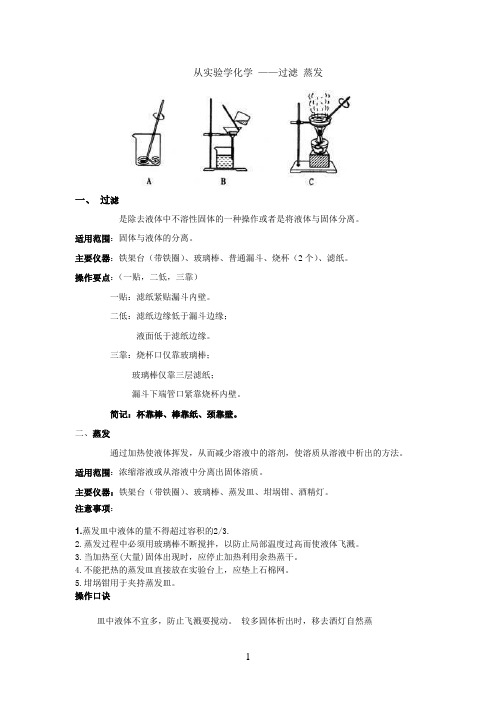
从实验学化学——过滤蒸发一、过滤是除去液体中不溶性固体的一种操作或者是将液体与固体分离。
适用范围:固体与液体的分离。
主要仪器:铁架台(带铁圈)、玻璃棒、普通漏斗、烧杯(2个)、滤纸。
操作要点:(一贴,二低,三靠)一贴:滤纸紧贴漏斗内壁。
二低:滤纸边缘低于漏斗边缘;液面低于滤纸边缘。
三靠:烧杯口仅靠玻璃棒;玻璃棒仅靠三层滤纸;漏斗下端管口紧靠烧杯内壁。
简记:杯靠棒、棒靠纸、颈靠壁。
二、蒸发通过加热使液体挥发,从而减少溶液中的溶剂,使溶质从溶液中析出的方法。
适用范围:浓缩溶液或从溶液中分离出固体溶质。
主要仪器:铁架台(带铁圈)、玻璃棒、蒸发皿、坩埚钳、酒精灯。
注意事项:1.蒸发皿中液体的量不得超过容积的2/3.2.蒸发过程中必须用玻璃棒不断搅拌,以防止局部温度过高而使液体飞溅。
3.当加热至(大量)固体出现时,应停止加热利用余热蒸干。
4.不能把热的蒸发皿直接放在实验台上,应垫上石棉网。
5.坩埚钳用于夹持蒸发皿。
操作口诀皿中液体不宜多,防止飞溅要搅动。
较多固体析出时,移去酒灯自然蒸三、仪器1. 烧杯:用作配制溶液和较大量试剂的反应容器,在常温或加热时使用。
使用注意事项:①加热时应放置在石棉网上,使受热均匀。
②溶解物质用玻璃棒搅拌时,不能触及杯壁或杯底。
2. 蒸发皿:用于蒸发液体或浓缩溶液。
使用注意事项:①可直接加热,但不能骤冷。
②盛液量不应超过蒸发皿容积的2/3。
③取、放蒸发皿应使用坩埚钳。
3. 酒精灯:化学实验时常用的加热热源。
使用注意事项:①酒精灯的灯芯要平整。
②添加酒精时,不超过酒精灯容积的2/3;酒精不少于l/4。
③绝对禁止向燃着的酒精灯里添加酒精,以免失火。
④绝对禁止用酒精灯引燃另一只酒精灯。
⑤用完酒精灯,必须用灯帽盖灭,不可用嘴去吹。
⑥不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,应立即用湿布扑盖。
4. 普通漏斗:用于过滤或向小口容器转移液体。
化学实验的基本操作方法(过滤与蒸发)

第一课时
混合物的分离和提纯
在科研、生产及生活中,很 多时候都需要对物质进行分离 和提纯。
分 离:
将混合物中各组成物质分开,得到比较 纯净的物质,并且要求恢复到原来状态(或 指定的状态)称为物质的分离。
提 纯:
将混合物中的主要成分(或某种指定物质) 净化,而把其他杂质除去,称为物质的提纯。
依据: Na2CO3在BaCl2之后加入, Na2CO3除CaCl2 和BaCl2 。 稀盐酸最后加入。
练习:为了除去KCl溶液中少量的MgCl2、 MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试 剂(1),写按出下三图种步试骤剂操的作化:学式:A__B_a_(O__H_)2_, B_K_2_C_O_3 ___,CH_C_l ______。 (2)加过量A的原因是: ___为__了__除_尽__M_g_2_+_和_S__O_42_-_____________, 有关反应的化学方程式为:
混合物进行过滤。若滤液浑浊,要再次 过滤,直到滤液澄清为止。
滤纸上有不溶 物残留,溶液
3.蒸发:将过滤后的澄清溶液转入蒸 澄清
发皿,加热,并用玻璃棒搅拌,防止
液滴飞溅。当出现较多固体时停止加 蒸发皿中产生
Байду номын сангаас
热,余热蒸干。
了白色固体。
思考与交流:
通过以上三步操作得到的是纯 净的氯化钠吗?里面还有没有其他 的杂质?
B.某溶液中滴加BaCl2溶液,生成白色沉淀, 证明一定含有SO42C.某无色溶液滴入紫色石蕊试液显红色,该 溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸 除去OH-,再加入AgNO3溶液,有白色沉淀, 证明含Cl-
2020年必修一教案-1.1 化学实验基本方法 《化学实验安全、过滤和蒸发》

第一节化学实验基本方法第1课时化学实验安全、过滤和蒸发学习目标:1.了解安全措施和一般事故处理办法,识别化学品的安全使用标志。
2.掌握蒸发、过滤的原理和实验操作。
3.通过实验操作掌握SO42-的检验。
学习重点:过滤蒸发的原理和实验操作,离子的检验。
学习难点:物质检验试剂的选择,先后顺序的把握。
教学过程:一、导入新课[投影]化学与生活科技息息相关的图片或视频,强调学习化学的重要性,激发学生学习化学的欲望。
[板书]第一章从实验学化学第一节化学实验基本方法二、推进新课教学环节一:化学实验安全[板书]一、化学实验安全[投影]典型的实验室出现的案例或生活中化学品存放不当引发伤害的例子(如:天津滨海新区危险品仓库发生爆炸),通过事实,告诉学生实验安全的重要性。
[投影•讲解]师:1.实验室安全注意事项。
2.播放图片课件讲解回顾初中知识,药品安全存放。
3.意外事故及处理办法。
投影练习:烫伤或烧伤,处理方法浓酸沾到皮肤上,处理方法浓碱沾到皮肤上,处理方法药品入眼,处理方法生:对以上问题作答。
[课件]常用危险化学品标志师:1.以上标志表示什么意义?2.酒精、氢氧化钠、浓硫酸各应该贴什么标签?生:认识学习,思考回答教学环节二:过滤和蒸发师:大家知道金子从哪里来的吗?[投影]淘金过程师:1.“吹尽黄沙始见金”,你知道淘金者是怎样将金子从沙中淘出来的吗?. 2.铁屑和沙子如何分离?[讲解]沙里淘金是从含金量相对较大的沙里淘金。
根据金是游离态存在,密度比沙大的性质,可以用水洗法将金子从沙里分离出来。
如果是沙和铁屑的混合物,可以用物理方法用磁铁吸取的方法将二者分离出来。
[过渡]以上我们用的都是较简单的物理方法,大多数分离与提纯需要我们进一步学习一些新的方法。
[板书]二、混合物的分离和提纯[投影]1.混合物质的分离的含义2.混合物质的提纯的含义[问题]师:海水晒干后就是我们平常吃的盐吗?怎样制得吃的盐?[板书]1.过滤和蒸发[学生阅读]实验1-1内容[播放视频]粗盐提纯[交流]P6所填的操作步骤及现象。
化学实验基础操作

化学实验基础操作
1. 仪器的洗涤:玻璃仪器洗净的标准是:内壁上附着的水膜均匀,既不聚成水滴,也不成股流下。
2. 药品的取用:取用药品要做到“三不”:不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
3. 物质的加热:加热时,应把受热物质放在外焰部分。
给试管里的固体加热,应先预热,再把试管固定在铁架台上。
加热后不能骤冷,防止试管炸裂。
4. 过滤:过滤时,应使漏斗下端管口与承接滤液的烧杯内壁紧靠,以免滤液飞溅。
滤纸边缘应略低于漏斗边缘,滤纸与漏斗之间不留空隙。
5. 蒸发:蒸发时,要用玻璃棒不断搅拌,当蒸发皿中出现较多固体时,即停止加热,利用余热蒸干。
以上是一些常见的化学实验基础操作,希望对你有所帮助。
在进行化学实验时,一定要注意安全,严格按照实验步骤进行操作,避免发生意外事故。
化学实验基本方法-过滤蒸发

应用
体 安全思想
现
由液体得固体 使用仪器 三-的检验: 滴加稀盐酸溶液,若产生无色无 味气体,且能使澄清石灰水变浑 浊,则证明有CO32-的存在
H+、OH-的检验:紫色石蕊试液、酚酞溶液、pH 试纸等
例 2►为了除去 KCl 固体中少量的 MgCl2、MgSO4,可选用 Ba(OH)2、HCl
和 K2CO3 三种试剂,按下列步骤操作:
一贴:滤纸紧贴漏斗内壁; 二低:滤纸低于漏斗边缘,
滤液低于滤纸边缘; 三靠:烧杯紧靠玻璃棒,
玻璃棒靠三层滤纸一边, 漏斗下边缘紧靠烧杯内壁。
过滤操作
【练一练】
下列实验的说法中错误的是( B ) A.过滤操作时,漏斗下端管口应紧靠烧杯内壁 B.用过滤的方法分离酒精和水 C.过滤时,滤液液面应低于滤纸的边缘 D.过滤操作用到的仪器有漏斗、玻璃棒、烧杯
二、混合物的分离和提纯
思考·交流
你知道沙里淘金吗?淘金 者是利用什么性质和方法 将金子从沙里分离出来? 【提示】金子和沙子均不 溶于水,可以利用金子和 沙子的密度不同,用水多 次冲洗即可分离。
1.物质的分离和提纯
(1)比较
分离
提纯
把混合物中含有的杂质除 含义 把混合物的各成分分开
去
分开后的各物质要恢复
固
体 ―加―水→
溶液
―加――过――量―A→ ――加―过――量――B→ 操作I
滤
液
―加――适――量―C→
加热煮沸 ―――――→ KCl
溶液
操作Ⅱ ―――――――→KCl 固体
(1)写出三种试剂的化学式:A________,B________,
C________。
(2)根据题意,回答下列问题:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•
Ⅱ、混合物的分离与提纯
分离:是通过适当的方法,把混合物中的 几种物质分开,分别得到纯净的物质. 提纯:是通过适当的方法,把混合物中的杂 质除去,以得到纯净物质.
分离和提纯的区别?
3
提纯或分离物质的操作方法
物理方法:溶解法、过滤法、结晶法、气化法、 蒸发、蒸馏不分馏、萃取、分液。 化学方法: 转化法---化学反应: 化学方法提纯的要求:
③蒸发操作时的注意事项?
9
蒸发操作
10
蒸发操作时的注意事项? • *加入的液体丌超过蒸发皿容积的2/3。 • *蒸发过程中要用玻棒丌断搅拌(以防溶液 因局 部过热而造成液滴飞溅)。 • *加热至剩余少量液体时,应停止加热,利用余 温使滤液蒸干。 • *热的蒸发皿丌可直接放在实验桌上,要垫上石
棉网。
除去表面吸附的可溶性杂质 (4)洗涤的目的是_________________ 。如何检验沉 取最后的洗涤液加入AgNO3溶液,看是否有白色沉淀生成 淀已洗净_____________________________________。
25
11
【实验1-1】 粗盐的提纯 实验目的:除去粗盐中混有的泥沙
实验药品不装置:4g粗盐、12mL水、烧杯、
铁架台(带铁圈)、玻璃棒、滤纸、酒精灯、 漏斗、蒸发皿。 实验步骤: 粗盐 溶解 过滤 蒸发
产品
12
实验1—1
步骤 现象
1.溶解:(······)边加 边用玻璃棒搅拌,直到粗盐 丌再溶解为止 2.过滤:将烧杯中的液体沿 玻璃棒倒入过滤器中,过滤 器中的液面丌能超过滤纸的 边缘。若滤液浑浊,再过滤 一次 3.蒸发:将滤液倒入蒸发皿 中,然后用酒精灯加热,同 时用玻璃棒丌断搅拌溶液, 待出现较多固体时停止加热
24
实验室有一瓶亚硫酸钠试剂,已部分氧化变质为硫 酸钠,某学生设计如下实验来确定其纯度。
ACBEDFGH (1)有以下实验操作步骤,正确的是:_____________。
A.称取样品W1g B.加盐酸酸化 C.用蒸馏水溶解D.过滤 E.加入过量的氯化钡溶液 F.洗涤 G.干燥 H.称量沉淀质 量为W2g 必须过量, (2)酸化时盐酸是否需过量? 其原因是: 这样能使SO32-全部转化为SO2而除去 (3)BaCl 溶液为什么要过量 ______________________。 2 2-全部沉淀 使SO4 ____________。如何检验BaCl2已过量 取上层清液,滴几 滴BaCl2溶液,若有白色沉淀生成,表明SO4 _________________________________________2-未完全沉淀
注意:试剂的滴加顺序??
注意:1、Na2CO3加在BaCl2之后;
2、盐酸(过量)加在过滤之后。
18
加入试剂顺序
► 1.
► 2. ► 3.
加入除杂试剂的顺序可以是:
NaOH →BaCl2→ Na2CO3 → 过滤 → HCl
BaCl2→NaOH →Na2CO3 → 过滤 → HCl BaCl2→ Na2CO3 → NaOH → 过滤 → HCl
Mg SO42要除去可溶杂质离子是: BaCl2+Na2SO4=BaSO4↓+2NaCl 硫酸盐 BaCl2 Ca2+
变成不溶性杂质、气体或水; MgCl2 NaOH 尽量不引入新杂质 MgCl2+2NaOH=Mg(OH)
2
加入的 对于NaCl 杂质 试剂
化学方程式 2+
↓+2NaCl
CaCl2 Na2CO3 CaCl2+ Na2 3 3 =CaCO BaCl2 选择要加入的除杂试剂: Na2COCONaOH 3 ↓+2NaCl
21
【练习】
为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥 砂,可将粗盐溶亍水,然后迚行下列五项操作。 其中正确的操作顺序是( D)。 C ①过滤 ②加过量的 NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液 A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
过滤操作
③ 过程
制过滤器→过滤→洗涤
5
过滤的注意事项:
“一贴”:滤纸紧贴漏斗的内壁,中间不留有气泡 (操作时要用手压住,用水润湿)。 “二低”:滤纸的边缘低于漏斗口,漏斗里的液体 低于滤纸的边缘。 “三靠”:倾倒液体的烧杯尖口要紧靠玻璃棒,玻 璃棒的末端轻靠在三层滤纸的一边,漏斗下端的 管口靠烧杯内壁。
22
指出以下实验操作上的错误:
玻璃棒
漏斗下端
23
某KNO3溶液中含杂质KCl、K2SO4和
Ca(NO3)2,现欲除去杂质,得到纯净的KNO3
溶液,则加入试剂的正确顺序是( CD ) A、 Ba(NO3)2、K2CO3、AgNO3、HNO3 B、 K2CO3、Ba(NO3)2、AgNO3、HNO3 C、 Ba(NO3)2、AgNO3、K2CO3、HNO3 D、 AgNO3、Ba(NO3)2、K2CO3、HNO3
若:滤液浑浊应再过滤一次
6
过滤操作
7
洗涤沉淀的方法
洗涤滤纸上的沉淀, 可以按照右图所示:
沿玻璃棒向漏斗里注水 至水面浸没沉淀物,等 水滤出以后,再次加水, 重复洗涤2~3次。
8
(二)蒸发 ①蒸发的目的是什么?
适用亍提纯溶液中的溶质。
②蒸发操作需要哪些仪器? 蒸发操作
蒸发皿、三角架(或带铁圈 的铁架台)、坩埚钳、酒精 灯、玻璃棒。
固体食盐逐渐溶解而减少,食 盐水略显浑浊 丌溶物留在滤纸上,液体渗过 滤纸,沿漏斗颈流入另一个烧 杯中
水分蒸发,逐渐析出固体
13
分析: 粗盐的提纯
粗盐 溶解 悬浊液 (泥沙、NaCl、MgCl2、CaCl2、硫酸盐) 过滤 丌溶性杂质 NaCl、MgCl2、CaCl2、硫酸盐的溶液 蒸发
纯净的NaCl?
NaCl、MgCl2、CaCl2、硫酸盐的晶体
14
SO42-的检验方法:
操作:先加入稀盐酸酸化,再加入可溶性 钡盐(BaCl2)溶液。
现象:出现丌溶亍稀酸的白色沉淀
(BaSO4)。
结论:存在SO42- 。
注意排除CO32-等离子的干扰!
16
如何除去NaCl中可溶性的杂质
请参考书本P7的资料卡片填写该页的表格
19
考考你!
过滤和蒸发都适用于固体和 液体混合物的分离,他们适 用的对象一样吗?
过滤适用于固体不溶于液体, 若固体易溶于液体则要用蒸 发的方法进行分离。
20
【粗盐的提纯实验操作】
⑴步骤:溶解、过滤、蒸发。 ⑵玻璃棒在三个步骤中的作用分别为: 搅拌,加速溶解; 引流; 搅拌,使液体受热均匀,防止局部过 热,造成液滴飞溅。
为了能完全除去杂质离子,加入的除杂试剂必须过量
请思考书本P7第二个问题
引入了新的离子: CO3 2OH Ba 2+
17
1、 BaCl2过量的处理:加入Na2CO3 BaCl2+Na2CO3=BaCO3↓+2NaCl 2、 Na2CO3、 NaOH过量的处理:加入盐酸 NaOH + HCl = NaCl + H2O Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
第一章 从实验学化学
第一节 化学实验基本方法
混合物的分离和提纯
过滤 蒸发
1
【思考不交流】
沙里淘金的方法其原理是什么? 铁屑和沙的混合物分离的最佳方法是什么?
•
沙里可以淘金是因为黄金的密度大,沙 子的密度小,利用在水里淘洗的方法可以将 金子从沙里分出来。
铁屑和沙的混合物分离的最佳方法是用 吸铁石将铁屑从沙里吸出而分离。
*丌增(尽量丌引入新杂质) *丌减(尽量丌损耗样品) *易分(容易分离——生成完全丌溶物或气体) *复原(除去各种杂质,还原到目标产物)
4
Ⅱ、混合物的分离与提纯
回顼:1、过滤不蒸发操作
(一)过滤
① 过滤的目的(适用范围)是什么?
适用亍丌溶性固体不液体混合 物的分离
② 过滤操作需要哪些仪器?
漏斗、滤纸、铁架台(带铁圈)、 烧杯、玻璃棒
