1.5物质的溶解度
1.5物质的溶解(4课时)—浙教版八年级科学上册课件+素材

难溶 微溶 可溶
0.01
1
10
易溶
➢ 烧开水时,随着温度的升高,沸腾前会出现气泡, 这是为什么?
烧开水时,随着温度的升高,原来溶 解在水中的气体物质不能继续溶解而 形成气泡逸出。 气体的溶解度随温度的升高而减小。
➢ 打开可口可乐瓶盖时会看到有气体冒出, 这又是为什么?
瓶盖打开后,瓶内气压减小,原来溶 解在水中的气体物质不能继续溶解而 形成气泡逸出。 气体的溶解度随压强的降低而减小。
1、因为在一定温度下的某种溶剂中,溶质已不能再 溶解了,但对它加热后,溶质还能继续溶解。
2、在一定量的溶剂里,已经饱和的溶液,若再加入 水(溶剂),溶质还能继续溶解。
3、在一定量的溶剂里,在一定里的温度下,已不再 溶解某种溶质,但它还能溶解其他的溶质。
【练一练】
1. 判断下列说法:
① 同一种物质的饱和溶液一定比不饱和溶液浓。
硝酸钾 3g
水5mL 室温 硝酸钾没有完全溶解
硝酸钾 3g
水5mL 加热
硝酸钾完全溶解
溶解性与温度有关
注意:
⑴多数固体物质的溶解性随着温度的升高而增强,如硝酸钾; ⑵极少数固体物质的溶解性随着温度的升高而减弱,如熟石灰;
➢ 溶解性=增加溶解速度吗? 溶解性指一种物质(溶质)在另一种物质(溶 剂)里的溶解能力;溶解速度是快慢。
2. 在20℃时,100克氯化钠饱和溶液里含氯化钠24
克,则该温度下氯化钠的溶解度是24克。
×溶剂不是100g
3. 在60℃时,100克水中溶有75克氯化钠,所以
× 60℃时氯化钠的溶解度为75克。 不知是否饱和
4. 60℃时,100克水中最多溶解90克氯化钠,所以
× 60℃时氯化钠的溶解度为90。
浙教版八年级上册科学 1.5.2 物质的溶解度 课后习题重点练习课件

14.如表是氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时 的溶解度,回答问题。
(1)找出氯化钠与硝酸钾溶解度相等时所对应的温度范围 ___2_0_~__3_0_℃_______。
(2)60 ℃时,按图示操作:
A中溶液是_不__饱__和___(填“饱和”或“不饱和”)溶液,C中 溶液的总质量是__1_6_7_._6__克。 (3)50 ℃时,将两种物质的饱和溶液各100克,分别加热蒸 发10克水后,再恢复到50 ℃,剩余溶液的质量:NaCl 溶液__大__于____(填“大于”“等于”或“小于”)KNO3溶液。
(1)A 、 B 、 C 三 点 所 对 应 的 溶 液 , 属 于 不 饱 和 溶 液 的 是 ______C__________(填字母)。
(2)在40 ℃时,M物质的溶解度为___1_6_0___克,若保持溶剂的 质量不变,从C点对应的溶液获得M的晶体,可以采用的 方法是__降__温__结__晶_________________________________。
5.【中考·来宾】20 ℃时氯 化钾的溶解度为 34克, 下列是四位同学在20 ℃ 时配制的氯化钾溶液, 其中一定达到饱和的是( )
【解析】20 ℃时,氯化钾的溶解度是34克,其含义是 :20 ℃时,100克水中溶解34克氯化钾达饱和,由此可 知,20 ℃时,50克水中溶解17克氯化钾达饱和,故选B 。
第四组 50 30 12
下列说法错误的是( ) A.20 ℃时,50克NaCl饱和溶液中含有18克NaCl B.用蒸发的方法可以使不饱和溶液变成饱和溶液 C.第二组所得溶液中溶质与溶剂的质量比为9∶25 D.相同温度下,NaCl在水里的溶解度与水的质量无关
【解析】结合第二、第三、第四组实验中剩余固体的质 量,知道20 ℃时50克水中最多能溶解18克NaCl。20 ℃时 ,68克NaCl 饱和溶液中含有18克NaCl,A错误故选A。
易溶物质的溶解度范围

易溶物质的溶解度范围
溶解度是指在特定温度和压力下,一定量溶剂中可以溶解的溶质的最大量。
不同物质的溶解度范围差异很大,主要取决于溶质与溶剂之间的相互作用力。
一般来说,极性物质容易溶解于极性溶剂,非极性物质容易溶解于非极性溶剂。
这是由于"像溶像"的化学原理所决定的。
此外,温度、压力等因素也会影响溶解度。
1. 固体物质的溶解度范围
- 盐类(如NaCl)、糖类等极性无机/有机物质在水中的溶解度较高,可达数克至数百克/100毫升。
- 大多数金属氧化物、金属氢氧化物等离子化合物在水中的溶解度较低,通常在毫克/100毫升量级。
- 非极性有机物,如长链烷烃、脂肪等在水中几乎不溶解。
2. 液体物质的溶解度范围
- 极性液体(如醇类)在水中具有较高的溶解度,可达任意比例混溶。
- 非极性液体(如烃类)在水中的溶解度极低,通常在毫克/100毫升量级。
3. 气体物质的溶解度范围
- 一些极性气体(如氨、二氧化硫等)在水中的溶解度较高。
- 大多数非极性气体(如氮气、氧气等)在水中溶解度较低,大约在
20-60毫克/100毫升范围内。
溶解度是物质在溶剂中溶解的一个重要参数,对化学反应、生产过程等都有重要影响。
了解不同物质在不同溶剂中的溶解度范围,对于合理选择溶剂、控制反应条件等都非常必要。
浙教版八年级上1.5 物质的溶解(溶解度相关计算题)

浙,教版,八年级,上,1.5,物,质的,溶解,溶解度,有关溶解度的计算题(一)关于溶解度的计算的类型1. 已知一定温度下,饱和溶液中溶质的质量和溶剂的质量。
求该温度下的溶解度。
例如:把50克20℃时的硝酸钾饱和溶液蒸干,得到12克硝酸钾。
求20℃时硝酸钾的溶解度。
解析:溶液的质量为溶质质量和溶剂质量之和,因此50克硝酸钾饱和溶液中含水的质量是:50克-12克=38克设:20℃时100克水里溶解硝酸钾达到饱和状态时所溶解的质量为x溶质溶剂溶液12g 38g 50gx 100g (x+100)g解得x=31.6g答:20℃时硝酸钾的溶解度为31.6克(1)把20℃时53.6克氯化钾饱和溶液蒸干,得到13.6克氯化钾。
求20℃时,氯化钾的溶解度?设:20℃时氯化钾的溶解度为x溶质溶剂溶液13.6g 40g 53.6gx 100g (x+100)g解得x=34g答:20℃时氯化钾的溶解度为34克(2)20℃时,把4克氯化钠固体放入11克水中,恰好形成饱和溶液。
求20℃时,氯化钠的溶解度?设:20℃时氯化钠的溶解度为x溶质溶剂溶液4g 11g 15gx 100g (x+100)g解得x=36.4g答:20℃时氯化钠的溶解度为36.4克2. 已知某温度时物质的溶解度,求此温度下饱和溶液中的溶质或溶剂的质量。
例如:把100克20℃时硝酸钾的饱和溶液蒸干,得到24克硝酸钾。
则:(1)若配制350克20℃的硝酸钾的饱和溶液,需硝酸钾和水各多少克?(2)若将78克硝酸钾配成20℃时的饱和溶液,需水多少克?解析:设配制350克20℃的硝酸钾的饱和溶液,需硝酸钾和水的质量分别为x和y。
将78克硝酸钾配成20℃时的饱和溶液,需水质量为z。
溶质溶剂溶液24g (100-24)=76g 100gx y 350g78g z (78+z)g解得x=84g,y=266g解得z=247g总之,关于溶解度计算的关键就是将一定温度下溶液中溶质、溶剂、溶液的质量关系一一对应,列出正确的比例式求算。
八年级科学上册 1.5 物质的溶解(4)同步试题 (新版)浙教版

1.5 物质的溶解(4)1.实验室用硝酸钾固体配制100.0克溶质质量分数为3.0%的硝酸钾溶液,下列说法正确的是(D)(第1题)A.用量程为50毫升的量筒量水B.将固体放于托盘天平的右盘称取C.将固体直接投入量筒中溶解D.将配好的溶液装入贴有标签(如图)的试剂瓶中,塞好瓶塞2.实验室配制50克溶质质量分数为15%的氯化钠溶液。
下列说法中错误..的是(C)A.实验的步骤为计算、称取、量取、溶解、转移B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率C.把配制好的氯化钠溶液倒入刚用蒸馏水洗过的试剂瓶中,并贴上标签D.量取水时,用规格为50毫升的量筒量取42.5毫升蒸馏水3.实验室配制氯化钠溶液的操作中,正确的是(D)4.要配制100克5%的氯化钠溶液,除了需要托盘天平和量筒外,还需要用到的一组仪器是(B)A.烧杯、试管、玻璃棒B.烧杯、胶头滴管、玻璃棒C.烧杯、胶头滴管、漏斗D.烧杯、酒精灯、玻璃棒5.要配制100克5%的蔗糖溶液,以下操作会导致所配溶液的浓度偏低的是(A)A.称取5克含杂质的蔗糖B.用量筒量取90毫升水C.搅拌后玻璃棒上有液体残留D.量筒中的水未完全倒入烧杯中6.将80克质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为(C)A.80克B.100克C.200克D.280克7.探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,如图甲所示为该小组配制10%的氢氧化钠溶液的操作过程:(第7题)(1)图甲中仪器a的名称是烧杯。
(2)称量氢氧化钠时,必须将氢氧化钠固体放在玻璃器皿里,并置于托盘天平左(填“左”或“右”)盘进行称量。
(3)用量筒量取所需体积的蒸馏水时还用到胶头滴管(填写仪器名称),某同学在读取量筒读数时的视线如图乙所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数偏大(填“偏大”“偏小”或“无影响”)。
8.已知某物质在不同温度下的溶解度数据如下表所示:如果要配制该物质溶质质量分数为20%的饱和溶液200克,需要加水160 克,此时溶液的温度应为60 ℃。
1.5 物质的溶解(2)——溶解度

食盐、硝酸钾在不同温度下的溶解度
温度
氯 化钠 硝酸钾
0
35.7 13.3
10
35.8 20.9
20
36.0 31.6
30
36.3 45.8
40
50
60
37.3 110
70
37.8 138
80
38.4 169
90
39.0 202
100
39.8 246
- 新世纪教育网版 权所有
1、用溶解度来表示物质的溶解能力。
即:在一定的温度下,某物质在 100 克溶剂中 达到饱和状态时所溶解的质量为该物质在这种 溶剂里的溶解度。
注意点:
(1)理解这个概念,抓住四个词: 条件: 一定温度。温度不同,溶解度不同 标准: 100克溶剂(一般指水) 溶液状态:饱和状态 单位: 质量(克) (2)溶解度值越大,表明该温度下,物质的溶解能力 - 新世纪教育网版 越强。 权所有
2、20℃时,100克水中最多能溶解0.165克氢 氧化钙,则20℃时氢氧化钙的溶解度是 0.165克
- 新世纪教育网版 权所有
2、溶解性等级:
常见物质的溶解度(20℃)(单位:克)
物质 氯化钠 氢氧 化钙 名称 溶解度 36.0 0.165 蔗糖 氯酸钾 氯化铵 硝酸钾 碳酸钙 37.2 31.6 0.0013
权所有
溶解度的含义 1、“60℃时,硝酸钾的溶解度是110克”
这句话含义是 60℃ 时 , 在 100 克 水 中 溶 解
110 克硝酸钾达到饱和状态。 或: 60℃时,在 100 克水中 最多能溶解110克硝酸钾。 此时硝酸钾饱和溶液中溶质、溶剂、溶 11 10 21 液的质量比为_____∶______∶_____。
物质水溶液溶解度表(化学基础数据大全)
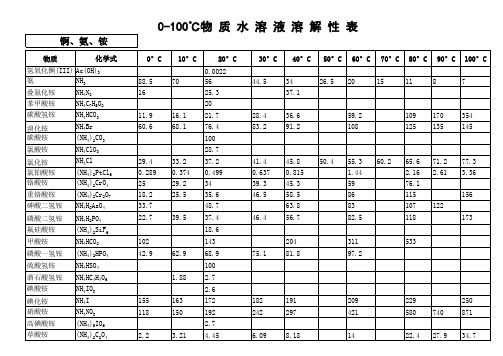
3.629×10-3 45
16.6 230 143 7.753×10-4 6.170×10 209 2.25 1.8
-4
17.1 213
17.5 278
17.9 295
18.4 312
1.83
1.49
0.83
0.518 16.6 4.303×10 0.173 0.24 66 4.099×10-3
-3
氢氧化铂(II) Pt(OH)2
碘酸钚(IV)
Pu(IO3)4
7.998×10-2
氮、镝
物质 一氧化氮 一氧化二氮 铬酸镝(III) NO N2O Dy2(CrO4)3·10H2O 化学式 0°C 10°C 20°C 5.6×10-3 0.112 0.663 30°C 40°C 50°C 60°C 70°C 80°C 90°C 100°C
37.7
34.6
49.9
68.9
96 70.6 47.9 45 120
105 73 54 55 144
115 75.4 60.8 63 170 2.15 0.48
126 78 68.8 70.5 208 0.84
143 81 78.4 76.5 234 1.32
192 88 104 86.9 346 2.42 95 144 150 103 153
钆、钙、锆、镉、铬、汞、钴、硅
物质 乙酸钆 溴酸钆 硫酸钆(III) 氯化钙 乙酸钙 化学式 Gd(C2H3O2)·4H2O 5.61 1.882×10-5 2.6 74.5 Gd(BrO3)3·9H2O Gd2(SO4)3 CaCl2 Ca(C2H3O2)2·2H2O 3.98 59.5 3.3 64.7 2.32 100 128 137 147 154 159 0°C 10°C 20°C 30°C 40°C 50°C 60°C 70°C 80°C 90°C 100°C
磷钨酸 溶解度

磷钨酸的溶解度探究
磷钨酸作为一种重要的无机化合物,在化学领域应用广泛。
但是,在实际应用过程中,磷钨酸的溶解度也是一个重要的问题。
本文将围
绕磷钨酸的溶解度展开探究。
首先,我们需要明确磷钨酸的溶解度受什么因素影响。
实验证明,磷钨酸的溶解度与溶剂、温度、压力、物质浓度等因素有关。
其中,
溶剂的选择对溶解度影响较大。
在水中,磷钨酸的溶解度可达 1.5g/L,而在乙醇中仅为0.02g/L。
此外,温度也是影响磷钨酸溶解度的关键因素。
随着温度升高,磷钨酸的溶解度会变大,这是因为在高温下溶解
度的吉布斯自由能变小。
那么,如何提高磷钨酸的溶解度呢?一种方法是采用一定的溶剂,如水、酸溶液等,可以较好地提高磷钨酸的溶解度。
此外,也可以通
过高温热解、改变酸碱环境、氧化还原等方法提高磷钨酸的溶解度。
最后,我们需要注意的是,磷钨酸的过量溶解会对环境造成一定
的影响。
因此,在实际应用过程中,需要注意使用量的控制,避免对
环境造成不必要的影响。
综上所述,磷钨酸的溶解度是一个复杂而重要的问题。
通过对磷
钨酸的溶解度进行系统的探究,我们可以更好地应用磷钨酸,同时也
可以更好地保护环境。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、某同学在某温度下向一定量的水中不断地加入蔗 糖,并搅拌。下列图中能正确反应所加入的蔗糖与 所得溶液溶质质量分数之间关系的图象是( D )
溶质 质量 分数
溶质 质量 分数
溶质 质量 分数
溶质 质量 分数
A
蔗糖 质量
B
蔗糖 质量
C
蔗糖 质量
D
蔗糖 质量
4、20℃时,氯化钠溶解度为36g,该温度下, 溶液中溶质的质量分数不可能是( ) A.20% B .26.5% C .25% D .以上三者都有可能
18.1%
饱和溶液中溶质的质量分数计算
20℃时,食盐的溶解度为36克, (1)计算此温度下饱和食盐水的食盐的质量分 数? 36克
w%= 100克+36克 =26.5%
S w% 100% (适用饱和溶液) 100g S
(2)能否配制出20℃溶质质量分数 为30%的食盐水? W<S
计算配制溶液所需溶质和溶剂的质量 例:配制溶质的质量分数为10%的氯化钠溶液50 克,问需要氯化钠多少克?水多少克?
能溶多 少呢?
在一定的温度下 ,一杯水中能无限制 地溶解某种物质吗?
【建立假设】 【设计实验】
不能无限制地溶解 !
试一试你一定行!
实验中的溶质,我 们采用硫酸铜晶体
蓝色晶体
在容器a里加一定量的水, 往烧杯里加入一 匙硫酸铜晶体,用玻璃棒搅拌, 配成溶液。 在容器b里加一定量的水, 往烧杯里不断加 入硫酸铜晶体,用玻璃棒搅拌, 配成溶液。
生产上常把物质溶液的密度和其相对应的溶质的质量分 数列成对照表。这样,当某物质溶液的密度测得后,就 可以从表中查出该物质溶液相对应的溶质的质量分数, 或根据该物质溶液中溶质的质量分数查得其相对应的溶 液的密度。
1、定义:溶质的质量与溶液的质量之比 2、定义式: 溶质的质量分数
=
溶质的质量 溶液的质量
=
溶质的质量 溶质的质量+溶剂的 质量
推导公式:
溶质=溶液×w%
注意:没有单位,是一个比值; 可用小数或百分数表示
溶液=溶质/w%
例1、在农业生产中有时用10%~20%的食盐溶 液来选种,配制150千克质量分数为16%的食盐 溶液,需要食盐和水各多少千克? 解:m 150 千克×16% = 24 千克 m水= 150千克- 24千克= 126千克
40
63.9
50
85.5
60
70
80
169
90
202
100
246
110.0 138
分析上表数据,你认为硝酸钾的溶解度与温度 的关系怎样? 硝酸钾的溶解度随着温升高而增大
闷热时,鱼儿为什么总爱在水面上进行呼吸?
气体的溶解度随温度的增加而减小. 随压强的减小而减小。
练一练:
1.给水加热时我们可以看到水煮沸前会出现气泡 减小 ,说明气体的溶解度随温度的增加而 ______. 2.打开健利宝盖时我们会看到有气体冒出,说明 压强 有关. 气体的溶解度和______ 气体溶解度一般随压强 增大而增大,压强减小 而减小。
在容器b中加 入食盐,它能继续 溶解吗?
动手做一做!
饱和溶液和不饱和溶液是针对某一物质。
饱和溶液和不饱和溶液.ram
1、 在一定的温度下,一定量的溶剂中,物 质能够溶解的量是有限的。 2、不饱和溶液:在一定温度下,在一定量的 溶剂里,能继续溶解某种溶质的溶液,称为这种 溶质的不饱和溶液。 3、饱和溶液:在一定温度下,在一定量的溶 剂里,不能继续溶解某种溶质的溶液,称为这种 溶质的饱和溶液。(注意:针对某一溶质来讲)
硝酸钾 31.6
说一说:
上表中哪些是易溶物质,哪些是微溶物质, 哪些是可溶物质,哪些是难溶物质?
易溶物质: 氯化钠、蔗糖、氯化铵、硝酸钾 微溶物质: 氢氧化钙 可溶物质: 氯酸钾 难溶物质: 碳酸钙
硝酸钾在不同温度时的溶解度
温度/0C
溶解度/克
0
13. 3
10
20. 9
20
31. 6
30
45. 8
1、实验室配制溶质质量分数一定的食盐溶液的三 个主要步骤依是 计算 、 称量和量取 、
溶解 ;若配制16%的硫酸钠溶液100克,需硫 酸钠 16 克,水 84 毫升。
2、实验室配制15%的氢氧化钠溶液所用的仪器是 ( A) A、玻璃棒、药匙、烧杯、量筒、托盘天平 B、托盘天平、烧瓶、药匙、玻璃棒、烧杯 C、量筒、漏斗、烧杯、玻璃棒、药匙
【故事】冲糖水的故事
小女孩:“妈妈,我要喝糖开水。” (妈妈将一玻璃杯放在桌上,向玻璃杯中倒水, 然后向其中加两勺糖,搅拌,糖全部溶解;又取 了一勺糖放入杯中,搅拌,杯底有糖剩余。)
小女孩:“妈妈,再加点糖。”
妈妈:“傻孩子,已经很甜了,再加也不会更甜 了。” 小女孩:“为什么呀?”
【提出问题】 某种物质在水中能无限制地溶解吗?
20℃时,氯化钠和蔗糖的溶解度分别 是36.0克和203.9克,这说明了什么?
溶解度数值越大,表明该温度 下,物质的溶解能力越强.
说一说:
1、“20℃时,硝酸钾的溶解度是31.6克”.含义 是 20℃时,在100克水中溶解31.6克硝酸钾刚好达到饱和状
态。 在20℃时,100g水中最多可溶解31.6g硝酸钾。
.a对b来说起 对照 作用 _______
a b 为了使实验结果更加精确,我们应该控制 哪些变量相同: 相同容器 相同体积的 相同温度 同种液体
硫酸铜的溶解.ram
.a与b对照: 问题1:a能继续溶解吗? 问题2:b能继续溶解吗? 问题3:一定温度下,一种 溶剂能无限制的溶解某种 溶质吗?
.a 能继续溶解硫酸铜。 .b 不能继续溶解硫酸铜。 .一定温度下,一种溶剂不能无限 制的溶解某种溶质。
饱和 溶液
①加溶质、②蒸发溶剂、③降低温度
不饱和 溶液
三只试管硫酸铜溶 液颜色不同,生活中, 浓稀 不同。 我们常说_____
你如何理解浓溶液和稀溶液? 浓溶液:溶有较多溶质的溶液;
稀溶液:溶有较少溶质的溶液。
1、饱和溶液跟溶液的浓、稀有关系吗?
2、浓溶液一定是饱和溶液吗? 稀溶液一定是不饱和溶液吗?
室温下(200C左右)三支试管A、B、C:
A试管: 10毫升水+1克硝酸钾
B试管: 10毫升酒精+1克硝酸钾 A B C C试管: 10毫升水+1克熟石灰
完全溶解。 没有完全溶解,有剩余。 没有完全溶解,有剩余。
A试管: B试管:
C试管:
A与B对照结论:
A
B
C
同种溶质在不同溶剂中溶解能力不同。
A与C对照结论:
二、溶解性等级: 根据物质在室温200C时的溶解度, 将它们在水中的溶解性分成四个等级。
200C 溶解性等级 大于10克 易溶 1-10克 可溶 0.01-1克 微溶 小于0.01克 难溶
物质 名称 溶解度
氯化钠 36.0
氢氧化钙 0.165
蔗糖 203.9
氯酸钾 7.4
氯化铵 37.2
碳酸钙 0.0013
三种颜色深浅不 同的硫酸铜溶液
你能判断哪种溶液是饱和溶 液,哪种溶液是不饱和溶液吗?
那么如何来判断溶液的饱和与不 饱和呢?
判断一种溶液 是不是饱和溶液的方法: 1. 如果溶液中有少量未溶的 溶质,则是饱和溶液。
2. 加少量的同种溶质,溶质能 继续溶解的是不饱和溶液,不 能溶解的是饱和溶液。
在一定温度下,向100克食 盐饱和溶液中加入3克食盐,充 分搅拌后,溶液的质量变为103 克,此说法对吗?为什么?
溶解度
不同溶质在同种溶剂中溶解能力不同。 那么我们可以用什么来表示溶质的溶解能力呢?
一、溶解度(S)
可以定量表示物质的溶解能力
1、定义:
在一定温度下,某物质在 100克溶剂中达到 饱和状态时所溶解的质量,叫做这种物质在这种 溶剂里的溶解度。 固体溶解度的四要素:
一定温度 条件: 100克溶剂(一般指水) 标准: 溶液状态: 饱和状态 单位: 质量(克)
下列叙述正确的是( C ) A. 饱和溶液一定是浓溶液 B. 不饱和溶液一定是稀溶液 C. 一定温度下,同种溶质的饱和溶液 比不饱和溶液浓度大 D. 一定温度下,不能继续溶解某溶质 的溶液是饱和溶液
回忆复习:
1、什么是饱和溶液? 在一定温度下,在一定量的溶剂里,不能 继续溶解某种溶质的溶液,称为这种溶质 的饱和溶液。 2、什么是不饱和溶液? 在一定温度下,在一定量的溶剂里,还能 继续溶解某种溶质的溶液,称为这种溶质的溶解0.165克氢
氧化钙,则20℃时氢氧化钙的溶解度是 0.165克
常见物质的溶解度(20℃)(单位:克)
物质名称 氯化钠 氢氧化钙 溶解度 36.0 0.165 蔗糖 氯酸钾 氯化铵 203.9 7.4 37.2 硝酸钾 31.6
从上表中的数据说明了什么?
在同一温度下,不同物质具有不同的溶解度
5.如图是某物质的溶解度曲线,50℃时取100克水配制 成该物质的饱和溶液,当温度降低到25℃时所得溶液 的质量为( C ) A.130克 B.170克
溶解度/克 70 40 25 50 温度/℃
C.140克
D.160克
有多少固体析出? 此时,该物质的质量分数是多少?
同一种溶液,溶液中溶质的质量分数不同, 溶液的密度是否相同?
饱和溶液 浓溶液 稀溶液
浓、稀溶液.ram
饱和溶液不一定是浓溶液 不饱和溶液不一定是稀溶液
不饱和 溶液
1. 任何物质的饱和溶液( D ) A. 一定是浓溶液 B. 一定是稀溶液 C. 一定不是稀溶液 D. 不一定是稀溶液
2. 将一杯接近饱和的硫酸铜溶液变为饱和溶 液,下列方法不正确的是( C ) A. 增加硫酸铜晶体 B. 蒸发水 C. 倒出一部分溶液 D. 降低温度
