常见物质溶解性溶度积
溶解度和溶度积表(全)

56.3 299
75.4 308
129 348
152 376
氯化镉 氰化镉 亚铁氰化镉 氟化镉 甲酸镉 氢氧化镉 碘酸镉 碘化镉 硝酸镉 草酸镉 高氯酸镉 磷酸镉 硒酸镉 硫酸镉 硫化镉 钨酸镉 硝酸铬 高氯酸铬 硫酸铬 叠氮化亚汞 溴化亚汞 碳酸亚汞 氯化亚汞 铬酸亚汞 氰化亚汞 高氯酸亚汞 硫酸亚汞 乙酸汞 苯甲酸汞 溴酸汞 溴化汞 氯酸汞 氯化汞 氰化汞 碘酸汞 碘化汞 草酸汞 硫化汞 硫氰酸汞 溴酸钴 溴化钴 氯酸钴 氯化钴 氟化钴 氟硅酸钴 碘酸钴
84 7.6× 10-2 25.5
89.6 0.24 30.5
203 97.4 0.4 104 36.1 1.2× 10-2
111 0.61 42
125 0.85 48.8
[编辑] 铪、氦、钬
物质
氢氧化铪(III) 氢氧化铪(IV) 氦 氢氧化钬(III) 硫酸钬(III) [编辑] 镓、钾、金
5.59 4.6× 10-2 250 11.5
8.22 5.7× 10-2
14.1 102
416
10.4
14.9
物质
一氧化氮 一氧化二氮 铬酸镝(III) [编辑] 铒
化学式
NO N2O Dy2(CrO4)3· 10H2O
0°C
10°C
30°C
40°C
物质
氢氧化铒(III) [编辑] 钒
化学式
Er(OH)3
31.2 43.9
33.5 44.6
0.159 26.2 28
1.67
2.48
35.8 45.4 2.775×10-4 80 9.732×10-3 0.16 2.8×10-2 31.9 1.3×10-2 0.687 3.89 3.5×10-2
化合物的溶度积常数表

1。07×10-21
*CuI
1。1×10—12
*Cr(OH)3
6。3×10—31
*PbS
8.0×10—28
*Hg2Cl2
1。3×10-18
*Cu(OH)2
2.2×10-20
*SnS
1×10-25
*Hg2I2
4。5×10—29
*Fe(OH)2
8.0×10—16
**SnS2
2×10—27
HgI2
1.38×10-9(25)
硫氰酸银
1。03×10—12(25)
硫化锌
1。2×10—23(18)
锶
碳酸锶
5.60×10—10(25)
氟化锶
4。33×10—9(25)
草酸锶
5。61×10—8(18)
硫酸锶
3.44×10—7(25)
铬酸锶
2.2×10—5(18—--285)
一些化合物的沉淀溶解pH值
氢氧化物
一水合碳酸铜
6。94×10—8(25)
氟化钡
1。84×10—7(25)
草酸铜
4.43×10-10(25)
碘酸钡Ba(IO3)2·2H2O
1.67×10—9(25)
硫化铜
8.5×10—45(18)
碘酸钡
4。01×10—9(25)
溴化亚铜
6。27×10—9(25)
镉
氯化亚铜
1.72×10-7(25)
草酸镉
2.0×10-9
*SrSO4
3.2×10-7
**Ni(丁二酮肟)2
4×10—24
*PbCrO4
2。8×10—13
硫化物
**Mg(8-羟基喹啉)2
常用化合物溶度积常数表
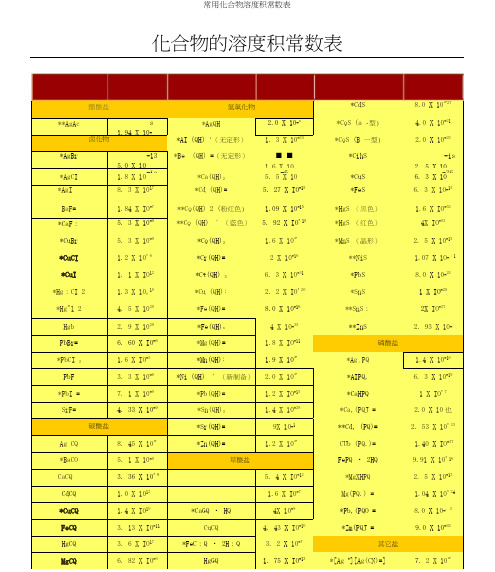
■ ■
1.6 X 10
*CihS
-is
2. 5 X 10
-io
-6
-36
*AgCI
1.8 X 10
*Ca(QH)2
5. 5 X 10
*CuS
6. 3 X 10
*AgI
8. 3 X 1017
*Cd (QH)=
5. 27 X IO-15
*FeS
6. 3 X 1O_1S
BaF=
MnCQ
2. 24 X IO-11
MgGQ ・ 2H:Q
4. 83XIO-6
*AgjFe(CN)j
1.6XIO-41
NiCQ
1.42 X IO-7
MnGQ ・ 2H=Q
1. 70 X IO-7
*Cu:[Fe(CN)6]
1.3X10-16
*PbCQ
7.4 X 10'14
**PbCx
8. 51 X IO-10
*摘自J・ A. Dean Ed・ Lange's Handbook of Chemi s try, 13th ・ edition 1985
**摘自其他参考书。
*Sn(QH)3
1.4 X 10-28
*Ca,(PQJ =
2.0 X 10也
碳酸盐
*Sr(QH)=
9X 10_1
**Cd, (PQ)=
2. 53 X 10'33
Ag CQ
8. 45 X 10"
*Zn(QH)=
1.2 X 10"
CUb (PQ.)=
1.40XIO-37
*BaCO
5. 1 X 10-9
草酸盐
无机化学第五章 溶度积

例2:25oC,已知Ksp(A2B)=4×10-12,求同温度下A2B的溶 解度S(A2B)/g·L-1。(A2B的相对分子质量为200)
解:
A2B
2A+ + B2-
平衡浓度 /(mol·L-1)
2x
x
Ksp = c(A )2 c(B2 )
4 10 12 = 2x2 x = 4x3 x = 104 mol/L
平衡浓度/(mol
1
L
)
x
x
Ksp (AgCl) = c(Ag )c(Cl ) = x2 =1.81010
1. AB型(如AgCl、AgI、CaCO3) AB (S) ⇋ A+ (aq) + B–(aq)
x
x
Ksp = c(A+ )c(B–) = x2
2. AB2或A2B型 (Mg(OH)2 、Ag2CrO4)
难溶 微溶
可溶
易溶
0.01 1
10
Sg/100g
S>10g 易溶 1>S>0.01g 微溶
10g>S>1g 可溶 0.01g>S 难溶
本章主要研究微溶和难溶
溶度积
在一定温度下,将难溶电解质放入水中时, 就发生溶解和沉淀两个过程。
以BaSO4为例:
Ba2+
H2O作用下
SO42-
H2O
BaSO4
BaSO4溶解过程
AB2(S) ⇋ A2+ (aq) + 2B–(aq)
x
2x
Ksp = c(A+ )c2(B –) = x(2x)2 = 4x3
3. AB3或A3B型 (如 Fe(OH)3 、Ag3PO4)
溶解度和溶度积表(全)
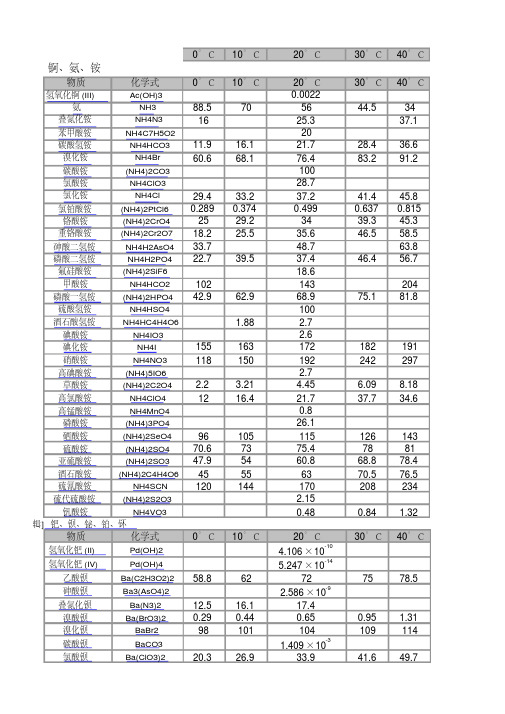
BaCl2 Ba(ClO2)2
BaCrO4 Ba(CN)2 Ba2Fe(CN)6
BaF2 BaSiF6 Ba(HCO2)2 BaHPO4 BaHPO3 Ba(OH)2·8H2O
31.2 43.9
26.2 1.67
碘酸钡
Ba(IO3)2
碘化钡 钼酸钡 硝酸钡 亚硝酸钡 草酸钡 氧化钡 高氯酸钡 高锰酸钡 焦磷酸钡 硒酸钡 硫酸钡 硫化钡 砷酸铋 氢氧化铋 碘化铋 磷酸铋 硫化铋 氢氧化铂 (II) 溴化铂 (IV) 氟化钚 (III) 氟化钚 (IV) 碘酸钚 (IV) [ 编辑 ] 氮、镝
2.519 ×10-5
8.18
0°C 10°C
216
233
41.4 46.2 65.8
213
1.83
1.49
17.1
0.16
0.141
0.38
0.52
67.6
70.8
152
191
104
8.79 0.264
7.14 0.265
129
152
348
376
氯化镉
CdCl2
100
135
135
氰化镉
Cd(CN)2
2.2 ×10-2
亚铁氰化镉
Cd2Fe(CN)6
8.736 ×10-5
氟化镉
CdF2
0.88
碘化钴 硝酸钴 亚硝酸钴 高氯酸钴 硫酸钴 二氧化硅
CoI2 Co(NO3)2 Co(NO2)2 Co(ClO4)2 CoSO4 SiO2
[ 编辑 ] 铪、氦、钬
物质
氢氧化铪 (III)
化学式
Hf(OH)3
氢氧化铪 (IV)
Hf(OH)4
标准溶度积ksp的计算公式

标准溶度积ksp的计算公式
标准溶度积ksp是一种计算溶解度的方法,它用来衡量一种物质在某种温度和压力下,在特定溶剂中可以溶解的最大量。
它的计算公式是Ksp = [A]^a[B]^b[C]^c...,其中A、B、C...是溶解在溶剂中的物质,a、b、c...是物质的溶解度系数。
使用标准溶度积ksp可以计算出溶解度,从而确定物质溶解的最大量。
比如,假设在某种温度和压力下,物质A、B、C的溶解度系数分别为2、3、4,那么溶解度ksp就可以通过Ksp = [A]^2[B]^3[C]^4来计算。
标准溶度积ksp计算出来的,可以用来判断溶解物在某种温度和压力下,是否容易溶解以及溶解的最大量。
它可以帮助我们了解溶解物的溶解性,从而提高溶解过程的效率,并有效控制溶解度。
此外,标准溶度积ksp还可以用来识别溶质之间的反应性,并根据反应性来调整溶解度。
例如,某种溶质在某种温度和压力下的溶解度系数可能会发生变化,如果使用标准溶度积ksp,就可以根据变化的溶解度系数来调整溶解度,从而提高溶解效率。
总之,标准溶度积ksp是一种有用的计算溶解度的工具,它可以帮助我们了解物质溶解的最大量,并根据反应性来调整溶解度,从而提高溶解效率。
常见物质溶解性及溶度积
溴化铵
NH4Br
60.6
68.1
76.4
83.2
91.2
108
125
135
145
碳酸铵
(NH4)2CO3
100
氯酸铵
NH4ClO3
28.7
氯化铵
NH4Cl
29.4
33.2
37.2
41.4
45.8
50.4
55.3
60.2
65.6
71.2
77.3
氯铂酸铵
(NH4)2PtCl6
0.289
0.374
0.499
37.4
36
34.7
33.8
33.2
32.7
33.5
31.1
29.7
砷酸钙
Ca3(AsO4)2
3.629×10-3
叠氮化钙
Ca(N3)2
45
苯甲酸钙
Ca(C7H5O2)2
·3H2O
2.32
2.45
2.72
3.02
3.42
4.71
6.87
8.55
8.7
碳酸氢钙
Ca(HCO3)2
16.1
16.6
17.1
1.352×10-7
氟化钚(III)
PuF3
3.144×10-4
氟化钚(IV)
PuF4
3.622×10-4
碘酸钚(IV)
Pu(IO3)4
7.998×10-2
[编辑]氮、镝
物质
化学式
0°C
10°C
20°C
30°C
40°C
50°C
60°C
70°C
80°C
溶解度积与溶解度的关系
溶解度积与溶解度的关系溶解度积是化学中一个重要的概念,它是指在一定温度下溶解度可测定的不易溶解物质在水溶液中浓度的乘积,通常用符号Ksp表示。
溶解度积的大小与溶解度直接相关,而溶解度则决定了溶液中物质的浓度。
本文将探讨溶解度积与溶解度的关系及其在化学反应和溶解度计算中的应用。
一、溶解度积的定义及计算公式溶解度积是指在一定温度下,一种物质在水中溶解时,形成的离子浓度的乘积。
对于一般的无机盐,它的溶解过程可以用一个一般的化学方程式表示:AaBb (s) → aA+ (aq) + bB- (aq)在这个化学方程式中,AaBb代表不溶解物质,aA+为不溶解物质的正离子,bB-为不溶解物质的负离子。
根据溶解度积的定义,它可表示为:Ksp = [A+]^a[B-]^b其中,[A+]表示正离子的浓度,[B-]表示负离子的浓度。
当溶解度积达到平衡时,离子的生成和析出速率相等,此时的溶解度积为平衡常数。
根据平衡常数的性质,我们可以预测溶液中溶质的溶解度。
二、溶解度积与溶解度之间存在着密切的关系。
溶解度指的是在一定温度和压力下,单位体积的溶液中能够溶解的溶质的量。
溶解度积大,说明溶解物质在水中溶解得越多,其饱和溶液的溶解度也相应增大;相反,溶解度积小,溶解物质在水中溶解得越少,其饱和溶液的溶解度也相应减小。
一般来说,溶解度积越大,溶解度越大,溶液中溶质的浓度越高。
这是因为高溶解度积意味着在溶质和溶剂之间形成的化学平衡偏向于产生更多离子。
例如,当溶解度积确定的不溶解物质溶解时,溶液中的离子浓度较高,溶质的溶解度也较高。
三、溶解度积与化学反应的应用溶解度积在化学反应中起到重要的作用。
通过溶解度积的计算和测定,我们可以判断一些物质之间是否发生反应,推测化学反应的方向,并计算出反应的平衡浓度。
例如,当给定两种盐溶液Ba(NO3)2和Na2SO4时,根据它们的溶解度积,我们可以判断出它们之间是否会发生双替代反应。
根据溶解度积计算和测定的结果,我们可以得出以下方程式:Ba(NO3)2 (aq) + Na2SO4 (aq) → BaSO4 (s) + 2NaNO3 (aq)利用溶解度积与溶解度之间的关系,我们可以推测出BaSO4盐的沉淀会形成,并判断反应方程式的方向。
常见物质溶解性及溶度积
31.2
33.5
35.8
38.1
40.8
46.2
52.5
55.8
59.4
氯酸钡
Ba(ClO2)2
43.9
44.6
45.4
47.9
53.8
66.6
80.8
铬酸钡
BaCrO4
2.775×10-4
氰化钡
Ba(CN)2
80
亚铁氰化钡
Ba2Fe(CN)6
9.732×10-3
氟化钡
BaF2
0.159
0.16
HNO3
-
HNO3
-
-
-
水
-
-
水
水
水
-
-
水
水
水
水
水
HCl
水
水
水
水
水
水
CNS-
不溶
HNO3
HNO3
水
-
HNO3
HCl
-
-
-
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
碘化物, I-
不溶
HNO3
略溶,
HNO3
HCl
HCl
略溶
水
水
水解,
HCl
水
水解,
HCl
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
溴化物, Br-
不溶
HNO3
不溶
HCl
溶度积的名词解释
溶度积的名词解释溶度积是化学中一个重要的概念,用来描述固体溶解于溶液中的程度。
在化学反应中,一般来说,溶解产物溶解度的大小会对反应平衡产生重要影响。
溶度积能够帮助我们理解溶解过程中物质的溶解特性,并在实际应用中提供参考。
溶度积的定义是指溶解度较小的物质在饱和溶液中所形成的离子浓度的乘积。
对于一个给定的物质,其溶度积可通过实验测定或计算推导得出。
一般情况下,溶度积被表示为一个化学反应的乘积形式。
考虑一个简单的例子,乙酸钙(CaCH3COO)在水中溶解时可以发生如下反应:CaCH3COO(s) ⇌ Ca2+(aq) + 2CH3COO-(aq)在饱和溶液中,化学反应向前和向后进行的速率相等,达到了动态平衡。
在此平衡条件下,乙酸钙的固体与水溶液中乙酸根离子(CH3COO-)和钙离子(Ca2+)的浓度都是稳定的。
我们可以用数学方式来表示溶度积。
根据上述反应式,我们可以得出溶度积的定义为:溶度积 = [Ca2+][CH3COO-]²其中[Ca2+]表示钙离子的浓度,[CH3COO-]表示乙酸根离子的浓度。
溶度积的值越大,表示物质在水中溶解的程度越大。
溶度积在化学实验和工业生产中有着广泛的应用。
首先,了解物质在溶液中的溶解程度可以帮助化学家确定化学反应的平衡产物和反应条件。
通过测定溶度积,我们可以了解到物质溶解的极限。
例如,在一些制药过程中,溶度积可以帮助研究人员确定药物的溶解性,进而指导合成过程的条件优化。
此外,溶度积还可以用来判断是否发生沉淀反应。
当两种溶液混合时,如果产生的离子浓度大于其溶度积的值,就会发生沉淀现象。
这对于一些实验室实践和环境监测中的离子分析非常重要。
此外,溶度积对于了解环境中某些重金属离子的毒性也非常有帮助。
一些金属离子的毒性和生物有效性与其溶度积有关。
了解并计算溶度积可以提供给环境科学家和生态学家在环境监测和生物监测中使用。
总之,溶度积是化学中一个重要的概念,用来描述溶液中固体物质所溶解的程度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
39.5
37.4
46.4
56.7
82.5
118
173
氟硅酸铵
(NH4)2SiF6
18.6
甲酸铵
NH4HCO2
102
143
204
311
533
磷酸一氢铵
(NH4)2HPO4
42.9
62.9
68.9
75.1
81.8
97.2
硫酸氢铵
NH4HSO4
100
酒石酸氢铵
NH4HC4H4O6
1.88
2.7
碘酸铵
BaCl2
31.2
33.5
35.8
38.1
40.8
46.2
52.5
55.8
59.4
氯酸钡
Ba(ClO2)2
43.9
44.6
45.4
47.9
53.8
66.6
80.8
铬酸钡
BaCrO4
2.775×10-4
氰化钡
Ba(CN)2
80
亚铁氰化钡
Ba2Fe(CN)6
9.732×10-3
氟化钡
BaF2
0.159
0.16
HNO3
-
HNO3
-
-
-
水
-
-
水
水
水
-
-
水
水
水
水
水
HCl
水
水
水
水
水
水
CNS-
不溶
HNO3
HNO3
水
-
HNO3
HCl
-
-
-
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
碘化物, I-
不溶
HNO3
略溶,
HNO3
HCl
HCl
略溶
水
水
水解,
HCl
水
水解,
HCl
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
溴化物, Br-
不溶
HNO3
不溶
常见物质溶解性
Ag+
Hg22+
Pb2+
Hg2+
Bi3+
Cu2+
Cd2+
As3+
Sb3+
Sn2+
Sn4+
Al3+
Cr3+
Fe3+
Fe2+
Mn2+
Ni2+
Co2+
Zn2+
Ba2+
Sr2+
Ca2+
Mg2+
K+
Na+
NH4+
碳酸盐, CO32-
HNO3
HNO3
HNO3
HCl
HCl
HCl
HCl
-
-
-
-
-
-
-
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
略溶
水
水
水
草酸盐,C2O42-
HNO3
HNO3
HNO3
HCl
HCl
HCl
HCl
-
HCl
HCl
水
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
水
水
水
水
氟化物, F-
水
水
略溶,
HNO3
水
HCl
略溶,
HCl
略溶,
HCl
-
略溶,
HCl
水
水
水
水
略溶,
BaC2O4·2H2O
3×10-3
氧化钡
BaO
3.8
高氯酸钡
Ba(ClO4)2
239
336
416
495
575
653
高锰酸钡
Ba(MnO4)2
1.5×10-2
焦磷酸钡
Ba2P2O7
9×10-3
硒酸钡
BaSeO4
5×10-3
硫酸钡
BaSO4
2.448×10-4
硫化钡
BaS
2.88
4.89
7.86
10.4
HNO3
HNO3
HNO3
HCl
HCl
水
HCl
-
-
HCl
-
-
HCl
水
-
略溶,
HCl
HCl
HCl
水
HCl
略溶
水
水
水
水
水
硫化物S2-
HNO3
王水
HNO3
王水
HNO3
HNO3
HNO3
HNO3
浓HCl
浓HCl
浓HCl
水解,
HCl
水解,
HCl
HCl
HCl
HCl
HNO3
HNO3
HCl
水
水
水
水
水
水
水
氰化物, CN-
N2O
0.112
铬酸镝(III)
Dy2(CrO4)3·10H2O
0.663
[编辑]铒
物质
化学式
0°C
10°C
20°C
30°C
40°C
50°C
60°C
70°C
80°C
90°C
100°C
氢氧化铒(III)
Er(OH)3
1.363×10-5
[编辑]钒
物质
化学式
0°C
10°C
20°C
30°C
40°C
50°C
HCl
略溶,
HCl
HCl
HCl
HCl
HCl
略溶
HCl
不溶
HCl
水
水
水
亚硫酸盐, SO32-
HNO3
HNO3
HNO3
HCl
-
HCl
HCl
-
-
HCl
-
HCl
-
-
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
水
水
水
水
AsO33-
HNO3
HNO3
HNO3
HCl
HCl
HCl
HCl
-
-
HCl
-
-
-ቤተ መጻሕፍቲ ባይዱ
HCl
HCl
14.9
27.7
49.9
67.3
60.3
砷酸铋
BiAsO4
7.298×10-4
氢氧化铋
Bi(OH)3
2.868×10-7
碘化铋
BiI3
7.761×10-4
磷酸铋
BiPO4
1.096×10-10
硫化铋
Bi2S3
1.561×10-20
氢氧化铂(II)
Pt(OH)2
3.109×10-11
溴化铂(IV)
PtBr4
热水
水
水
水
-
水
水
-
-
-
-
-
-
水
-
水
水
水
水
水
水
水
水
水
水
水
硝酸盐, NO3-
水
略溶,
HNO3
水
水
略溶,
HNO3
水
水
-
-
-
-
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
O2-
HNO3
HNO3
HNO3
HCl
HNO3
HCl
HCl
HCl
HCl
HCl
HCl,
略溶
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
略溶,
溴酸钆(III)
Gd(BrO3)3
·9H2O
50.2
70.1
95.6
126
166
氢氧化钆(III)
Gd(OH)3
1.882×10-5
硫酸钆(III)
Gd2(SO4)3
3.98
3.3
2.6
2.32
氯化钙
CaCl2
59.5
64.7
74.5
100
128
137
147
154
159
乙酸钙
Ca(C2H3O2)2
·2H2O
0.637
0.815
1.44
2.16
2.61
3.36
铬酸铵
(NH4)2CrO4
25
29.2
34
39.3
45.3
59
76.1
重铬酸铵
(NH4)2Cr2O7
18.2
25.5
35.6
46.5
58.5
86
