江苏省无锡市2021届高考化学综合测试试题
江苏省无锡市江阴华士高级中学2021年高三化学测试题含解析

江苏省无锡市江阴华士高级中学2021年高三化学测试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 对于相同温度时三种溶液:a.盐酸 b.醋酸 c.氯化铵溶液。
下列说法正确的是()A.相同浓度的三种溶液,溶液中的c(H+)相同B.相同浓度的三种溶液中水的电离度:c>b>aC.pH相同的三种溶液完全反应消耗的氢氧化钠的物质的量:c>b>aD.同浓度、同体积三种溶液与一定量NaOH恰好反应后,阴离子浓度相同参考答案:B略2. 下列化学用语表述一定正确的是A.甲醛的电子式:B.用铜电极做盐酸溶液的电解实验:C.溴乙烷与氢氧化钠水溶液共热:D.澄清石灰水中加入过量的小苏打溶液:参考答案:D略3. 用N A代表阿伏加德罗常数的值,下列说法正确的是()A.100mL lmol/L的FeCl3溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1N A B.7.8 g Na2O2中含有的离子总数目为0.4N AC.30g SiO2晶体中含有Si—O键的数目为2N AD.标准状况下44.8L HF溶于水配成溶液中所含F—的数目为2N A参考答案:略4. 下列有关实验原理或实验操作正确的是图1 图2图3 图4A. 图1装置可用于制取少量氯气B. 图2装置可用于验证酸性:H2SO4>H2CO3>HClOC. 图3装置可用于检验制得的乙烯中是否混有SO2和CO2D. 图4装置可用于灼烧CuSO4·5H2O晶体以除去结晶水参考答案:B浓盐酸和二氧化锰反应需要加热,故A错误;乙烯被酸性高锰酸钾氧化生成二氧化碳,且SO2被酸性高锰酸钾氧化掉,不能使品红褪色,不能确定是否含有SO2,故C错误;灼烧结晶水合物应在坩埚进行,故D错误;故答案为B。
5. 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。
江苏省无锡市辅仁中学2021年高三化学联考试卷含解析

江苏省无锡市辅仁中学2021年高三化学联考试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. (2分)在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目无变化的是()B因为加入的过氧化钠具有强氧化性,所以二价铁会被氧化为三价铁,两者变化均较大,过氧化钠和水反应生成氢氧化钠和氧气,钠离子增加,反应生成NaOH与NH4+结合微热会产生挥发性的氨气,所以铵根减少,铝离子加过量过氧化钠时生成偏铝酸钠,再加过量盐酸又反应生成铝离子,即Al3+数目无变化.2. 在某无色透明酸性溶液中,能共存的离子组是()A、NH4+NO3-Al3+ Cl-B、Na+ AlO2-K+NO3-C、MnO4- K+SO42- Na+D、K+SO42- HCO3-Na+参考答案:A略3. 下列对实验现象的表述正确的是A.将装有等量的NO2与N2O4混合气体的两个容积相同的玻璃球分别浸入热水和冷水中,浸入热水中的玻璃球里气体颜色较浅B.红热的铜丝可以在氯气中燃烧,生成黑色的固体C.将稀盐酸滴到二氧化锰固体上立即产生黄绿色气体D.将白色的硫化锌固体浸入硫酸铜溶液中,会发现固体逐渐变为黑色参考答案:D4. 下列除去杂质(括号内为杂质)的方法正确的是①乙烷(乙烯)光照条件下通入Cl2,气液分离②乙酸乙酯(乙酸)用饱和碳酸氢钠溶液洗涤、分液③苯(乙酸)用氢氧化钠溶液洗涤、分液④乙醇(乙酸)加足量生石灰、蒸馏A.①②③B.②③④C.①③④D.①②④参考答案:B略5. 下列有关实验装置进行的相应实验,能达到实验目的的是A.用图1所示装置除去Cl2中含有的少量HClB.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体C.用图3所示装置制取少量纯净的CO2气体D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层参考答案:DA中氢氧化钠也能吸收Cl2;B中蒸干NH4Cl饱和溶液时,NH4Cl晶体受热会分解;C中纯碱为易溶于水的粉末。
江苏省无锡市2020┄2021届高三化学上学期期末考试试题Word版 含答案

江苏省无锡市2021年高三化学上学期期末考试试题本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分120分,考试时间100分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Mg—24 P—31Cl—35.5 Co—59第Ⅰ卷(选择题共40分)单项选择题:本题包括10小题,每小题2分,共20分。
每小题只有一个选项符合题意。
1. 2021年11月第四届国际碳材料大会在上海举行,碳材料产品丰富,应用广泛,让人感到“碳为观止”。
下列敘述正确的是()A.金刚石与石墨互为同位素B.石墨烯是一种有发展前途的导电材料C.碳纤维、合成纤维、光导纤维都属于高分子材料D.富勒烯是由60个碳原子以碳碳单键构成的分子2. 用化学用语表示2Na+2H2O===2NaOH+H2↑中的相关微粒,其中正确的是()A.中子数为10的氧原子:错误!O B. NaOH的电子式:Na错误!错误!错误!错误!错误!C. Na+的结构示意图:D. H2O的比例模型:3. 下列有关物质的性质与用途具有对应关系的是()A.氨气具有还原性,可用作制冷剂B.次氯酸具有弱酸性,可用作有色物质的漂白剂C.浓硫酸具有强氧化性,可用作酯化反应的催化剂D.碳酸钠溶液显碱性,可用其热溶液除去金属餐具表面油污4. 室温下,下列各组离子在指定溶液中能大量共存的是()A. 0.1 m ol ·L—1的H2SO4溶液:NH错误!、Fe2+、Cl—、NO错误!B. 0.1 mol ·L—1的FeCl3溶液:K+、Al3+、SO错误!、NO错误!C. 0.1 mol ·L—1的Na2SO3溶液:Ba2+、K+、ClO—、MnO错误!D. 0.1 mol ·L—1的Ba(OH)2溶液:Mg2+、Na+、HCO错误!、Cl—5. 下列有关实验原理或操作正确的是()A.用图甲所示装置配制银氨溶液B.用图乙所示装置制取并收集干燥纯净的NH3C.用图丙所示装置可以比较KMnO4、Cl2、S的氧化性D.用图丁所示装置蒸干CuSO4溶液制备胆矾晶体6. 下列有关化学反应的叙述正确的是()A.将Na2O2投入NH4Cl溶液中只可能生成一种气体B.铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同C. SO2通入BaCl2溶液有白色沉淀BaSO3生成D.向滴有酚酞的Na2CO3溶液中加入足量CaCl2溶液,溶液红色褪去7. 下列指定反应的离子方程式正确的是()A. Fe3O4溶于足量稀HNO3:Fe3O4+8H+===Fe2++2Fe3++4H2OB.向KClO3溶液中滴加稀盐酸:ClO错误!+Cl—+6H+===Cl2↑+3H2OC.向Al2(SO4)3溶液中滴加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH 错误!D.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO错误!+Ba2++OH—===BaSO4↓+H2O8. 短周期主族元素X、Y、Z、W原子序数依次增大,Y的原子半径是短周期主族元素原子中最大的,X与Z属于同一主族,Z的最外层电子数为最内层电子数的3倍。
江苏省无锡市2021年高考化学综合测试试题
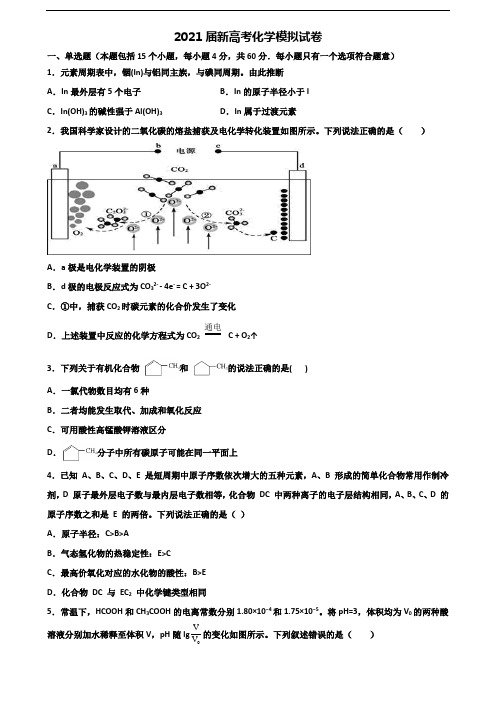
2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.元素周期表中,铟(In)与铝同主族,与碘同周期。
由此推断A.In最外层有5个电子B.In的原子半径小于IC.In(OH)3的碱性强于Al(OH)3D.In属于过渡元素2.我国科学家设计的二氧化碳的熔盐捕获及电化学转化装置如图所示。
下列说法正确的是()A.a极是电化学装置的阴极B.d极的电极反应式为CO32- - 4e- = C + 3O2-C.①中,捕获CO2时碳元素的化合价发生了变化D.上述装置中反应的化学方程式为CO2通电C + O2↑3.下列关于有机化合物和的说法正确的是( )A.一氯代物数目均有6种B.二者均能发生取代、加成和氧化反应C.可用酸性高锰酸钾溶液区分D.分子中所有碳原子可能在同一平面上4.已知A、B、C、D、E 是短周期中原子序数依次增大的五种元素,A、B 形成的简单化合物常用作制冷剂,D 原子最外层电子数与最内层电子数相等,化合物DC 中两种离子的电子层结构相同,A、B、C、D 的原子序数之和是 E 的两倍。
下列说法正确的是()A.原子半径:C>B>AB.气态氢化物的热稳定性:E>CC.最高价氧化对应的水化物的酸性:B>ED.化合物DC 与EC2中化学键类型相同5.常温下,HCOOH和CH3COOH的电离常数分别1.80×10−4和1.75×10−5。
将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lgVV的变化如图所示。
下列叙述错误的是()A .溶液中水的电离程度:b 点<c 点B .相同体积a 点的两溶液分别与NaOH 恰好中和后,溶液中n(Na +)相同C .从c 点到d 点,溶液中--(HA)(O (H ))A c c c ⋅不变(HA 、A -分别代表相应的酸和酸根离子) D .若两溶液无限稀释,则它们的c(H +)相等6.下列有关碳酸钠在化学实验中的作用叙述错误的是( )A .用碳酸钠溶液制备少量烧碱B .用饱和碳酸钠溶液除去CO 2中混有的HCl 气体C .用饱和碳酸钠溶液除去乙酸乙酯中混有的乙醇和乙酸D .用热的碳酸钠溶液洗涤银镜反应前试管内壁的油污7.海南是海洋大省,拥有丰富的海洋资源,下列有关海水综合利用的说法正确的是A .蒸发海水可以生产单质碘B .蒸馏海水可以得到淡水C .电解海水可以得到单质镁D .海水制食用盐的过程只发生了物理变化8.已知有关溴化氢的反应如下:反应I :2222CuCl4504HBr O 2Br 2H O ++℃反应Ⅱ:3424NaBr(s)H PO ()NaH PO HBr ∆+===+↑浓 反应Ⅲ:2522324HBr P O 2Br P O 2H O +===++下列说法正确的是A .实验室可用浓34H PO 与NaBr 反应制HBr 并用25P O 干燥B .反应Ⅰ中还原剂和还原产物的物质的量之比为2:1C .HBr 有强还原性,与3AgNO 溶液发生氧化还原反应D .HBr 的酸性比HF 强,可用氢溴酸在玻璃器皿表面作标记9.化学与人类生产、生活密切相关。
江苏省无锡市广勤中学2021年高三化学测试题含解析

江苏省无锡市广勤中学2021年高三化学测试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 短周期主族元素A、B、C、D、E原子序数依次递增,A、B两元素相邻,B、C、E原子最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。
下列说法正确的是A.元素B和E的氧化物对应的水化物均为强酸B.C的单质能与A的氧化物发生置换反应C.元素C、D、E的最高价氧化物对应的水化物之间均可相互反应D.工业上常用电解元素C、D的氯化物来制取它们的单质参考答案:B略2. 设N A表示阿伏加德罗常数的值,下列表述不正确的是()A.标准状况下,22.4L氢气所含质子数是2N AB.5.4g水所含的分子数为0.3N AC.含1mol硫酸钾的溶液中硫酸根离子数为2N AD.1mol金属钠与水反应失去的电子数为N A参考答案:C略3. BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种:(BHT)下列说法正确的是A.能与Na2CO3溶液反应生成CO2B.与BHT互为同系物C.BHT久置于空气中会被氧化D.两种方法的反应类型都是加成反应参考答案:BC略4. pH=1的两种酸溶液A、B各1mL,分别加水稀释到 1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是A.A、B两种酸溶液的物质的量浓度一定相等B.若a=4,则A是强酸,B是弱酸C.若1<a<4,则A、B都是弱酸D.稀释后,A酸溶液的酸性比B酸溶液弱参考答案:A略5. 下列图示与对应的叙述相符的是()A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)C.图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大参考答案:C考点:溶解度、饱和溶液的概念;催化剂的作用;物质的量或浓度随时间的变化曲线.专题:图示题.分析:A、吸热反应,反应物的总能量小于生成物的总能量,反应中加入催化剂会降低活化能,改变反应的速率,但反应热不改变;B、原电池原理能加速金属的腐蚀速率,根据金属Zn的消耗情况来确定生成氢气的量的多少;C、溶解度曲线上的点是饱和溶液,曲线以下的点是不饱和溶液来分析;D、对于可逆反应,当达到化学平衡状态时反应物的转化率最大,生成物的产率最大.解答:解:A、吸热反应,反应物的总能量小于生成物的总能量,与图不符,故A错误;B、锌粉与足量的等浓度的盐酸反应在滴加CuSO4溶液后能加速金属锌的腐蚀速率,但是金属Zn被消耗掉一部分来置换金属铜,所以用来生成氢气的金属锌质量减少,产生的氢气量减少,,故B错误;C、溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,故C正确;D、对于可逆反应,当达到化学平衡状态时反应物的转化率最大,t时不是平衡状态,反应物转化率不是最大,故D错误.故选C.点评:本题以图象题的形式呈现来考查知识点,做题时要注意从图象中获取正确信息,正确判断得出结论.6. 下列有关工业生产的叙述正确的是()A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率B.联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠。
江苏省无锡市第十高级中学2021年高三化学联考试卷含解析

江苏省无锡市第十高级中学2021年高三化学联考试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是A.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e-→4OH-B.电解饱和食盐水时,阳极的电极反应式为:2Cl-→Cl2↑+2e-C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu→Cu2+ +2e-D.钢铁发生电化学腐蚀的正极反应式:Fe→Fe2++2e-参考答案:B略2. 常温下,下列各组离子在指定溶液中一定能大量共存的是A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-C.pH=12的溶液:K+、Na+、CH3COO-、Br-D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3参考答案:C3. 中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。
下列推断不正确的是( ) A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁B.若D是一种强碱,则A、B、C均可与X反应生成DC.若D为NaCl,且A可与C反应生成B,则E可能是CO2D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C 参考答案:A略4. 下列是几种常见有机物的比例(填充)模型,其中可以表示溴乙烷的是A B C D参考答案:C略5. 常温下,将200 mL pH = a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间后,测得溶液的PH 变为b(溶液体积的变化忽略不计),在整个电解过程中始终只有一个电极上有气体产生。
下列说法错误的是A.b<a<7B.阴极电极反应式为:Cu2++2e-=CuC.向溶液中加人9.8x(10-b-10-a)gCu(OH)2可使溶液恢复到电解前的浓度D.阳极产生的气体是O2,其体积(标准状况下)为1.12x(10-b-10-a)L参考答案:C略6. 判断下列说法正确的是A.我们把直径大小在1nm~100nm之间的粒子称为胶体 B. 碱性氧化物均是金属氧化物C. 胶体带电,故可以在电场作用下产生电泳现象 D. 酸性氧化物均可以和水反应参考答案:B略7. 在25℃时,H2R及其钠盐的混合溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是()A.H2R是二元弱酸,其K a1=1×10-2B.当溶液恰好呈中性时,c( Na+ )=2c ( R2- ) + c( HR- )C.NaHR在溶液中水解倾向大于电离倾向D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2参考答案:C试题分析:A.根据图像可知,在溶液中存在H2R、HR-、R2-,说明H2R是弱酸。
2021-2022学年江苏省无锡市堰桥中学高三化学测试题含解析

2021-2022学年江苏省无锡市堰桥中学高三化学测试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平)对该氧化还原反应型离子方程式说法不正确的是A. IO-4作氧化剂B. 氧化剂和还原剂的物质的量之比为5:2C. 若有参加反应时则转移10 mol电子D. 配平后的化学计量数分别为2、3参考答案:D略2. 下列说法正确的是A.煤的气化和液化是高效、清洁地利用煤炭的重要途径B.蚕丝的主要成分是纤维素C.pH小于7.0的降雨通常称为酸雨D.含磷合成洗涤剂易于被细菌分解,故不会导致水污染参考答案:A3. 某反应的反应过程和能量变化如图所示,下列有关该反应的叙述正确的是()A.该反应的反应热△H<0B.反应物的总能量低于生成物的总能量C.该反应是吸热反应D.加入催化剂后反应放出的热会减少参考答案:A考点:反应热和焓变..专题:化学反应中的能量变化.分析:-图象中能量变化分析可知反应物能量高于生成物的能量,反应是放热反应;依据反应特征分析判断各选项.解答:解:A、反应是放热反应,△H<0,故A正确;B、依据图象可知反应物的总能量高于生成物的总能量,故B错误;C、反应是放热反应,故C错误;D、催化剂改变反应速率,不改变平衡,反应的焓变不变,故D错误;故选A.点评:本题考查了反应能量变化的分析判断,图象分析是解题关键,反应的能量守恒是判断的依据.4. 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是()A.NaNO2在水中的溶解性大于NH4NO2B.NaNO2与N2H4反应中,NaNO2是氧化剂C.可用KI、淀粉和食醋鉴别NaNO2和NaClD.分解NaN3盐每产生1 mol N2转移6 mol e﹣参考答案:D【考点】含氮物质的综合应用.【专题】氮族元素.【分析】A.根据铵盐加热易分解,而钠盐加热难分解;B.根据氧化剂是化合价升高的反应物;C.根据信息可知:NaNO2具有氧化性,在酸性条件下氧化碘化钾,得到单质碘,单质碘遇淀粉溶液变蓝,而NaCl无氧化性;D.根据NaN3中氮的化合价为﹣,生成1个N2转移个电子.【解答】解:A.NH4NO2加热易分解,而NaNO2加热难分解,所以NaNO2的稳定性大于NH4NO2,故A正确;B.NaNO2与N2H4反应生成NaN3,NaNO2是中氮的化合价由+3价降低为﹣,是氧化剂,故B正确;C.NaNO2具有氧化性,在酸性条件下氧化碘化钾,得到单质碘,单质碘遇淀粉溶液变蓝,NaCl无氧化性,在酸性条件下不能氧化碘化钾,所以可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2,故C正确;D.NaN3中氮的化合价为﹣,生成1个N2转移个电子,则每产生1 mol N2转移mole﹣,故D 错误;故选D.【点评】本题主要考查了亚硝酸钠的性质,难度不大,注意抓住题目信息来解题.5. 依照阿伏加德罗定律,下列叙述中正确的是 ( )A.同温同压下两种气体的体积之比等于摩尔质量之比B.同温同压下两种气体的物质的量之比等于密度之比C.同温同压下两种气体的摩尔质量之比等于密度之比D.同温同体积下两种气体的物质的量之比等于压强反比参考答案:答案:C6. 下列叙述正确的是()A.Fe分别与氯气和稀盐酸反应所得氯化物相同B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性C. Li、Na、K的原子半价和密度随原子序数的增加而增大D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强参考答案:D略7. 下列物质的制备方法正确的是A.氯化铝溶液和硫化钠溶液反应制备Al2S3B.用镁粉和空气反应制备Mg3N2C.用铝粉和MnO2制得锰D.用电解熔融氯化铝的方法制得单质铝参考答案:C略8. 下列关于洛哌丁胺的说法中,正确的是A. 能发生消去反应B. 不能发生水解反应C. 能与浓溴水发生取代反应D. 能与新制Cu(OH)2发生氧化反应参考答案:A略9. 有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)A.反应中,盐桥中的K+会移向CuSO4溶液B.取出盐桥后,电流计依然发生偏转C.铜片上有气泡逸出D.反应前后铜片质量不改变参考答案:A10. 下列表示对应化学反应的离子方程式正确的是()A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O B.5molFe和4molCl2反应:5Cl2+4Fe 2FeCl2+2FeCl3C.向Ca(ClO)2溶液中通入过量的 SO2:C1O-+SO2+H2O=HClO+HSO3-D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2=2Fe3++2OH-参考答案:A 【名师点晴】离子方程式正误判断是高考高频知识点,解这类题主要是从以下几个方面考虑:①反应原理,如:铁与盐酸或稀硫酸反应只生成二价铁;三氯化铝溶液与碳酸钠溶液混合发生的是双水解反应,而不是复分解反应;Mg2+遇OH-和CO32-时更宜生成的是Mg(OH)2沉淀等。
2021年江苏省无锡市第三高级中学高三化学联考试卷含解析

2021年江苏省无锡市第三高级中学高三化学联考试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. PX是纺织工业的基础原料,其结构简式为,下列关于PX的说法正确的是( ) A.属于饱和烃B.其一氯代物有四种C.可用于生产对苯二甲酸D.分子中所有原子都处于同一平面参考答案:C【分析】由结构可知,分子中含苯环,为平面结构,结构对称,只有2种H,甲基能被高锰酸钾氧化,以此来解答.【解答】解:A.含苯环,为不饱和烃,故A错误;B.结构对称,只有2种H,则其一氯代物有2种,故B错误;C.甲基能被高锰酸钾氧化,可用于生产对苯二甲酸,故C正确;D.苯环为平面结构,但甲基为四面体结构,则所有原子不可能共面,故D错误;故选C.【点评】本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意甲苯结构及性质分析,题目难度不大.2. 两种气体a和b分别为0.6mol和0.5mol,在容积为0.4L的密闭容器中发生反应:3A+B mC+2Z , 5分钟后,C变为0.2mol。
又知在此反应时间内V Z=0.1mol/(L·min),则m 的值为A. 2B. 1C. 4D. 3参考答案:A 3. 弱酸酸式盐的酸根离子电离和水解并存,已知HSO—3电离大子水解。
以NaHXO3表示NaHCO3和NaHSO3。
对于NaHCO3和NaHSO3溶液,下列关系式中不正确的是A.C(Na+)+C(H+)==C(OH—)+C(HXO3—)+2C(XO32—)B.C(Na+)=C(HXO3—)+C(H2XO3)+C(XO32—)C.C(Na+)>C(HXO3—)>C(H+)>C(OH—)D.C(OH—)==C(H+)+C(H2XO3)—C(XO32—)参考答案:C略4. 工业上生产MnO2和Zn的主要反应有:①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O②MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4下列说法不正确的是A.①中MnO2和H2SO4都是氧化剂 B.①中析出16 g S时转移l mol电子C.②中MnSO4发生氧化反应 D.硫酸在该生产中可循环利用参考答案:A略5. 下列各组中的两种物质相互作用时,改变反应条件或反应物的用量,不会影响产物组成的是A.Na与O2 B.NaOH与CO2 C.Na2O2与CO2 D.Na2CO3与HCl ()参考答案:C略6.含有a mol FeBr2的溶液中,通入x mol Cl2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.下列说法正确的是()A.共价化合物的熔沸点都比较低B.、、三种核素可组成3种水分子C.H2O分子比H2S分子稳定的原因,是H2O分子间存在氢键D.SiO2和CaCO3在高温下反应生成CO2气体,说明硅酸的酸性比碳酸强2.短周期元素X.Y.Z.W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。
下列判断不正确的是()A.四种元素的单质中,X的熔沸点最低B.最高价氧化物对应水化物的酸性W比Z强C.X的气态氢化物的稳定性较Z的弱D.原子半径:Y>Z>W>X3.下列有关实验正确的是A.装置用于Na2SO3和浓H2SO4反应制取少量的SO2气体B.装置用于灼烧CuSO4·5H2OC.装置用于收集氯气并防止污染空气D.装置用于实验室制备少量乙酸乙酯4.氰气[(CN)2]性质与卤素相似,分子中4个原子处于同一直线.下列叙述正确的是()A.是极性分子B.键长:N≡C大于C≡CC.CN﹣的电子式:D.和烯烃一样能发生加成反应5.下列有关浓硫酸和浓盐酸的说法错误的是()A.浓硫酸、浓盐酸都是无色液体B.铁片加入浓硫酸中无明显现象,加入浓盐酸中有大量气泡产生C.将两种酸分别滴到 pH 试纸上,试纸最终均呈红色D.将蘸有浓氨水的玻璃棒靠近浓盐酸有白烟,靠近浓硫酸没有白烟6.测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的实验方案不合理的是A.取ag混合物用酒精灯充分加热后质量减少bgB.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加bgC.取ag混合物于锥形瓶中加水溶解,滴入1~2滴甲基橙指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmLD.取ag混合物于锥形瓶中加水溶解,滴入1~2滴酚酞指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL7.异戊烷的A.沸点比正己烷高B.密度比水大C.同分异构体比C5H10多D.碳碳键键长比苯的碳碳键长8.下列物质的分离方法中,利用粒子大小差异的是A.过滤豆浆B.酿酒蒸馏C.精油萃取D.海水晒盐A.A B.B C.C D.D9.下列实验操作、现象和结论均正确的是()选项实验现象结论A 植物油和溴水混合后振荡、静置溶液分层,溴水褪色植物油萃取了溴水中的Br2将Cl2通入滴有酚酞NaOH的溶B褪色Cl2具有漂白性液生成的Ca(HCO3)2可溶于C 将过量的CO2通入CaCl2溶液无白色沉淀生成水D 将浓硫酸滴到胆矾晶体上晶体逐渐变白色浓硫酸的吸水性A.A B.B C.C D.D10.从化学的规角分析,下列说法不正确的是A.锂离子电池是一种生活中常用的化学电源B.纳米材料可用于制造不用洗的衣服面料C.水中加入“催化剂”,可变成汽车燃料“油”D.科学家未研发出只加水就能跑的“水氢发动机”汽车11.延庆区的三张名片:长城、世园会、冬奥会中所使用的材料属于无机非金属材料的是A.京张高铁的复兴号火车“龙凤呈祥”内装使用材料FRPB.中国馆屋顶ETFE保温内膜C.八达岭长城城砖D.2022年冬奥会高山滑雪服12.正确的实验操作是实验成功的重要因素,下列实验操作正确的是( )A.称取一定量的NaClB.制备氢氧化亚铁并观察其颜色C.检验浓硫酸与铜反应后的产物中是否含有铜离子D.收集NO2并防止其污染环境13.2013年浙江大学以石墨烯为原料研制的“碳海绵”是一种气凝胶,它是处理海上原油泄漏最好的材料:它能把漏油迅速吸进来,吸进的油又能挤出来回收,碳海绵还可以重新使用,下列有关“碳海绵”的说法中错误的是A.对有机溶剂有很强的吸附性B.内部应有很多孔隙,充满空气C.有很强的弹性D.密度较大,化学性质稳定14.苯乙酮常温下为无色晶体或浅黄色油状液体,是山楂、含羞草、紫丁香等香精的调合原料,并广泛用于皂用香精和烟草香精中,可由苯经下述反应制备:+(CH 3CO)2O 3AlCl −−−→ +CH 3COOHN A 代表阿伏加德罗常数的值。
下列有关说法正确的是A .气态苯乙酮的密度是气态乙酸密度的2倍B .1mol 苯所含的化学单键数目为12 N AC .0.5mol 乙酸酐中含有的电子数目为27 N AD .1L2mol/LCH 3COOH 溶液与足量钠反应生成的气体分子数为N A15.在25℃时,向50.00mL 未知浓度的氨水中逐滴加入0.5mol·L -1的HC1溶液。
滴定过程中,溶液的pOH[pOH=-lgc(OH -)]与滴入HCl 溶液体积的关系如图所示,则下列说法中正确的是A .图中②点所示溶液的导电能力弱于①点B .③点处水电离出的c(H +)=1×10-8mol·L -1C .图中点①所示溶液中,c(C1-)>c(NH 4+)>c(OH -)>c(H +)D .25℃时氨水的K b 约为5×10-5.6mo1·L -1二、实验题(本题包括1个小题,共10分)16.ZnSO 4∙7H 2O 可用于测定钢铁及炉渣的含硫量。
某工厂下脚料中含锌、镉(Cd)、铜、铁等金属,以该下脚料为原料制备ZnSO 4∙7H 2O 并回收Cu 、Cd 的工艺流程如图所示:已知部分氢氧化物开始及完全沉淀的pH 如表所示(起始时金属离子浓度按0.1mol∙L -1计算): 氢氧化物 Fe(OH)3 Cd(OH)2 Zn(OH)2开始沉淀的 pH 1.9 7.46.2完全沉淀的 pH3.2 9.5 8.2请回答下列问题:(1)滤渣1中含有_______(填化学式)。
(2)试剂X 是双氧水时,写岀氧化过程中发生反应的离子方程式_______。
(3)pH的调控范围是_______,试剂Y可选用_______(填字母)A.NaOH B.ZnO C.ZnCO3(4)电解时以汞(Hg)作电极可以将镉与锌完全分离,镉单质在_______(填“阴”或“阳”)极析出,阳极的电极反应式为_______。
(5)操作I包括的操作是_______及过滤等,过滤后得到的滤液可以加入_______ (填“酸浸”或“氧化”)步骤循环利用。
三、推断题(本题包括1个小题,共10分)17.G是一种神经保护剂的中间体,某种合成路线如下:根据上述转化关系,回答下列问题:(1)芳香族化合物A的名称是___。
(2)D中所含官能团的名称是____。
(3)B—C的反应方程式为____。
(4)F—G的反应类型___。
(5)G的同分异构体能同时满足下列条件的共有____种(不含立体异构);①芳香族化合物②能发生银镜反应,且只有一种官能团,其中,核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:3的是__(写出一种结构简式)。
(6)参照上述合成路线,写出以和BrCH2COOC2H5为原料(无机试剂任选),制备的合成路线____________。
四、综合题(本题包括2个小题,共20分)18.磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质。
工业上以磷矿石为原料制备H3PO4,一种生产流程如下:已知:Ca5F(PO4)3 + 7H3PO4→5Ca(H2PO4)2 + HF38、写出有关操作的名称:Ⅰ___________、Ⅲ_________。
工艺流程中设计操作Ⅱ与Ⅲ的目的是__________________________________。
39、若在实验室里采用此种方法溶解磷矿石,请写出必须的实验注意事项,并说明理由:_____________。
40、磷矿石也可直接用硫酸溶解,两种工艺相比,该工艺的优点是____________________。
41、测定产品磷酸的浓度可采用滴定法。
准确量取10.00 mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103 mol/L标准NaOH溶液滴定;当观察到溶液恰好变色,且在半分钟内不变色,即为滴定终点(生成NaH2PO4),消耗标准溶液20.16 mL。
该实验过程中需要的定量仪器有______________________________(写名称)。
42、若理论上滴定应耗用标准溶液20.20 mL,则相对误差为______________(按近似计算法则)。
该产品中磷酸的质量分数为_____________(保留3位小数)。
19.(6分)CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:(1)CO2可以被NaOH溶液捕获。
若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。
(室温下,H2CO3的K a1=4.3×10﹣7;K a2=5.6×10﹣11)(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。
写出电极A发生的电极反应式___。
(二)CO2的综合利用(1)CO2与CH4经催化重整制得合成气:反应Ⅰ.CH4(g)H+CO2(g)⇌2CO(g)+2H2(g)△H1已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示物质H2(g)CO(g)CH4(g)标准燃烧热△H/kJ•mol﹣﹣285.8 ﹣283.0 ﹣890.31则反应I的△H=___kJ•mol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g),在10L 恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是CeC.状态d时,v(正)<v(逆)D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。
_______参考答案一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.B【解析】A.共价化合物可能是分子晶体,也可能是原子晶体,则熔沸点不一定都较低,故A错误;B.根据排列组合,、、三种核素可组成3种不同的水分子,故B正确;C.氢键是分子间作用力,只影响物理性质不影响化学性质,H2O分子比H2S分子稳定的原因,是H2O分子H—O的键能大的缘故,故C错误;D.高温下SiO2能与CaCO3固体反应生成CaSiO3和CO2,不是在常温下进行,且不是在水溶液中进行,不能说明硅酸的酸性强于碳酸,故D错误;答案为B。
