九上化知识点34单元
科粤版九年级化学上册第三章单元复习课件(共55张PPT)

23
精要回放(三)
读法:由两种元素组成的化合物读作__ __某__化__某_________, 有时还需读出_化__学__式__中_各_ _元__素_的__原__子__个__数__, 含有酸根的读作 ____某_酸__某_____,含有氢氧根的读作______氢__氧__化__某_______ 化 学 式 计算[以Ca(OH)2为例]:相对分子质量为___7_4____;钙、 氧两种元素的质量比为___5_∶__4__;钙元素的质量分数为 ____5_4_._1_%_______
⑥ 发出白光,
放出热量
⑨
石蜡+氧气―点―燃→二氧化碳+水
6
精要回放(三)
[注意] 在做铁丝在氧气中燃烧的实验时,集气瓶底部应预先 __装__少_量__水___或__铺_一__层_细__沙____,这样做是为了 _防__止_反__应_生__成_的__高__温_熔__融_物__溅__落_瓶__底_,__使__集_气__瓶_炸__裂_______。 可见, 氧气的化学性质_____比_较__活_泼_______,在一定条件下能和多种 物质发生化学反应。
学 式
②____二__氧__化_碳__由__碳__元__素__和__氧_元__素__组__成_________________
③____1_个__二__氧__化_碳__分__子_____________________________
④____1_个_二__氧__化__碳__分__子_由__1_个__碳__原__子__和_2_个__氧__原__子__构__成_____
16
精要回放(三)
五、燃烧 1.燃烧条件 燃烧需要具备三个缺一不可的条件:物质本身是可燃物、 _温__度_达__到__可_燃__物_的__着__火_点___和___可__燃_物__接_触__氧_气__(_或_空__气__)______。
九年级上册化学第四单元知识点

九年级上册化学第四单元知识点
九年级上册化学第四单元主要包括以下知识点:
1. 锐式和钝式晶体:讲述了晶体的构成和晶体形态,介绍了锐式和钝式晶体的区别,并举例说明。
2. 晶体的晶格和晶面:介绍了晶格和晶面的概念,讲解了晶格和晶面的关系,并讨论了晶面的性质和分类方法。
3. 晶体的晶体系和晶体面指数:介绍了晶体系的概念和分类方法,讨论了各种晶体系的特点和晶体面指数的表示方法。
4. 晶体的物理性质:介绍了晶体的物理性质,包括透明性、硬度、断裂等,并解释了这些性质与晶体的内部结构之间的关系。
5. 晶体的化学性质:讨论了晶体的化学性质,包括溶解性、腐蚀性等,并解释了这些性质与晶体的化学组成之间的关系。
6. 晶体的应用:介绍了晶体在科学技术和日常生活中的广泛应用,包括电子元件、光电子器件、化学传感器等。
以上是九年级上册化学第四单元的主要知识点,希望能帮助到你。
如有其他问题,请继续提问。
人教版九年级上册化学第一单元知识点总结

第一单元走进化学世界课题一物质的变化和性质第一课时物质的变化一、物理变化1、概念:没有生成其他物质的变化。
2. 特征:没有其他物质生成。
3.伴随现象:形状,状态的改变二、化学变化1、概念:生成其他物质的变化。
2、特征:有其他物质生成。
3、伴随现象:发光、发热、颜色改变、放出气体、生成沉淀;常伴随能量变化。
、生成沉淀,放出气体,颜色改变,发光,放热等现象经常用于判断是否为化学反应。
(但不是绝对的,爆炸和发光不一定是化学变化可以说明)2、两者的本质区别是:有无其他物质生成。
3、两者之间的联系:化学变化中一定伴随物理变化,但物理变化中不一定伴随化学变化。
(蜡烛的燃烧现象可以说明)第二课时物质的性质一、物理性质1、概念:不需要发生化学变化就表现出来的性质。
2、如:颜色、状态、气味、熔点、沸点、密度、硬度、溶解性、导电性、挥发性等。
(可归纳为:色味态、两度、两点、三性)二、化学性质1、概念:需要在化学变化中表现出来的性质。
2、如:可燃性、助燃性、氧化性、还原性、腐蚀性、酸碱性、毒性、稳定性等。
三、注意事项1、性质与变化的区别:一般描述物质性质的语言中有“可、易、能、会、难”等字,叙述物质的变化往往用“已经”、“了”、等过去时或“在”等现在时等表示时态的用语。
如酒精燃烧、酒精能燃烧。
(即能力和动作的区别)2、氧气(O2)和二氧化碳(CO2)的鉴别方法有哪些?答:方法一:二氧化碳(CO2)能使燃着的木条熄灭,氧气能使燃着的木条燃烧更旺;方法二:二氧化碳(CO2)能使带火星的木条熄灭,氧气能使带火星的木条复燃。
方法三:二氧化碳(CO2)能使澄清石灰水变浑浊,氧气不能。
课题二化学是一门以实验为基础的科学通过学习课题二我们获得的知识:1、二氧化碳可以使澄清石灰水变浑浊;2、氧气可使带火星的木条复燃(注意:不是有氧气就可以,空气中也有氧气);3、二氧化碳可以使燃着的木条熄灭;4、空气主要由氮气、氧气组成,还含有二氧化碳、水蒸气等;5、吸入的空气中含有较多的氧气,人体呼出的气体中含有较多的二氧化碳和水;6、蜡烛燃烧的产物是水和二氧化碳;7、科学探究是基本步骤:提出问题---猜想假设---制定方案---科学实验---分析论证---得出结论、交流讨论。
人教版新目标英语九年级全册单元知识点及配套练习

人教版新目标英语九年级全册单元知识点及配套练习九年级英语单元知识Unit 12、动词现在分词和不定式可作主语,表单数3、介词后面的动词形式(~ing);4、What about+~ing;How about+~ing;5、too+形(副)+to(不定式);6、find+宾语+宾语补足语;7、not…at all一点也不;8、get+形容词;11、instead/instead of;12、listen to13、ask(sb.)for(sth.);14、for example;15、have fun(doing sth.)16、end up(with…)17、spoken English;English—speaking people(countries)18、make mistakes 19.talk to(with) sb.20、why don’t you(we,they )+动词原形?=why not+动词原形?21、laugh at22、first of all23、to begin with.24、later on25、be afraid of sth.(doing)be afraid to do sth.be afraid that从句26、in class/out of class /after class27、take notes30、have trouble doing sth.31、look up32、make up a conversation.33、around the world.34、deal with35、stay(keep)+形容词36、go by37、decide(not)to do sth.40、complain about sth.41、compare sth to sth.(把…比作…);compare sth with sth.(把…与…进行比较)42、43、break off45、study for a test50、find sb./sth.+宾语补足语;find it +宾语补足语+(for sb.)to do sth.51、try one's best (to do sth.)52、with the help of sb=with one's help53、much tootoo muchUnit 21、过去常做某事:主语used to(不定式)be used to(介词)be used to(不定式)be used for sth.(doing)2、not…any more→no more;not…any longer→no longer5、复合词:a fifteen-year-old boy6、对某人而言做某事是…的:It's(形容词)for sb. to do sth.7、be able to do sth.8、give up(+ ~ing)9、afford sth.(to do sth.)10、be interested in sth.(doing.sth.)11、in front of…in the front of…12、be terrified ofbe afraid of13、go to bed(sleep)14、on the soccer team15、worry about sb.(sth.)be worried about…worry that从句16、all the time17、take a bus to(某地) = go to(某地)by bus 20、spend+time(money) on sth/(in)doing sth.)It takes(took)sb.+时间+to do sth.物cost(某人)+钱人 pay 钱 for 物。
人教版九年级英语上册各单元知识点总结

Unit1 How can we become good learners?【短语归纳】【短语归纳】1. have conversation with sb. 同某人谈话同某人谈话2. too…to… 太……而不能而不能3. the secret to… ……的秘诀的秘诀4. be afraid of doing sth./ be afraid to do sth. 害怕做某事害怕做某事5. look up 查阅查阅6. repeat out loud 大声跟读大声跟读7. make mistakes in 在……方面犯错误方面犯错误8. connect ……with… 把……和……连接/联系起来联系起来 9. get bored 感到厌烦感到厌烦10. be stressed out 焦虑不安的焦虑不安的11. pay attention to 注意;关注注意;关注12. depend on 取决于;依靠取决于;依靠13. the ability to do sth.. 做某事的能力做某事的能力【单元知识点】【单元知识点】1. by + doing :通过……方式方式(by 是介词,后面要跟动名词,也就是动词的ing 形式)形式)2. talk about 谈论,议论,讨论谈论,议论,讨论The students often talk about movie after class. 学生们常常在课后讨论电影。
讨论电影。
talk to sb= talk with sb 与某人说话与某人说话3. 提建议的句子:提建议的句子:①What/ how about +doing sth.? 做…怎么样?(about 后面要用动词的ing 形式,这一点考试考的比较多)形式,这一点考试考的比较多)如:What/ How about going shopping?②Why don't you + do sth.? 你为什么不做…?(注意加黑的部分用的是动词的原型)分用的是动词的原型)如:Why don't you go shopping?③Why not + do sth. ? 为什么不做…?(注意加黑的部分用的是动词的原型)是动词的原型)如:Why not go shopping?④Let's + do sth. 让我们做…吧。
化学九年级上册第四单元

化学九年级上册第四单元化学九年级上册第四单元,主要涉及到反应与化学方程,我们将讨论以下内容:一、化学反应与物质转化1.化学反应的定义:化学反应是指物质之间发生的原子核、电子互相重新组合的过程。
2.物质转化的证据:物质变色、发出气体、产生光、放出热量等。
3.物质的转化过程:单向过程和逆向反应,化学反应是可逆反应的一种。
4.物质转化的速度:影响物质转化的因素有温度、浓度、物质状态等。
5.化学平衡:在闭合系统中,反应物和生成物浓度达到一定比例时,化学反应达到了平衡状态。
二、化学方程式1.化学方程的定义:用化学符号和化学式表示化学反应过程。
2.反应物与生成物:化学方程中反应物写在反箭头的左边,生成物写在反箭头的右边。
3.反应物和生成物的表示方法:分子式、离子式、化学式等。
4.化学方程的平衡:平衡标准和平衡常数的概念。
5.满足质量守恒和电荷守恒:左右原子数和电荷数相等。
三、化学方程的平衡1.方程的平衡法则:化学方程中不平衡的原子种类、原子个数要相等。
2.平衡方程的调整方法:可以通过改变系数来平衡方程。
3.化学方程的平衡条件:反应物和生成物的摩尔比相等。
四、化学方程式的计算1.摩尔比和质量比的计算:根据化学方程式中的物质的摩尔数来计算其质量比。
2.质量比和体积比的计算:根据化学方程式中反应物和生成物的物质的质量来计算质量比和体积比。
3.化学方程中有限性原理:根据有限性原理来计算实际物质转化的量。
五、化学方程式的应用1.计算反应物和生成物的量:根据化学方程式中反应物的量来计算生成物的量。
2.预测反应的进行程度:根据平衡常数来预测反应的进行程度。
3.反应温度和浓度对反应速度的影响:根据反应速度和温度、浓度的关系来分析反应过程。
以上只是化学九年级上册第四单元的一些内容,希望对你有所帮助。
人教版九年级化学上册 第三单元:《物质构成的奥秘》知识点总结
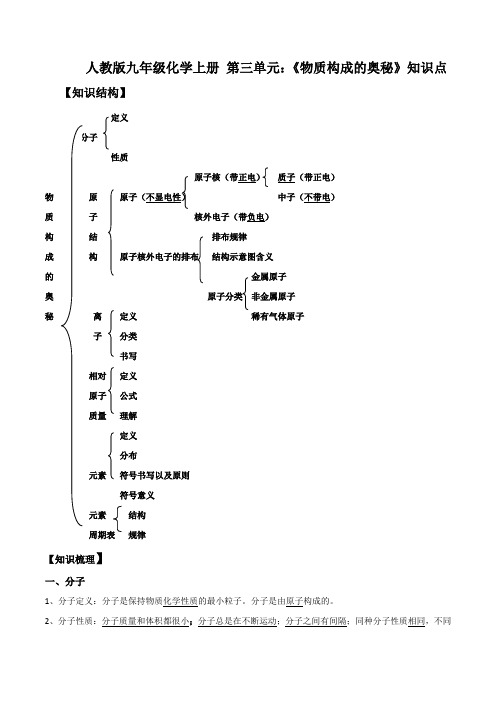
人教版九年级化学上册第三单元:《物质构成的奥秘》知识点【知识结构】定义性质原子核(带正电)质子(带正电)物原中子(不带电)质子核外电子(带负电)构结排布规律成构结构示意图含义的金属原子奥非金属原子秘离定义稀有气体原子子分类书写相对定义原子公式质量理解定义分布元素符号书写以及原则符号意义元素结构规律【知识梳理】一、分子1、分子定义:分子是保持物质化学性质的最小粒子。
分子是由原子构成的。
2、分子性质:分子质量和体积都很小;分子总是在不断运动;分子之间有间隔;同种分子性质相同,不同种分子性质不同。
3、物理变化:分子本身没有发生变化,分子的化学性质不变。
化学变化:分子本身发生变化,生成了新的分子,不再保持原分子的化学性质。
典例1 建立宏观和微观之间的联系对学习化学十分重要。
下列宏观事实的微观解释错误的是()A.品红在水中扩散﹣﹣分子在不断运动B.水蒸发由液态变成气态﹣﹣水分子发生改变C.NO与NO2化学性质不同﹣﹣构成物质的分子不同D.10mL H2O与10mL C2H5OH混合后体积小于20mL﹣﹣分子间有间隔【答案】B【解析】A、品红在水中扩散,是因为品红分子是在不断的运动的,运动到水分子中间去了,故选项解释正确。
B、水蒸发由液态变成气态,是因为水分子间的间隔发生了改变,故选项解释错误。
C、NO与NO2化学性质不同,是因为它们分子的构成不同,不同种的分子化学性质不同,故选项解释正确。
D、10mL H2O与10mL C2H5OH混合后体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释正确。
故选:B。
典例2下列关于分子和原子的说法,错误的是()A.分子和原子都可以构成物质B.由分子构成的物质,分子是保持其化学性质的最小粒子C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小【答案】D【解析】A、分子、原子和离子都是构成物质的微粒,故A正确;B、由分子构成的物质,分子是保持其化学性质的最小微粒,故B正确;C、在化学变化中,分子分成原子,原子再重新结合成新的分子,原子是在化学变化中不能再分的最小微粒,故正确.D、分子和原子之间都有间隔,分子之间的间隔不一定比原子间的间隔大,故D错误;故选D。
九上化学四单元笔记

九年级上册化学四单元笔记
九年级上册化学第四单元的笔记主要包括以下内容:
一、基本概念和原理
原子和分子的概念:原子是化学变化中的最小粒子,分子是保持化学性质的最小粒子。
原子的构成:原子由原子核和核外电子构成,原子核由质子和中子构成。
化学键的概念:原子或离子之间通过相互作用形成的强烈连接。
化合价的概念:元素的原子在化学反应中得失电子的数量。
二、化学式和化合价
化学式的概念和书写规则。
化合价的计算方法。
化合价的规律和影响因素。
化学式的配平方法。
三、化学反应方程式
化学反应方程式的概念和书写规则。
化学反应方程式的计算方法。
化学反应方程式的配平方法。
化学反应方程式的应用。
四、实验操作和技能
实验基本操作技能,如取用固体、液体药品的方法,加热操作等。
实验方案的设计和实施,如用双氧水制取氧气,用高锰酸钾制取氧气等。
实验安全注意事项,如防止爆炸、烫伤、中毒等。
五、重要知识点和难点
原子和分子的概念及构成。
化合价的概念和计算方法。
化学反应方程式的书写规则和配平方法。
实验操作技能和安全注意事项。
六、易错点和难点突破
区分分子、原子、离子的概念和区别。
熟悉常见元素的化合价和化合物的化学式书写规则。
掌握化学反应方程式的计算方法和配平技巧。
加强实验操作技能的训练和安全意识的提高。
以上是九年级上册化学第四单元的主要内容,通过学习这些内容,可以帮助学生掌握化学基础知识,提高实验操作技能和解决问题的能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级上册化学三、四单元知识点
一、分子和原子
1、物质的构成:物质是由微观粒子构成的(举例:糖放入水中会消失,但水会变甜)。
这些粒子包括原子、分子、离子。
2、微观粒子的特性:①微观粒子的质量和体积都很小。
②微观粒子都在不停的运动。
(举例:气味的扩散、水的蒸发)③微观粒子间都存在间隙。
以下涉及到的微粒都以分子来举例
3、分子的运动:分子运动的快慢与温度有关。
温度越高分子运动越快。
(举例:给水加热时水蒸发加快)
4、分子间的间隙:①分子间存在间隙。
②分子间的间隙大小与物质状态有关——一般情而言“固态>液态>气态”(水是个特例,水由液态变为固态的冰后,体积会增大。
既水中分子间的间隙小于冰中分子间的间隙)③分子间的间隙随温度的改变而改变——温度升高,分子间的间隙变大;温度降低,分子间的间隙变小,于是我们就看到了物体的热胀冷缩现象(由此我们可以得出,物体热胀冷缩只是由于分子的间隙改变了,分子本身大小没有改变)
5、分子:分子由原子构成;由分子构成的物质,分子是保持其化学性质的最小粒子。
同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
(注意:分子只能保持物质的化学性质,但不能保持物质的物理性质)
6、原子:原子是化学变化中的最小粒子(既:化学变化中分子的种类会发生变化,原子的种类不会发生变化。
分子和原子
性质 体积小、质量小;不断运动;有间隙
联系 分子是由原子构成的。
分子、原子都是构成物质的微粒。
区别
化学变化中,分子可分,原子不可分。
7、化学变化的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
)
二、原子的结构
1、原子的组成:
质子:一个质子带一个单位的正电荷
中子:不带电
电子:一个电子带一个单位的负电荷 2、原子的特性
① 原子的带电情况:原子核所带电量数称为核电荷数,由于原子核所带电量和核外电子的电量相等,但电性相反,因此原子不显电性。
由此得出——核电荷数=质子数=核外电子数 ②原子核内的质子数不一定等于中子数。
③原子的种类是由质子数决定的。
④原子核只占原子体积的很小一部分,原子内相对有一个很大的空间,电子在这个空间里作高速运动。
⑤原子的重量主要集中在原子核上。
电子的重量可以忽略不计。
3、电子层:核外电子与原子核的距离有远有近,我们根据远近的不同将核外电子分为若干个电子层。
距核由近到远称为第一层、第二层……。
我们将核外电子的这种分布称为分层排布。
1—20号元素,第一层最多能排2个电子,其它各层最多能排8个电子。
4、最外层电子数与化学性质的关系:①稀有气体元素最外层电子数一般为8个(氦为2),我们称之为
原子核
原子 注意:原子核中一定含有质
子,但不一定含有中子。
如有一种氢原子的原子核中就只有质子没有中子。
相对稳的结构。
拥有该结构的原子化学性质稳定,不易与其它物质发生反应。
②金属的原子最外层电子数一般都少于四个,化学性质活泼,容易与其它物质发生反应,且反应中容易失去电子。
③非金属的原子最外层电子数一般都多于四个,化学性质也活泼,也容易与其它物质发生反应,且反应中容易得到电子。
5、离子:原子在化学反应中失去或得到电子后形成了带电的原子。
我们将这种带电的原子叫做离子。
带正电的叫阳离子(如Na +),带负电的叫阴离子(如Cl -
)。
6、离子符号表示的意义:
Mg 2+——表示镁离子/一个镁离子“2+”表示每个镁离子带两个单位的正电荷 2Mg 2+ 表示2个镁离子
7、离子符号的写法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。
离子带1个单位的正电荷或个单位的负电荷,“1”省略不写。
如Na +、Cl -等。
8、原子变为离子过程的表述:
在反应中容易失去2个电子,形 在反应中容易得到1个电子,形成 成带2个单位正电荷的阳离子。
带1个单位正电荷的阴离子。
9、原子、离子的区别:
10、相对原子质量:相对原子质量并不是原子的真正质量,而是与碳12原子的质量的1/12的比值。
11、相对原子质量的计算方法:该原子的真正质量÷碳12原子的真正质量×1/12 12、相对原子质量≈质子数 + 中子数。
电子的质量可以忽略不计!
三、元素
粒子的种类 原 子 离 子
阳离子 阴离子 区 别
结构 核电荷数=电子数
核电荷数>电子数 核电荷数<电子数
电性 不显电性 显正电性 显负电性 符号
用元素符号表示
用阳离子符号表示
用阴离子符号表示
8 +12
2 2
8 +17
2 7。
