盐析法沉淀蛋白质的原理
盐析法沉淀蛋白质的原理

盐析法沉淀蛋白质的原理是
A.改变蛋白质的一级结构
B.破坏空间结构
C.使蛋白质的等电点发生变化
D.中和蛋白质表面电荷并破坏水化膜
E.使蛋白质变性正确答案:D 解析:盐析法沉淀蛋白质即向蛋白质溶液中加入中性盐(如氯化钠,硫酸铵等),破坏蛋白质的亲水胶体的稳定性,从而使蛋白质沉淀。
蛋白质亲水胶体的两个稳定因素是蛋白质颗粒表面的水化膜和表面电荷。
中性盐可中和其表面电荷,破坏水化膜。
沉淀蛋白质不变性是盐析的特点之一,盐析法最常用于蛋白质沉淀。
所以此答案为D
蛋白质在水溶液中的溶解度取决于蛋白质周围亲水基团与水和蛋白质分子上的电荷形成水合膜的程度。
当蛋白质溶液中加入中性盐时,中性盐与水分子的亲和力强于蛋白质,因此蛋白质分子周围的水合膜减弱甚至消失。
同时,在蛋白质溶液中加入中性盐后,由于离子强度的变化,蛋白质的表面电荷大大中和,导致蛋白质溶解度降低,蛋白质分子聚集。
盐析分离蛋白的原理是

盐析分离蛋白的原理是
盐析分离也被称为离子交换沉淀,是一种常用的蛋白分离技术。
其基本原理是利用盐浓度的变化来控制蛋白质的溶解度,从而使蛋白质沉淀或溶解。
在盐析分离过程中,首先将蛋白质溶解在稀缩的缓冲溶液中,再逐渐加入盐类溶液。
随着盐浓度的增加,盐离子与蛋白质分子之间的静电吸引力逐渐增强,使蛋白质的溶解度降低。
当盐浓度逐渐达到某一临界点时,蛋白质在溶液中形成团聚或沉淀。
蛋白质的溶解度受多种因素影响,包括盐类浓度、蛋白质的电荷、pH值、温度等。
通过调节这些因素,可以实现对蛋白质的选择性分离。
盐析分离的原理基于蛋白质的溶解度在不同盐浓度条件下的差异,可用于蛋白质的粗提或部分纯化。
蛋白质盐析的原理

蛋白质盐析的原理蛋白质盐析是一种常用的蛋白质纯化方法,它利用蛋白质在高盐浓度下沉淀的特性来实现对蛋白质的分离和纯化。
在盐析过程中,蛋白质的溶解度会随着盐浓度的增加而减小,从而导致蛋白质的沉淀。
本文将介绍蛋白质盐析的原理及其在蛋白质纯化中的应用。
蛋白质的盐析是基于蛋白质在高盐浓度下的溶解度变化而实现的。
通常情况下,蛋白质在低盐浓度下是易溶的,但随着盐浓度的增加,蛋白质的溶解度会逐渐减小,最终在高盐浓度下发生沉淀。
这是因为盐离子与蛋白质分子之间的相互作用会影响蛋白质的构象和溶解度,从而导致蛋白质的沉淀。
在实际应用中,蛋白质盐析通常是在较低的pH值和高盐浓度下进行的。
这样可以最大限度地提高蛋白质的溶解度,促使蛋白质在高盐浓度下沉淀。
一般来说,选择合适的盐和盐浓度是非常重要的,不同的蛋白质可能对盐的种类和浓度有不同的要求,需要进行实验优化。
蛋白质盐析在蛋白质纯化中具有广泛的应用。
它可以用于蛋白质的初步分离和富集,也可以用于去除杂质和其他蛋白质。
在蛋白质纯化流程中,盐析常常是作为其他分离技术的预处理步骤,能够有效地提高后续纯化步骤的效率和纯度。
除了以上介绍的基本原理和应用外,蛋白质盐析还有一些注意事项和优化策略。
例如,在进行盐析实验时,需要注意控制盐的加入速度和均匀性,避免对蛋白质产生不可逆的影响。
此外,还需要考虑蛋白质的稳定性和溶解度,选择合适的缓冲液和条件进行盐析实验。
总之,蛋白质盐析是一种简单而有效的蛋白质纯化方法,它利用蛋白质在高盐浓度下的溶解度变化来实现对蛋白质的分离和纯化。
在实际应用中,需要根据具体的蛋白质特性和实验条件进行优化,以获得最佳的分离效果。
希望本文的介绍能够对蛋白质盐析的原理和应用有所帮助。
盐析法沉淀蛋白质的原理

1.盐析法沉淀蛋白质的定义
蛋白质在水溶液中的溶解度是由蛋白质周围亲水基团与水形成水化膜的程度,以及蛋白质分子带有电荷的情况决定的。
当用中性盐加入蛋白质溶液,中性盐对水分子的亲和力大于蛋白质,于是蛋白质分子周围的水化膜层减弱乃至消失。
同时,中性盐加入蛋白质溶液后,由于离子强度发生改变,蛋白质表面电荷大量被中和,更加导致蛋白溶解度降低,使蛋白质分子之间聚集而沉淀。
这也就是我们所说的盐析,具体而言,指的就是蛋白质水溶液中加入中性盐,随着盐浓度增大而使蛋白质沉淀出来的现象。
中性盐是强电解质,溶解度又大,在蛋白质溶液中,一方面与蛋白质争夺水分子,破坏蛋白质胶体颗粒表面的水膜;另一方面又大量中和蛋白质颗粒上的电荷,从而使水中蛋白质颗粒积聚而沉淀析出。
2. 盐析法沉淀蛋白质的原理一:破坏了水化层
在高浓度的中性盐溶液中,由于盐离子亲水性比蛋白质强,与蛋白质胶粒争夺与水结合,破坏了蛋白质的水化层。
在高浓度的中性盐溶液中,由于蛋白质和盐离子对溶液中水分子都有吸引力,产生与水化合现象,但它们之间有竞争作用,当大量中性盐加入时,使得盐解离产生的离子争夺了溶液中大部分自由水,从而破坏蛋白质的水化作用,引起蛋白质溶解度降低,故从溶液中沉淀出来。
3.盐析法沉淀蛋白质的原理二:破坏了电荷
由于盐是强电解质,解离作用强,盐的解离可抑制蛋白质弱电解质的解离,使蛋白质带电荷减少,更容易聚集析出。
4.盐析法的应用:
盐析法简单方便,可用于蛋白质抗原的粗提、丙种球蛋白的提取、蛋白质的浓缩等。
盐析法提纯的抗原浓度不高,只用于抗原的初步纯化。
蛋白质盐析的原理和影响因素

蛋白质盐析的原理和影响因素蛋白质盐析是一种常用的蛋白质纯化方法,它基于溶液中添加高浓度的盐类,使蛋白质发生沉淀而分离出来的原理。
蛋白质盐析的效果受多种因素的影响,包括盐浓度、溶液pH值、温度等。
蛋白质盐析的原理是利用盐对蛋白质溶液的离子强度的影响,使蛋白质发生沉淀从而分离出来。
在溶液中,蛋白质通常呈现带电状态,正负电荷的相互作用使蛋白质分散均匀。
当盐浓度增加时,盐中的离子与蛋白质分子间发生竞争作用,将溶液中的水分子聚集在一起形成水合层,蛋白质间的静电相互作用减弱,从而导致蛋白质发生沉淀。
影响蛋白质盐析效果的主要因素之一是盐的类型和浓度。
一般来说,常用的盐类有氯化铵、硫酸铵、硫酸钠等。
不同的盐对蛋白质的沉淀效果有差异,一般而言,盐的离子强度越大,蛋白质的沉淀效果越好。
此外,盐的浓度也会影响蛋白质的盐析效果,过高或过低的盐浓度都会导致蛋白质的沉淀效果不理想。
溶液的pH值也是影响蛋白质盐析的重要因素之一。
蛋白质的带电性质与溶液的pH值密切相关,当溶液的pH值与蛋白质的等电点接近时,蛋白质的沉淀效果最佳。
如果溶液的pH值偏离蛋白质的等电点,蛋白质的沉淀效果将受到影响。
温度也会对蛋白质盐析的效果产生影响。
一般来说,较低的温度有利于蛋白质的沉淀,因为低温可以减弱蛋白质分子间的热运动,增加静电相互作用的机会。
但是,过低的温度也会导致溶解度降低,从而影响蛋白质的盐析效果。
蛋白质本身的性质也会对盐析效果产生影响。
不同的蛋白质具有不同的等电点、溶解度和聚集特性,因此对于不同的蛋白质,选择合适的盐析条件是非常重要的。
蛋白质盐析是一种常用的蛋白质纯化方法,通过调节盐浓度、溶液pH值和温度等因素,可以实现蛋白质的分离和纯化。
在进行蛋白质盐析时,需要根据具体的蛋白质性质和实验要求选择合适的条件,以获得最佳的盐析效果。
盐析法沉淀蛋白质的原理
§ 硫酸钠 § 硫酸镁 § 磷酸二氢钠 § 柠檬酸盐
影响盐析的因素
§ 盐饱和度的影响 § 样品浓度的影响:
• 蛋白质浓度大,盐的用量小,但共沉作用明显,分辨率 低; • 蛋白质浓度小,盐的用量大,分辨率高; § pH 值:影响蛋白质表面净电荷的数量 • 通常调整体系 pH 值,使其在 pI 附近; § 盐析温度: • 一般在高盐浓度下,温度升高,其溶解度反而下降
盐析操作
§ 硫酸铵是最常用的蛋白质盐析沉淀剂
§ 采用硫酸铵进行盐析时可按二种方式加入:
1. 直接加入固体(NH4)2SO4 粉末,工业上常采用这种方法,加入速度不能太快, 应分批加入,并充分搅拌,使 其完全溶解和防止局部浓度过高;
2. 是加入硫酸铵饱和溶液,在实验室和小规模生产中, 或(NH4)2SO4 浓度不 需太高时,可采用这种方式,它可防止溶液局部过浓,但加量较多时,料液 会被稀释。
盐析法沉淀蛋白质的原理
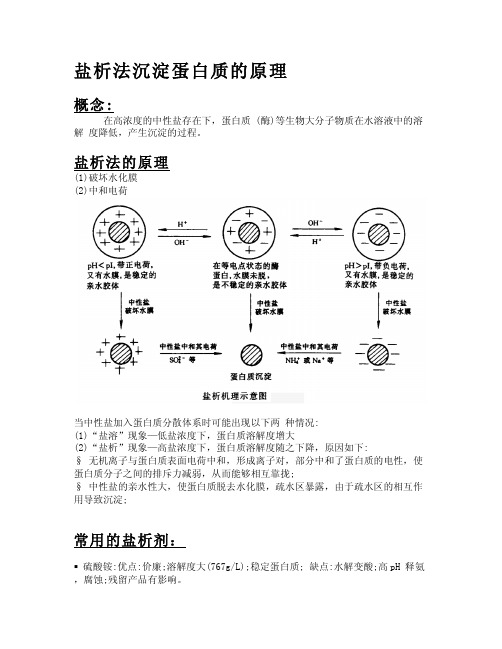
概念:
在高浓度的中性盐存在下,蛋白质 (酶)等生物大分子物质在水溶液中的溶 解 度降低,产生沉淀的过程。
盐析法的原理
(1)破坏水化膜 (2)中和电荷
当中性盐加入蛋白质分散体系时可能出现以下两 种情况: (1)“盐溶”现象—低盐浓度下,蛋白质溶解度增大 (2)“盐析”现象—高盐浓度下,蛋白质溶解度随之下降,原因如下: § 无机离子与蛋白质表面电荷中和,形成离子对,部分中和了蛋白质的电性,使 蛋白质分子之间的排斥力减弱,从而能够相互靠拢; § 中性盐的亲水性大,使蛋白质脱去水化膜,疏水区暴露,由于疏水区的相互作 用导致沉淀;
§ 脱盐
• 透析和凝胶过滤
盐析法沉淀蛋白质的原理

盐析法沉淀蛋白质的原理如下:
蛋白质在水溶液中的溶解度取决于蛋白质和水周围的亲水基团形成的水合膜的程度,以及蛋白质分子带电的条件。
当蛋白质溶液中加入中性盐时,中性盐对水分子的亲和力大于蛋白质,因此蛋白质分子周围的水合膜减弱甚至消失。
同时,在蛋白质溶液中加入中性盐后,由于离子强度的变化,蛋白质的表面电荷被大量中和,这导致蛋白质溶解度降低以及蛋白质分子的聚集和沉淀。
在某些情况下,最好添加饱和溶液。
但是添加固体和添加液体实际上是相同的。
仅当固体相对于液体时,体积才会减小,浓度才会增大。
考虑到少量的蛋白质溶液,当添加饱和硫酸铵溶液时,硫酸铵溶液的质量分数仅降低一点。
当添加固体时,因为温度恒定,所以硫酸钠的溶解度是确定的。
因此,添加的硫酸钠固体最终变成饱和溶液和不再溶解的固体。
当添加饱和溶液时,不必担心pH值,但是当添加固体时,它仅比饱和溶液的pH值大一点,即使可以忽略不计。
使用固体的优点是液体的体积几乎不变,蛋白质溶液的体积不变,每单位体积的可溶性蛋白质也不变,并且由于存在硫酸铵,溶解度降低并沉淀。
添加液体会增加溶液的体积。
这样,尽管存在硫酸铵,但由于溶质恒定且溶剂增加,因此不可避免地该溶液中蛋白质的可溶性量会增加。
盐析法沉淀蛋白质的原理

盐析沉淀蛋白质的原理实际上就是通过降低蛋白质的溶解度,从而使得蛋白质凝聚,最终从溶液中析出。
蛋白质的沉淀其实就是将蛋白质分子聚集,使得它从溶液中析出的一种现象。
一般来说都是对于富含蛋白质的物质进行检查,而在实验进行的过程中需要进行分离、以及提取步骤的时候,就需要将大量的一些干扰测定的蛋白质沉淀有效的除去,这样才能使得待测的毒物完好的留存于溶液当中,所以才需要进行盐析沉淀蛋白质。
蛋白沉淀法其实就是实验室进行一种毒物分析的过程中而对生物的样品进行预前处理的一种比较常见而且常用的方式。
在溶液中加入中性盐使生物大分子沉淀析出的过程称为“盐析”。
除了蛋白质和酶以外,多肽、多糖和核酸等都可以用盐析法进行沉淀分离。
盐析法应用最广的还是在蛋白质领域,已有八十多年的历史,其突出的优点是:
①成本低,不需要特别昂贵的设备。
②操作简单、安全。
③对许多生物活性物质具有稳定作用。
盐析的影响因素
1) 蛋白质的浓度:高浓度的蛋白质用稍低的硫酸铵饱和度沉淀,若蛋白质浓度过高,易产生各种蛋白质的共沉淀作用。
低浓度的蛋白质,共沉淀作用小,但回收率降低。
较适中的蛋白质浓度是2.5%~3.0%,相当于25 mg/mL~30mg/mL。
2) pH值对盐析的影响:在等电点处溶解度小,pH值常选在该蛋白质的等电点附近。
3) 温度的影响:对于蛋白质、酶和多肽等生物大分子,在高离子强度溶液中,温度升高,它们的溶解度反而减小。
在低离子强度溶液或纯水中蛋白质的溶解度大多数还是随浓度升高而增加的。
一般情况下,可在室温下进行。
但对于某些对温度敏感的酶,要求在0℃~4℃下操作,以避免活力丧失。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质在水溶液中的溶解度是由蛋白质周围亲水基团与水形成水化膜的程度,以及蛋白质分子带有电荷的情况决定的。
当用中性盐加入蛋白质溶液,中性盐对水分子的亲和力大于蛋白质,于是蛋白质分子周围的水化膜层减弱乃至消失。
同时,中性盐加入蛋白质溶液后,由于离子强度发生改变,蛋白质表面电荷大量被中和,更加导致蛋白溶解度降低,使蛋白质分子之间聚集而沉淀。
盐析法是指在药物溶液中加入大量的无机盐,使某些高分子物质的溶解度降低沉淀析出,而与其他成分分离的方法。
盐析法主要用于蛋白质的分离纯化。
常作盐析的无机盐有硫酸钠、硫酸镁、硫酸铵等。
还有其他方法能够沉淀蛋白质,比如重金属盐沉淀蛋白质
蛋白质可以与重金属离子如汞、铅、铜、银等结合成盐沉淀,沉淀的条件以pH稍大于等电点为宜。
因为此时蛋白质分子有较多的负离子易与重金属离子结合成盐。
重金属沉淀的蛋白质常是变性的,但若在低温条件下,并控制重金属离子浓度,也可用于分离制备不变性的蛋白质。
临**利用蛋白质能与重金属盐结合的这种性质,抢救误服重金属盐中毒的病人,给病人口服大量蛋白质,然后用催吐剂将结合的重金属盐呕吐出来解毒。
