初中化学奥林匹克竞赛集训营学案 溶液反应推理题
酸碱中和反应推断题集锦

酸碱中和反应推断题集锦
本文将提供一些关于酸碱中和反应推断的练题,有助于加深对此类题型的理解。
1. 已知试剂X是碳酸氢钠溶液,试剂Y是盐酸溶液。
若试剂X和试剂Y的等摩尔溶液混合后产生气泡,则生成的气体是?
答案:二氧化碳
解析:碳酸氢钠与盐酸混合会发生中和反应,生成水和二氧化碳气体。
2. 已知试剂X是氢氧化钠溶液,试剂Y是硝酸溶液。
若试剂X和试剂Y的等摩尔溶液混合后产生一固体沉淀,则该沉淀是?
答案:氢氧化铅
解析:氢氧化钠与硝酸混合会发生中和反应,生成水和硝酸根离子。
该离子与氧化铅离子结合生成氢氧化铅沉淀。
3. 某教员将小玻璃球分装在两个试管中,并加入硝酸和氢氧化钠。
其中试管甲生成一固体沉淀,试管乙无反应。
结论是?
答案:试管甲中有铅离子。
解析:铅离子能与硝酸根离子结合生成固体沉淀,而试管乙中没有发生固体沉淀的反应,说明其中没有铅离子。
通过练习此类题目,可以加深对酸碱中和反应推断的理解,提高化学分析能力。
如何做初中化学推理题

如何做初中化学推理题对初中学生来说,化学推理题是最难的题型了,那么如何做化学推理题呢,首先你必须读懂该题,一步一步的分析,第一步可以得出那些结论,第二步又得到那些结论。
最后综合起来推断出最终的答案,总之,前提是,你必须熟练掌握初中化学中,某些物质的颜色、特性,常见沉淀有哪些,如蓝色的物质,一般有,纯净的氧气是淡蓝色,S在空气中燃烧是淡蓝色,氧气中燃烧是蓝紫色,只要是含有Cu都是蓝色,其他的类推,只要熟记这些物质的特性,你就可以轻易的做题了。
下面我总结了下做化学推理题需要的知识点。
一、物质的学名、俗名及化学式(1)金刚石、石墨:C (2)水银、汞:Hg (3)生石灰、氧化钙:CaO (4)干冰(固体二氧化碳):CO2 (5)盐酸、氢氯酸:HCl (6)亚硫酸:H2SO3 (7)氢硫酸:H2S (8)熟石灰、消石灰:Ca(OH)2 (9)苛性钠、火碱、烧碱:NaOH (10)纯碱:Na2CO3 碳酸钠晶体、纯碱晶体:Na2CO3?10H2O (11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4?5H2O (13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡(15)酒精、乙醇:C2H5OH (16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(17)氨气:NH3 (碱性气体)(18)氨水、一水合氨:NH3?H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般无色。
初中化学竞赛推断题目解题技巧

初中化学竞赛推断题目解题技巧
1. 熟悉化学知识:推断题目需要对化学知识有深入的了解,包括元素周期表、化学反应、化学物质的性质等。
只有熟悉这些知识,才能在解题时迅速找到线索。
2. 仔细阅读题目:推断题目通常不会直接给出答案,而是通过描述一些现象或者条件,让考生根据这些信息推断出答案。
因此,仔细阅读题目,理解题目中的每一个细节,是非常重要的。
3. 利用逻辑推理:推断题目通常需要考生运用逻辑推理的能力,通过已知的信息推断出未知的答案。
例如,通过观察化学反应的结果,推断出反应物或者催化剂;通过分析物质的性质,推断出可能的组成元素等。
4. 利用排除法:当面对多个可能的答案时,可以尝试使用排除法。
首先假设一个答案是正确的,然后看这个答案是否符合题目的所有条件。
如果不符合,就排除这个答案,再试下一个。
5. 反复检查:在确定了答案之后,一定要再次检查一遍,确保自己的答案没有错误。
因为一旦答案出错,就可能会影响整个题目的分数。
6. 多做练习:提高推断题目解题能力的最好方法就是多做练习。
通过不断的练习,可以熟悉各种类型的推断题目,提高自己的解题速度和准确率。
初中化学竞赛实验辅导(精品)
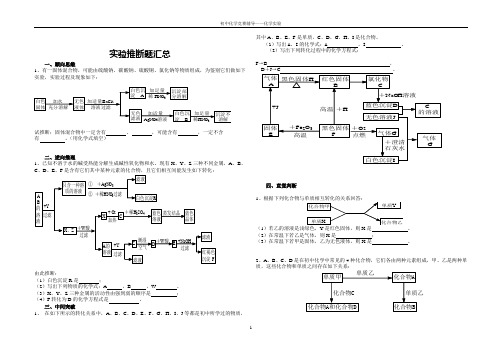
实验推断题汇总一、顺向思维1、有一固体混合物,可能由硫酸钠、碳酸钠、硫酸铜、氯化钠等物质组成,为鉴别它们做如下实验,实验过程及现象如下:试推断:固体混合物中一定含有、,可能含有,一定不含有。
(用化学式填空)二、逆向推理1、已知不溶于水的碱受热能分解生成碱性氧化物和水。
现有X、Y、Z三种不同金属,A、B、C、D、E、F是含有它们其中某种元素的化合物,且它们相互间能发生如下转化:由此推断:(1)白色沉淀R是;(2)写出下列物质的化学式:A,B,W。
(3)X、Y、Z三种金属的活动性由强到弱的顺序是;(4)F转化为D的化学方程式是。
三、中间突破1、在如下所示的转化关系中,A、B、C、D、E、F、G、H、I、J等都是初中所学过的物质,其中A、B、E、F是单质,C、D、G、H、I是化合物。
(1)写出A、I的化学式:A ,I 。
(2)写出下列转化过程中的化学方程式:F→B,D+J→C。
四、直觉判断1(1是。
(2)在常温下若乙是气体,则X是;(3)在常温下若甲是固体,乙为无色液体,则X是。
2、A、B、C、D是在初中化学中常见的4种化合物,它们各由两种元素组成,甲、乙是两种单质,这些化合物和单质之间存在如下关系:(1)化合物C中一定含有(甲元素或乙元素)(2)单质甲的化学式是,化合物A的化学式是。
(3)写出化合物B和化合物D在高温下反应并有化合物A产生的化学方程式为。
五、整体分析现有Ca(OH)2、Na2CO3、BaCl2、NaOH、盐酸、稀H2SO4六种溶液,有下图所示的相互反应关系,图中每条线两端的物质可以发生化学反应,试将它们的化学式填入图中相应的六个方框中。
六、表格式推断题有A、B、C、D、E五瓶失去标签的无色溶液,已知它们分别是NaOH,HCl,MgSO4,BaCl2和K2CO3中的一种。
为了鉴别,各取少量溶液两两混合,实验结果如下表所示。
表中“↓”表示生成难溶或微溶的沉淀;“↑”表示有气体生成;“—”表示观察不到明显的现象变化(本实验条件下,生成的微溶物均以沉淀形式出现)。
初三化学奥数

初三化学奥训第七讲:溶液反应推理题例1将锌片和铁片同时放入硫酸铜溶液中,充分反应后,锌仍有剩余,则此时溶液中大量存在的阳离子是。
将溶液过滤后,滤纸上除锌外还有例2在AgNO3和Fe(NO3)3的混合溶液中加入一定量的锌充分反应中,有少量金属析出,过滤后向滤液中滴加盐酸,有白色沉淀生成。
则析出的金属是。
例3某工厂的废渣中有少量的锌粉和氧化铜,跟大量盐酸形成的污水,产生公害,若向污水中放入铁粉,且反应后铁粉有剩余,此时污水中一定含有的金属离子是A Fe2+ Cu2+B Cu2+ H+C Zn2+ Fe2+D Zn2+ H+例4向CuO与Fe的混合物中加入一定量的稀H2SO4反应停止后,过滤。
除去不溶物,向滤液中加入铁片,未看到铁片有什么变化,则滤出的不溶物中一定含有,可能含有,滤液中一定含有,不可能含有。
例5将Ag、Mg、Fe、CuO组成的混合物,放入足量的盐酸中,反应后溶液呈篮绿色,过滤,滤纸上可能含有()A AgB Fe AgC Cu AgD Fe Cu例6在硫酸锌和硫酸铜混合液中加入过量铁粉,充分反应后,过滤,留在滤纸上的物质是()A CuB ZnC Zn CuD Fe Cu例7在混有少量CuO的铁粉中加入一定量的稀盐酸,充分反应过滤,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化,下列判断正确的是()A过滤出的不溶物只有铜 B过滤出的不溶物只有铁C 过滤出的不溶物中一定含有铜,可能含有铁。
D 滤液中一定含有氯化亚铁,可能含有氯化铜。
例8 把铁粉和铜粉的混合物放入含有FeCl3、FeCl2、CuCl2的溶液中,根据下列不同情填空:(提示:Fe+2FeCl3====3FeCl2)⑴充分反应,铁有剩余,则溶液肯定含有的阳离子,肯定没有的阳离子。
⑵充分反应,溶液里含有一定量的Cu2+,则溶液里不存在的物质是。
例8在氯化镁、氯化亚铁和氯化铜的混合溶液中,加入一定量的铝粉,充分反应后过滤,在滤出的固体中滴加稀盐酸,有气泡产生,则滤出的固体中一定含有(写化学式,下同),滤液中一定含有的溶质是。
初三化学奥林匹克竞赛题

初三化学奥林匹克竞赛题题目:某化学实验室中有一瓶未知溶液,你需要确定该溶液的化学性质。
以下是你所获得的实验数据:1. 该溶液呈酸性,pH值为3;2. 该溶液的电导率较高;3. 该溶液与氯化银溶液反应,生成白色沉淀;4. 该溶液与氢氧化钠溶液反应,产生气体并溶液变绿。
请回答以下问题:1. 根据实验数据,你认为该溶液中可能含有哪些离子或化合物?请解释你的推断。
2. 请写出与该溶液发生反应的化学方程式,并说明反应类型。
3. 该溶液的酸性可能是由哪种酸引起的?请给出理由。
4. 请推测该溶液中可能含有哪些金属离子?请解释你的推断。
5. 请推测该溶液中可能含有哪些非金属离子或化合物?请解释你的推断。
回答:1. 根据实验数据,该溶液呈酸性,pH值为3,说明其中含有酸性物质。
电导率较高表明该溶液中有可离子化的物质存在。
与氯化银溶液反应生成白色沉淀,说明该溶液中可能含有氯离子(Cl-)。
与氢氧化钠溶液反应产生气体并溶液变绿,说明该溶液中可能含有铜离子(Cu2+)。
综上所述,该溶液可能含有酸性物质、氯离子和铜离子。
2. 与氯化银溶液反应生成白色沉淀可以写为化学方程式,Ag++ Cl→ AgCl。
这是一种沉淀反应。
与氢氧化钠溶液反应产生气体并溶液变绿可以写为化学方程式,Cu2+ + 2OH→ Cu(OH)2↓。
这是一种酸碱中和反应。
3. 该溶液的酸性可能是由硫酸引起的。
硫酸是一种常见的强酸,可以使溶液呈酸性。
此外,硝酸和盐酸等也是常见的强酸,但由于未提及产生气体,因此推测酸性可能是由硫酸引起的。
4. 根据实验数据,该溶液与氢氧化钠溶液反应产生气体并溶液变绿,推测该溶液中可能含有铜离子(Cu2+)。
铜是一种常见的金属离子,可以与氢氧化钠反应生成铜(II)氢氧化物。
5. 除了含有铜离子,根据实验数据,该溶液呈酸性,可能含有酸性物质。
此外,与氯化银溶液反应生成白色沉淀,推测该溶液中还可能含有氯离子(Cl-)。
综上所述,该溶液可能还含有酸性物质和氯离子。
初中化学竞赛题流程图推断题(附加题)

初中化学竞赛题流程图推断题(附加题)由于题中没有给出未溶解的10g固体是什么,所以我们需要分类讨论①如果KCl已经全部溶解,则10g全都是二氧化锰,那么原混合物中氯酸钾的质量就是15g,我们需要知道KCl生成的质量是多少,那么根据化学方程式计算可得KCl的质量为9.12g,再根据KCl的质量计算,那么开始加入12g水的时候溶解的KCl质量就是9.12-2=7.12g然后计算溶解度7.12g/12g×100%=59.3g大于表格中100℃的溶解度,所以明显不可能比水沸腾的温度还要高的情况下实验;所以就可以排除这种剩余固体全是二氧化锰的情况;②剩余固体是KCl和二氧化锰的混合物那么后来加入5g水,溶解了2g的KCl可以得出KCl的溶解度为40g,观察表格可以发现这也就是40℃以内的温度,所以算是符合实际情况那么刚开始的12g水中溶解的KCl质量可以计算出来4.8g则所有生成的KCl的质量为6.8g通过化学方程式计算可得氯酸钾的质量为20.9g所以最终只有这种情况是符合实际的;初中化学竞赛:流程图推断题X和白色沉淀I、II都是含有镁元素的化合物,Z是一种能使地球产生“温室效应”的气体,A是一种碱。
它们的有关变化如下图所示(微溶物以沉淀形式出现):(1)写出下列物质的化学式:A_________,B__________;白色沉淀I是____________,Z是______________;(2)X和C反应的化学方程式是_________________________;推断题一直都是初中化学当中比较难的部分,这道题是07年初中化学竞赛的一道题目,有同学可能看到竞赛题就以为特别难,其实只要基础学的扎实,竞赛题也就比大家平时做的基础题难上一些而已,更何况平时不也经常遇到一些难题吗?好,这道题的题干给出了三个信息,1、含有镁元素的化合物三种,而且有两个还是沉淀,首先含镁元素的沉淀很容易想到:Mg(OH)2、MgCO3;2、Z是制造温室效应的气体,那就是CO2了;3、A是一种碱,根据流程图,A和X反应后生成了沉淀,也就是说含镁元素的化合物和一种碱生成了含镁元素的化合物沉淀,那么就可以敲定沉淀I是Mg(OH)2了;生成Mg(OH)2的同时,还有NaCl生成,有Na元素和Cl元素,所以A 肯定是NaOH,而反应物中的X则含有Mg元素和Cl元素,所以为MgCl2;那么白色沉淀I和B反应后又生成了MgCl2,那么可以判断出B为HCl,那么Y就是H2O了,根据白色沉淀II与B反应生成X、Y、Z三种物质,所以很明显就是碳酸盐和盐酸发生的反应,那么不难猜出沉淀II为MgCO3,X与C反应生成MgCO3和NaCl,所以C就是Na2CO3;到这里所有的物质就全部敲定了,所以可以填空了;(1)A是NaOH,B是HCl,白色沉淀I是Mg(OH)2,Z是CO2;(2)X和C反应的化学方程式,也就是[氯化镁]和[碳酸钠]的反应方程式,相信学过的同学都知道,MgCl2+Na2CO3=Mg CO3+2NaCl;(1)根据反应前后质量总量的变化可知氧气为0.4g;通过化学方程式计算出参与反应的过氧化氢的质量,然后计算出双氧水溶液的溶质质量分数即可;(2)小林在锥形瓶上方加上了干燥剂,目的是为了防止氧气在跑出锥形瓶的时候带走部分水蒸气,从而影响结果的测量;(3)认真分析第(2)会发现,小林只是在锥形瓶上方加了干燥剂,但是实验装置没有变,也就是说还是用的天平,而总质量前后变化为0.4g,天平的精确度为0.1g,任你再牛逼你也没法更精确的去读数,所以对于氧气0.4g来说,这个精确度不行;通过计算0.4g的氧气体积为接近300mL,所以要用大点的量筒,那就用500mL的;。
初三化学竞赛推断题大全

全能比赛推断题专项题训练1.现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl中的一种或几种,为确定其组成,取适量试样进行下列实验。
请根据实验现象判断:(1)取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有、。
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀部分消失并产生气泡。
则此固体粉末中一定有、。
(3)取步骤(2)实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确(填“是”或“否”)。
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进(若步骤(3)填“是”,此空不作答)。
2.现有一包白色固体混合物,可能由BaCl2、KNO3、CuSO4、FeCl3、Na2CO3、Na2SO4、NaCl等中的几种混合而成,为证明其组成,做如下实验:(1)取一定量该固体混合物加入足量的水,充分搅拌,得到白色沉淀和无色溶液。
过滤得到白色沉淀A,无色滤液B。
(2)向白色沉淀A中加入过量的盐酸溶液,沉淀部分溶解(3)向无色滤液B中加入硝酸银溶液,产生不溶于稀硝酸的白色沉淀;则:(1)该固体混合物中一定含有,可能含有;一定没有。
(用化学式填空)(2)该混合物至少由种物质构成,该混合物的所有可能组合有种(填数字)3.现有以下三组物质:(1)Fe(过量)、Cu(OH)2、H2SO4(2)Zn、AgNO3(过量)、Cu(NO3)2(3)Fe(过量)、Cu(NO3)2、AgNO3在各种物质里加水搅拌,待充分反应后,过滤,滤纸上有一种金属是;有两种金属的是;有三种金属的是;(填序号)4.有一混合气体的成分中可能含有水蒸气、一氧化碳、二氧化碳,某同学设计了如下的实验装置探究混合气体的成分.请根据要求回答下列问题:(1)实验中,证明混合气体中有水蒸气的现象是;若B中澄清石灰水出现现象,则证明混合气体中有二氧化碳;证明混合气体中有一氧化碳的现象是。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学奥林匹克竞赛集训营学案溶液反应推
理题。
将溶液过滤后,滤纸上除锌外还有例2 在AgNO3和Fe (NO3)3的混合溶液中加入一定量的锌充分反应中,有少量金属析出,过滤后向滤液中滴加盐酸,有白色沉淀生成。
则析出的金属是。
例3 某工厂的废渣中有少量的锌粉和氧化铜,跟大量盐酸形成的污水,产生公害,若向污水中放入铁粉,且反应后铁粉有剩余,此时污水中一定含有的金属离子是 A Fe2+ Cu2+ B Cu2+ H+ C Zn2+ Fe2+ D Zn2+ H+例4 向CuO与Fe的混合物中加入一定量的稀H2SO4反应停止后,过滤。
除去不溶物,向滤液中加入铁片,未看到铁片有什么变化,则滤出的不溶物中一定含有,可能含有,滤液中一定含有,不可能含有。
例5 将Ag、Mg、Fe、CuO组成的混合物,放入足量的盐酸中,反应后溶液呈篮绿色,过滤,滤纸上可能含有()A Ag B Fe Ag C Cu Ag D Fe Cu 例6 在硫酸锌和硫酸铜混合液中加入过量铁粉,充分反应后,过滤,留在滤纸上的物质是()A Cu B Zn C Zn Cu D Fe Cu 例7 在混有少量CuO的铁粉中加入一定量的稀盐酸,充分反应过滤,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化,下列判断正确的是()A 过滤出的不溶物只有铜 B过滤出的不溶物只有铁C 过滤出的不溶物中一定含有铜,可能含有铁。
D
滤液中一定含有氯化亚铁,可能含有氯化铜。
例8 把铁粉和铜粉的混合物放入含有FeCl
3、FeCl
2、CuCl2的溶液中,根据下列不同情填空:(提示:
Fe+2FeCl3====3FeCl2)⑴充分反应,铁有剩余,则溶液肯定含有的阳离子,肯定没有的阳离子。
⑵ 充分反应,溶液里含有一定量的Cu2+,则溶液里不存在的物质是。
例8 在氯化镁、氯化亚铁和氯化铜的混合溶液中,加入一定量的铝粉,充分反应后过滤,在滤出的固体中滴加稀盐酸,有气泡产生,则滤出的固体中一定含有(写化学式,下同),滤液中一定含有的溶质是。
答案:1 Zn2+ Cu Fe2 Ag3 C4 Cu Fe FeSO4 CuSO4 H2SO45 A C6 D7 C D8 Cu Fe MgCl2 AlCl3练习1 往AgNO
3、Cu(NO3)
2、KNO3三种物质的混合液中加入一定量的铁粉,当反应停止后过滤,向滤出的固体中加入稀盐酸,有可燃性气体产生,则滤出的固体中一定存在的物质是,滤液中一定有的金属阳离子是,一定没有的金属阳离子是。
练习2 把含有少量CuO的Fe粉加入盐酸中,反应完成后,有铁粉剩余,过滤后滤液中一定有,滤纸上一定有。
练习3 把Cu、Fe、Zn同时放入一定量的硫酸铜溶液中充分反应后,溶液为浅绿色,过滤,滤纸上一定有,可能有。
滤液中一定有,肯定没有。
练习4 往AgNO
3、Cu(NO3)
2、Zn(NO3)2的混合物溶液中加入一些铁粉,待反应完成后过滤如果在滤纸上只有Ag,则滤液中一定含有的溶质是,可能含有的溶质是。
如果在滤纸有Fe,则滤液中肯定有的溶质是。
练习5 把Fe、Cu一起放入FeCl
3、FeCl
2、CuCl2和AlgNO3的混合液中,充分反应后,铁还有剩余,则溶液里含量最多离子是() A Cu2+ B Fe3+ C Fe2+ Ag+练习6 在溶液中有FeSO4和CuSO4,加入锌粉后,振荡下列说法不正确的是() A 若有锌粉剩余,且溶液里尚有Cu2+,则必定有Fe2+ B 若有锌粉剩余,则溶液中只有Fe2+ C若有锌粉剩余,则溶液中只有Zn2+ D 若锌粉无剩余,且溶液中无Cu2+,则一定有Zn2+,但有无Fe2+不能肯定。
答案:1 Ag Cu Fe2+ K+ Ag+ Cu2+2 Fe2+ Cu Fe3 Cu Fe ZnSO4 FeSO4 CuSO44 Fe(NO3)2 Cu(NO3)2 Zn(NO3)2 AgNO3 Zn(NO3)2 Fe(NO3)25 C6 A B。
