化学反应工程原理(华东理工大学版)第二版第八章答案
大学物理化学核心教程第二版(沈文霞)课后参考答案第8章

第八章电化学一.基本要求1.理解电化学中的一些基本概念,如原电池和电解池的异同点,电极的阴、阳、正、负的定义,离子导体的特点和Faraday 定律等。
2.掌握电导率、摩尔电导率的定义、计算、与浓度的关系及其主要应用等。
了解强电解质稀溶液中,离子平均活度因子、离子平均活度和平均质量摩尔浓度的定义,掌握离子强度的概念和离子平均活度因子的理论计算。
3.了解可逆电极的类型和正确书写电池的书面表达式,会熟练地写出电极反应、电池反应,会计算电极电势和电池的电动势。
4.掌握电动势测定的一些重要应用,如:计算热力学函数的变化值,计算电池反应的标准平衡常数,求难溶盐的活度积和水解离平衡常数,求电解质的离子平均活度因子和测定溶液的pH等。
5.了解电解过程中的极化作用和电极上发生反应的先后次序,具备一些金属腐蚀和防腐的基本知识,了解化学电源的基本类型和发展趋势。
二.把握学习要点的建议在学习电化学时,既要用到热力学原理,又要用到动力学原理,这里偏重热力学原理在电化学中的应用,而动力学原理的应用讲得较少,仅在电极的极化和超电势方面用到一点。
电解质溶液与非电解质溶液不同,电解质溶液中有离子存在,而正、负离子总是同时存在,使溶液保持电中性,所以要引入离子的平均活度、平均活度因子和平均质量摩尔浓度等概念。
影响离子平均活度因子的因素有浓度和离子电荷等因素,而且离子电荷的影响更大,所以要引进离子强度的概念和Debye-Hückel极限定律。
电解质离子在传递性质中最基本的是离子的电迁移率,它决定了离子的迁移数和离子的摩尔电导率等。
在理解电解质离子的迁移速率、电迁移率、迁移数、电导率、摩尔电导率等概念的基础上,需要了解电导测定的应用,要充分掌握电化学实用性的一面。
电化学在先行课中有的部分已学过,但要在电池的书面表示法、电极反应和电池反应的写法、电极电势的符号和电动势的计算方面进行规范,要全面采用国标所规定的符号,以便统一。
会熟练地书写电极反应和电池反应是学好电化学的基础,以后在用Nernst方程计算电极电势和电池的电动势时才不会出错,才有可能利用正确的电动势的数值来计算其它物理量的变化值,如:计算热力学函数的变化值,电池反应的标准平衡常数,难溶盐的活度积,水的解离平衡常数和电解质的离子平均活度因子等。
基础化学第二版习题答案chap8

第八章 氧化还原反应和电极电势 习题答案1. 锌空气电池是历史比较悠久的电池之一,常用于AA 型、AAA 型电池以及钮扣电池等。
它的电池反应如下所示:2Zn(s)+O 2(g)=2ZnO(s)。
试写出电极反应。
负极:Zn+2OHˉ=ZnO+H 2O+2eˉ正极:0.5O 2+H 2O+2eˉ=2OHˉ2.若Pt | H 2(100 kPa )| 胃液 || KCl (0.1 mol·L -1)| Hg 2Cl 2 (s) | Hg(l) | Pt 的电动势等于0.420 V ,而Pt | H 2(100 kPa )H +(1.0 mol·L -1)|| KCl (0.1 mol·L -1| Hg 2Cl 2 (s) | Hg(l) | Pt 的电动势等于0.334 V ,求胃液的pH 。
解:对于电池:Pt | H 2(100 kPa )H +(1.0 mol·L -1)|| KCl (0.1 mol·L -1),Hg 2Cl 2 | HgE 1 =φ+-φo SHE =φ+ =-0.334 (V )对于电池:Pt | H 2(100 kPa ),胃液 || KCl (0.1 mol·L -1),Hg 2Cl 2| HgE 2 =φ+-φ待测 =0.334-φ待测 =0.420(V )φ待测= -0.086(V )根据能斯特方程2+θ+2(H )0.05916V =(H /H )+lg 2100/1000.05916V pH 0.086Vr c ϕϕ=-=- 待测 pH = 1.453. 将下列氧化还原反应设计成原电池,写出电极反应及电池符号:(1)Fe 2+ + Ag +Fe 3+ + Ag 电极反应:正极: Ag + + e - Ag 还原反应:负极: Fe 2+ -e - Fe 3+ 氧化反应电池符号为: (-) Pt | Fe 3+ (c 1) , Fe 2+ (c 2) || Ag + (c 3) | Ag (+)(2)MnO 4- + 5Fe 2+ + 8H +Mn 2+ + 5Fe 3+ + 4H 2O电极反应:正极: MnO 4- + 8H + + 5e - Mn 2+ + 4H 2O 还原反应负极: Fe 2+ -e - Fe 3+ 氧化反应电池符号为: (-) Pt | Fe 3+ (c 1) , Fe 2+ (c 2) || MnO 4- (c 3) , Mn 2+(c 4) | Pt (+)4. 298K 时,在Ag +/Ag 电极中加入过量I -,设达到平衡时[I -] = 0.10 mol·L -1,而另一个电极为Cu 2+/Cu ,[Cu 2+] = 0.010 mol·L -1,现将两电极组成原电池。
分析化学第八章 习题参考答案

第八章 习题参考答案18解:半反应为 MnO 4- + 8H + + 5e =Mn 2+ + 4H 2O V E 51.1=θ][]][[lg 5059.02842/42/4++-+-+-+=Mn H MnO E E Mn MnO Mn MnO θ当[MnO 4-]=[ Mn 2+]=1 mol·L -1或[MnO 4-]/[ Mn 2+]=1时,条件电位为 82/42/4]l g [5059.0++-'+-+=H E E Mn MnO Mn MnO θθ (1)[H +]=2.0mol·L -1时,V E MnMnO 54.1)0.2lg(5059.051.182/4=+='+-θ(2)pH=2.00时,V EMn MnO 32.1)10lg(5059.051.1822/4=+=-'+-θ20解: 2Fe 3+ + Sn 2+ = 2Fe 2+ + Sn 4+ 由下列两个半反应组成:Fe 3+ + e = Fe 2+170.01/23=='++n V E Fe Fe θ Sn 4+ + 2e = Sn 2+214.02/24=='++n V E Sn Sn θ故 n=298.18059.0)14.070.0(2059.0)(lg 2/42/3=-=-=''++'++θθSn Sn Fe Fe E E n K18105.9⨯='K24解: Fe 3+ + e = Fe 2+ 173.011=='n VE θ Sn 4+ + 2e = Sn 2+ 207.022=='n VE θV n n E n E n E SP 29.02107.0273.01212211=+⨯+⨯=++=''θθV n E E 16.02059.0307.0059.0322%1.0=⨯+=⨯+='-θV n E E 55.01059.0373.0059.0311%1.0=⨯-=⨯-='+θ故,滴定突跃范围为:0.16v-0.55v 。
第8章反应工程原理课件

qV ,o
• 空间速度:表示单位时间内通过单位反应器的物 料体积。其值为空间时间的倒数:
SV
1
qv
V ,o
VR
3-2 气相反应的膨胀因子 对于气相反应,由于反应前后物质的量发生
变化,物料的体积流量也发生变化。
Aa + bB → rR + sS
当t=0 nA,0 nB,0
0
0
当t=t na,0(1-xA) nB, O-b/anA,0 Xa
E ( ) dN 1
N d
E ( ) 0.01e 0.01
0~
dN F ( ) F ( )
N
1 e 0.01
四
五
六
七
八
0.00861 0.00638 0.00472 0.0035 0.00259 0.00192 0.00105 0.00043 0.000174
0.00861 0.00638 0.00472 0.0035 0.00259 0.00192 0.00105 0.00043 0.000174
r/snA, 0 xA
s/anA, 0 xA
在t=t时,反应系统中总物质的量为:
n
nA,O
nB,O
(s a
r a
b a
1)nA,O xA
n0
(
s
r
a
a
b
)n A,O n A
n nA A,OnA
A
s
r
a a
b
• 为膨胀因子或物质量浓度的变化率
反应时间为t时,反应物A的摩尔分数为:
y
A
y A,O (1 x A, )
• 之所以要引入多釜串联模型,是因为釜数本身可 以反映出实际流动情况偏离活塞流或偏离全混流 的程度。
有机化学第八章课后习题答案
CH 2BrCH 2CH 3
NaCN
CH 2CNCH 2CH 3
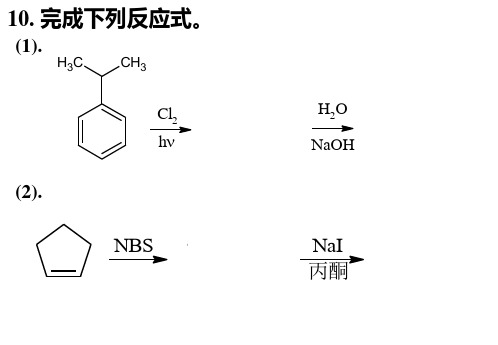
10. 完成下列反应式。
(5).
Mg CH2Cl 干醚
CH2MgCl
(1) CO2 (2) H3O
+
CH2COOH
(6).
CH3 H3C C CH3 Br CH CH3
KOH C2H5OH
H3C H3C
CH3 CH3
10. 完成下列反应式。
AlCl3
Cl2 h Br2 FeBr3
CH3 Br OH
NaOH Br H2O
CH3 Cl
12. 由指定原料合成下列化合物。 CH3C (10). CH3CH2CH2Br
NaOH CH3 CH2CH2Br C2H5OH,
CH3 CH=CH2
CCH2CH2CH3
Br2
CH3 CHBrCH2 Br
CH3
Cl
Cl
NaOH C2H5OH,
CH 3CH=CH 2
Cl2 h
CH 2ClCH=CH 2
Cl2
Cl Cl Cl
12. 由指定原料合成下列化合物。
(4). CH3CHClCH3
NaOH CH3CHClCH 3 C2H5OH,
CH3CH2CH2Cl
HBr CH3CH=CH 2 ROOR
+ HC
CCH 2CH 3
BrMg C
CCH 2CH 3
+ C2H6
12. 由指定原料合成下列化合物。
(1). CH3CHBrCH 3
NaOH CH3CHBrCH 3 C2H5OH,
Cl
CH3CH2CH2Br
HBr CH3CH=CH 2 ROOR
2010级华东理工大学文献检索答案

概论单选题1.以下不属于图书类的有( )。
A.《世界经济年鉴》B.《英汉科技大词库》C.《中国工商企业名录》D.《中国学位论文通报》D2.科技论文的正确组成部分,依次是()A.题目、作者、作者单位、文摘、关键词、正文、参考文献B.题目、作者单位、作者、关键词、文摘、正文、参考文献C.题目、作者、作者单位、关键词、文摘、正文、参考文献D.题目、作者、作者单位、正文、关键词、文摘、参考文献A3.下列号码中,哪个是完整的IPC分类号:()A.A61M16/01B.A61M021*******D.02260436.7A4.一般来说,隐性知识存在于:A.搜索引擎中B.书中C.人的头脑中D.光盘数据库中C5.查找<化工原理>这本书在下列哪个数据库中可以找到?A.维普科技期刊数据库B.万方数据库C.中国期刊数据库D.超星数字化图书馆D6.提高文献查准率的途径下列不正确的是()。
A.合理选择数据库B.逻辑与的使用C.尽量使用截词D.位置算符的使用C7.以下不属于搜索引擎使用技巧的是:A.巧用自然语言检索。
B.使用搜索引擎本身提供的限定。
C.留意别人的搜索。
D.见人就问,不懂就学。
D8.小王和小张在同一个数据库里查找同一个课题,小王查到60篇文献,有30篇相关。
小张查到50篇文献,有28篇相关,下列说法正确的是( )A.小王查准率是30篇B.小张查准率是28篇C.小王比小张查准率高D.小王比小张查准率低D9.下列不属于计算机检索的基本技术的是:A.布尔逻辑检索B.多媒体检索C.位置检索D.截词检索B10.如果你查到的文献太多,则可以():A.使用宽泛的检索式:少用AND;对同义词或不同拼法的词用OR逻辑运算。
B.使用更为泛指的检索词——参考如词表、字典、分类表和叙词表等工具。
C.限定你的检索在文献题名中进行。
D.检索其他的数据库——确定其他的数据库是否适合你所查的课题。
C11.检索式为:A and B,表示A.两个检索词必须相连,不得插入其他词,但词序可以颠倒。
华东理工大学化工原理简答题真题汇总
何谓轨线?何谓流线?为何流线互不订交?99答:轨线是同一流体质点在不一样时辰所占空间地点的连线;流线是采纳欧拉法观察的结果,流线上各点的切线表示该点的速度方向;因为同一点只有一个速度,由此可知,流线互不订交。
2. 动能校订系数α为何老是大于、等于1的?试说明原由?00简述数学模型法例划实验的主要步骤。
00、03、06、10答:数学模型实验研究方法立足于对所研究过程的深刻理解,按以下主要步骤进行工作:①将复杂的真切过程自己化简成易于用数学方程式描绘的物理模型;②将所获取的物理模型进行数学描绘即成立数学模型;③经过实验对数学模型的合理性进行查验并测定模型参数。
4. 流体流动过程中,稳固性是指什么?定态性是指什么?01简述因次论指导下的实验研究方法的主要步骤。
01、04答:因次剖析法的详细步骤:①找出影响过程的独立变量;②确立独立变量所波及的根本因次;③结构因变量和自变量的函数式,往常以指数方程的形式表示;④用根本因次表示所有独立变量的因次,并出各独立变量的因次式;⑤依照物理方程的因次一致性原那么和π定理获取准数方程;⑥经过实验概括总结准数方程的详细函数式。
层流与湍流的实质差别是什么?02答:湍流的最根本特色是出现了径向的速度脉动。
当流体在管内层流时,只有轴向速度而无径向速度,牛顿型流体听从牛顿粘性定律;但是在湍流时,流体质点沿管道流动的同时还出现了径向的随机脉动,这类脉动加快了径向的动量、热量和质量的传质,动量的传达不单因因为分子运动,而根源于流体质点的横向脉动速度。
非牛顿流体中,塑性流体的特色是什么?02、05、06、10答:含固体量许多的悬浮体常表现出塑性的力学特色,即只有当施加的剪应力大于某一临界值〔折服应力〕以后才开始流动,流动发生后,往常拥有剪切稀化性质,也可能在某一剪切率范围内有剪切增稠现象。
8. 什么是流体流动的界限层?界限层分离的条件是什么?03答:因为流体粘性的作用,凑近壁面的流体将接踵受阻而降速,跟着流体沿壁面前流动,流体受影响的地区渐渐扩大,而流速降为未受边壁影响流速的99%之内的地区即为界限层。
化学反应工程陈甘棠答案
化学反应工程陈甘棠答案【篇一:反应工程第五章习题答案】xt>5.1乙炔与氯化氢在hgcl2-活性炭催化剂上合成氯乙烯的反应c2h2?hcl?c2h3cl (a)(b) (c)其动力学方程式可有如下种种形式:(1) r??(papb?pc/k)/(1?kapa?kbpb?kcpc) (2)r??kakbpapb/(1?kbpb?kcpc)(1?kapa) (3)r??kapapb/(1?kapa?kbpb)(4) r??kbpapb/(1?kbpb?kcpc)2试说明各式所代表的反应机理和控制步骤。
解:(1) a???a?b???b?a??b??c??? (控制步骤) c??c??(2) a??1?a?1b??2?b?2a?1?b?2?c?2??1(控制步骤) c?1?c??1(3)a???a?b???b?a??b?c?? (控制步骤)(4) b???b?a?b??c? (控制步骤) c??c??5.2 在pd-al2o3催化剂上用乙烯合成醋酸乙烯的反应为c2h4?ch3cooh?12实验测得的初速率数据如下[功刀等,化工志,71,2007(1968).] 115℃, pacoh?200mmhg,po?92mmhg。
2pc2h4(mmhg)r0?10(mol/hr?g催化剂)570 100 195 247 315 4653.94.4 6.0 6.6 7.255.4注:1mmhg=133.322pa如反应机理设想为acoh???acoh?c2h4???c2h4?acoh?c2h4?hc2h4oac???o2?2??2o?hc2h4oac??o??c2h3oac??h2o? (控制步骤)c2h3oac??c2h3oac??h2o? ?h2o+?试写出反应速率并检验上述部分数据能与之符合否。
解:c2h4?ch3cooh?12o2?ch2cooc2h3?h2o(a)(b)(c)(e)(f) ?a?kapa?v?b?kbpb?v?c?v?f?kfpf?v ?d?ks1kakbpapb?v ?e?kep?ev?v??k2?k3par?ks2?d?c??k1pa(k2?k3pa)2r0??pa(k2?k3pa)2pc2h4(mmhg)70 100 195 247 315 465r0?10(mol/hr?g催化剂)53.94.4 6.0 6.6 7.255.41.3410?31.51 1.80 1.932.08 2.93pa作图,基本上为一直线。
化学反应工程__华东理工大学(1)--期末试卷
华东理工大学201 –201 学年第 学期《化学反应工程》课程考试试卷开课学院:化工学院 ,专业: ,考试形式:闭卷,所需时间:120 分钟一、填充题(25分,每个空格2.5分)⑴反应活化能越小,则说明反应速率对温度变化越 。
对反应活化能E=80 kj/mol 的反应,在300K 时反应速度要求增加10%,则反应温度应变为 。
⑵工业反应过程优化的技术指标是 。
⑶一级串连反应A P S k k 12−→−−→−,k 1=1 hr -1,k 2=2 hr -1,则在CSTR 反应器中最优空时opt τ= h r 。
⑷F(t)的含义是 。
若物料在CSTR 反应器中平均停留时间20分钟,则停留时间小于20分钟的物料占总出口物料 %。
⑸判断气固催化反应外扩散影响的准数是 ,消除外扩散阻力的工程措施是。
⑹在判断内扩散影响时,当Φ ,则内扩散对反应的影响可忽略;当Φ ,则内扩散对反应的影响严重。
二、单选或多选题(16分,每题4分)⑴ 实验室反应器催化剂装填高度10cm ,操作线速度为0.25cm/s 。
若工业反应器催化剂高度为2m ,空速与实验室反应器相同,则工业反应器流体线速度为 。
a. 2.5 cm/sb. 5cm/sc. 7.5cm/sd. 10 cm/s⑵常用的流固相反应模型之一是 。
a. 全混流模型b. 多釜串联模型c. 整体模型d.平推流模型⑶ 对21E E >的串联反应S P A −→−−→−21,21,E E 分别为主副反应活化能,提高反应选择性的措施是 。
a. A c ᆳb. A c ᆳc. T ᆳd. T ᆳ⑷ CSTR 中进行放热反应,其热稳定条件要求同时满足 。
a.=g Q b.g rdQ dQ dTdT<c.g r dQ dQ dTdT>d.rg Q Q =三、图解题(24分,每题8分)⑴平行反应选择性β与转化率x A 的关系如图所示,用图解法画出产物收率最大时反应器的组合形式(PFR ,CSTR),并画出反应器设备组合示意图。
大学物理化学核心教程第二版课后参考答案第8章
大学物理化学核心教程第二版(沈文霞)课后参考答案第8章(总45页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除第八章电化学一.基本要求1.理解电化学中的一些基本概念,如原电池和电解池的异同点,电极的阴、阳、正、负的定义,离子导体的特点和Faraday 定律等。
2.掌握电导率、摩尔电导率的定义、计算、与浓度的关系及其主要应用等。
了解强电解质稀溶液中,离子平均活度因子、离子平均活度和平均质量摩尔浓度的定义,掌握离子强度的概念和离子平均活度因子的理论计算。
3.了解可逆电极的类型和正确书写电池的书面表达式,会熟练地写出电极反应、电池反应,会计算电极电势和电池的电动势。
4.掌握电动势测定的一些重要应用,如:计算热力学函数的变化值,计算电池反应的标准平衡常数,求难溶盐的活度积和水解离平衡常数,求电解质的离子平均活度因子和测定溶液的pH等。
5.了解电解过程中的极化作用和电极上发生反应的先后次序,具备一些金属腐蚀和防腐的基本知识,了解化学电源的基本类型和发展趋势。
二.把握学习要点的建议在学习电化学时,既要用到热力学原理,又要用到动力学原理,这里偏重热力学原理在电化学中的应用,而动力学原理的应用讲得较少,仅在电极的极化和超电势方面用到一点。
电解质溶液与非电解质溶液不同,电解质溶液中有离子存在,而正、负离子总是同时存在,使溶液保持电中性,所以要引入离子的平均活度、平均活度因子和平均质量摩尔浓度等概念。
影响离子平均活度因子的因素有浓度和离子电荷等因素,而且离子电荷的影响更大,所以要引进离子强度的概念和Debye-Hückel极限定律。
电解质离子在传递性质中最基本的是离子的电迁移率,它决定了离子的迁移数和离子的摩尔电导率等。
在理解电解质离子的迁移速率、电迁移率、迁移数、电导率、摩尔电导率等概念的基础上,需要了解电导测定的应用,要充分掌握电化学实用性的一面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应工程原理(华东理工大学版)第二版第八章答案 篇一:化学反应工程原理(华东理工大学版)第三章 华东版 3-1 解:cA0kt?xA1?xA ?1把数据代入得cA0k?0.2min 当xA=0.75时解得t=15min 所以,增加的时间为15-5=10min 3-2 解:?1?xA?1?nn?1?1??n?1?cA0kt (式A) 把xA=0.75和t=10min代入解得cA0k?0.1 再把t=30min代入(式A)解得xA=1.25 所以,转化率应为1 3-3 解:设反应动力学方程为:? 则?1?xA?1?nn?1dcAn ?kcAdtn?1?1??n?1?cA0kt,且cA0=1 ?1?0.8??1??n?1?k8因此有 1?n?1?0.9??1??n?1?k18 解得:n=2;k=0.5L/mol·min 3-4 1)计算进料中酸、醇和水的摩尔浓度cA0、cB0、cS0(注意进料中水的浓度cS0不为0)。 2)列出当酸的转化率为xA时,各组分浓度的表示式: -11?n cA?cA0?1?xA? cB?cB0?cA0xA cR?cA0xA cS?cS0?cA0xA 3)将上列各式及各组分初浓度代入反应速率式,整理得 dxA2 ??7.93?10?6?10.2?20.1xA?2.58xA?dt 4)计算转化率达35%所需的时间为 t??0.35 0dxA ?627.93?1010.2?20.1xA?2.58xA上述积分可查积分表用公式计算,也可用MATLAB语言的quad解算子计算,结果为 t?7153s?2h 5)计算所需反应器体积。先计算每天的反应批数,再计算每m3反应体积每天的生产量,然后再计算达到要求产量所需反应器体积。答案为 VR=51.9m3 3-5 1)设酯的平衡转化率为xAe,将平衡时各组分浓度代入化学平衡方程得: 21.1512xAe?0.219 1.1511?xAe48.76?1.151xAe化简整理上述方程并求解得 xAe?90.8% 2)此题解法与3-4中的步骤2~4相同,答案为t=276min 3)此时各组分的浓度为 酯:0.207mol/L;水:47.816 mol/L;醇、酸:0.910 mol/L; 反应物系的组成为 酯:0.414%;水:95.80%;醇、酸:1.82%; 3-6 对可逆放热反应,当反应温度过低时,因反应速率过低转化率偏低,当反应温度过高时,转化率又会受化学平衡的限制。所以,对一定的平均停留时间都存在一能达到最高转化率的最优反应温度。对本题此最优反应温度可用解析法求解。 1) 列出反应器的物料衡算方程 qV?cA0?cA??VR??rA? 将反应动力学方程代入,整理后可得 xA?k?T??1???k?T??k??T???? 式(A) 2) 对上式求导,并令导数为零 ?dkdk??dk???1??k?k?????k??????dTdTdTdxA?? ?2dT?1??k?k?????? dkkE将上式展开,并将代入,化简后可得 ?2dTRT ???E2E1?ln?? RT?k20?E2?E1? 于是Topt??E2 ??E1Rln??k?E?E2021????12405 ?325K 10000??ln??15?5.254?10?2405?30? 3)计算最优反应温度下的转化率。将T=325K代入式(A)xA?k?T?? 1???k?T??k?T??????6.92?10e?1??6.92?1012e?10000?32512?10000325?3012405?325?30?5.254?1015e???30? =63.5% 3-7 解:依题意知,反应时间相同的情况下,虽然初始浓度不同,但转化率都相同,因此该反应应为一级反应。所以: t?11 lnk1?xA 把数据代入解得:k=0.00656min-1 3-8 3-11 dA?kAS dt dA依题意知:??kA?0.7?A? dt解:? dx因为:?2??C ax?bx?c? 合并同类项并定积分得:11.3?1.4ln?2.4k?293K?0.71.3 11.24?1.4ln?0.434k?310K?0.71.24 ?E RT ?根据阿累尼乌斯公式:k?k0e 可解得E≈66KJ 3-12 dcA 解:?k1cA Bk2cB化简得: 积分得: dcAdcBk1? cAcBk2 3-13篇二:化学反应工程原理第二版(华东理工大学版)第三章答案 解:cA0kt? xA1?xA 把数据代入得cA0k?0.2min?1 当xA=0.75时解得t=15min 所以,增加的时间为15-5=10min 3-2 解:?1?xA? 1?n ?1??n?1?cA0kt (式A) n?1 n?1 把xA=0.75和t=10min代入解得cAk?0.1 0 再把t=30min代入(式A)解得xA=1.25 所以,转化率应为1 3-3 解:设反应动力学方程为:?则?1?xA?因此有 1?n n?1 dcAdt ?kcA n ?1??n?1?cA0kt,且cA0=1 1?n ?1?0.8??1??n?1?k8?1??n?1?k18 ?1?0.9? 1?n 解得:n=2;k=0.5L/mol·min-1 3-4 1)计算进料中酸、醇和水的摩尔浓度cA0、cB0、cS0(注意进料中水的浓度cS0不为0)。 2)列出当酸的转化率为xA时,各组分浓度的表示式: cA?cA0?1?xA?cB?cB0?cA0xAcR?cA0xA cS?cS0?cA0xA 3)将上列各式及各组分初浓度代入反应速率式,整理得 dxAdt ??7.93?10 ?6 ?10.2?20.1x dxA A ?2.58xA? 2 4)计算转化率达35%所需的时间为 t? ? 0.350 7.93?10 ?6 ?10.2?20.1x A ?2.58x 2A ? 上述积分可查积分表用公式计算,也可用MATLAB语言的quad解算子计算,结果为 t?7153s?2h 5)计算所需反应器体积。先计算每天的反应批数,再计算每m3反应体积每天的生产量,然后再计算达到要求产量所需反应器体积。答案为 VR=51.9m31)设酯的平衡转化率为xAe,将平衡时各组分浓度代入化学平衡方程得: 1.151xAe 1.151?1?xAe??48.76?1.151xAe? 2 2 ?0.219 化简整理上述方程并求解得 xAe?90.8% 2)此题解法与3-4中的步骤2~4相同,答案为t=276min 3)此时各组分的浓度为 酯:0.207mol/L;水:47.816 mol/L;醇、酸:0.910 mol/L; 反应物系的组成为 酯:0.414%;水:95.80%;醇、酸:1.82%; 3-6 对可逆放热反应,当反应温度过低时,因反应速率过低转化率偏低,当反应温度过高时,转化率又会受化学平衡的限制。所以,对一定的平均停留时间都存在一能达到最高转化率的最优反应温度。对本题此最优反应温度可用解析法求解。 1) 列出反应器的物料衡算方程 qV?cA0?cA??VR??rA? 将反应动力学方程代入,整理后可得 xA? k?T?? ? ?1???k?T??k?T??? 式(A) 2) 对上式求导,并令导数为零 dxAdT ? ?dkdk? ?1??k?k?????k???????dTdT??dT dk ? ?1??k?k??? ??dkkE ?将上式展开,并将代入,化简后可得 2 dTRT ? ? 2 ? ??E1 ?ln?? RT?k20??E2?E1??E2 于是Topt?? E2 ??E1 Rln?? k?E?E??21??20 ?? 12405 10000?? ln??15 ?5.254?10?2405?30? ?325K 3)计算最优反应温度下的转化率。将T=325K代入式(A) k?T?? ? 1??kT?k???T????? xA? ? 6.92?10e 12 ? 10000325 ?30 ? ??30? 1000012405???1215 1??6.92?10e325?30?5.254?10e325 ? =63.5% 3-7 解:依题意知,反应时间相同的情况下,虽然初始浓度不同,但转化率都相同,因此该反应应为一级反应。所以: t? 1kln 11?xA -1 把数据代入解得:k=0.00656min 3-8 3-11 解:? dAdt ?kAS dAdt ?kA?0.7?A? 依题意知:? 因为:? dxax?bx?c 2 ? ?C ? 10.710.7 lnln ?E 1.3?1.41.31.24?1.41.24 ?2.4k?293K? 合并同类项并定积分得: ? ?0.434k?310K? 根据阿累尼乌斯公式:k?k0eRT 可解得E≈66KJ 3-12 dcA 解: ?k1cA dcBk2cB dt 化简得:积分得: dcAcA ? dcBk1cBk2 3-13篇三:化学反应工程原理(华东理工大学版)第六章答案 华理版 6-1 解:t?100?10min 10 F?t??1?e?t/ 所以,停留时间为0~1min的分率为 F?1??1?e?1/10 停留时间为2~10min的分率为 F?10??F?2???e?10/10?e?2/10 停留时间大于30min的分率为 1?F?30??e?30/10 6-2 解:将数据绘成f(t) ~t图 从曲线形状可知,该反应系统接近于PFR和CSTR的组合模型,当t<1min时,反应器出口响应为0,说明此为平推流,设Vp为PFR总分的体积,则 Vp v0?1.0 Vp?1.0v0?1.0?50?50L 当t>1min时,曲线形状呈指数衰减,如将t=1min以后的数据按lnf(t) ~t作图,可得一直线,直线的斜率为1,即为全混流总分的平均停留时间,所以全混流部分容积Vm为 Vm=1.0×50=50L 所以该反应器系统模型为PFR与CSTR串联,容积Vp、Vm各为50L,相应停留时间均为1min。6-3 c?解:CSTR中均相二级反应=?=0.435 c00即转化率为0.565 ?1c1??ec0k?ei?CSTR中固相二级反应:
