人教版高三化学总复习练习:第三章 金属及其化合物 3-3-1c(学后即练)含解析-新整理
人教版高三化学总复习练习:第三章 金属及其化合物 3-1-3a(基础小题快练)含解析-新整理

一、Na2CO3和NaHCO3的性质及应用1.有关Na2CO3和NaHCO3的叙述中正确的是()A.Na2CO3比NaHCO3的热稳定性强B.Na2CO3和NaHCO3溶液中离子的种类不同C.Na2CO3和NaHCO3均可与NaOH溶液反应D.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同解析:Na2CO3受热不分解,而NaHCO3受热分解,A对;Na2CO3和NaHCO3溶液中离子的种类相同,B错;Na2CO3与NaOH溶液不反应,C错;相同质量的Na2CO3和NaHCO3与足量盐酸作用时,NaHCO3产生的气体质量大,D错。
答案:A2.有关NaHCO3和Na2CO3的性质,以下叙述错误的是()A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍C.将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀D.相同条件下,同物质的量浓度的两种溶液,Na2CO3溶液的pH大于NaHCO3溶液的pH解析:NaHCO3的摩尔质量小于Na2CO3的摩尔质量,等质量的NaHCO3和Na2CO3,其物质的量的大小关系为n(NaHCO3)>n(Na2CO3),即在相同条件下NaHCO3产生CO2的体积大;物质的量相等的NaHCO3、Na2CO3与盐酸反应,消耗同浓度盐酸的体积Na2CO3是NaHCO3的两倍;NaHCO3溶液中HCO-3与OH-反应生成CO2-3,CO2-3与Ca2+结合生成CaCO3沉淀;相同条件下,等物质的量浓度的Na2CO3溶液比NaHCO3溶液的pH大。
答案:C3.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。
下列操作正确的是()A.a通入CO2,然后b通入NH3,c中放碱石灰B.b通入NH3,然后a通入CO2,c中放碱石灰C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉解析:侯氏制碱法的原理是向饱和的NaCl溶液中先通入NH3,然后通入CO2,利用生成的碳酸氢钠溶解度小而析出。
人教版高中化学必修一第三章金属及其化合物(知识梳理+章末综合复习试题)教师版.docx

高中化学学习材料唐玲出品第三章《金属及其化合物》复习知识梳理复习知识要点:1、钠及钠的重要化合物的性质2、铝及铝的重要化合物的性质3、铁及铁的重要化合物的性质复习目标:通过知识点内容梳理及例题练习,回忆并巩固本章所有知识点内容及其应用。
掌握钠和过氧化钠的重要性质;掌握铝及氢氧化铝既能和酸反应又能和碱反应的性质,并能正确书写相应方程式;掌握Fe2+盐和Fe3+盐之间的相互转换。
知识点一:钠1.物理性质颜色密度熔点_____ 比水____,比煤油____ ____100 ℃2.化学性质【特别提醒】(1)实验室中钠常保存在煤油或者石蜡油中,使之隔绝空气和水。
但不能保存在四氯化碳和汽油中。
(2)钠与氧气反应,条件不同产物不同。
【例题1】将一小块金属钠分别投入盛①水、②乙醇、③稀H2SO4的三个小烧杯中,反应速率由快到慢的顺序为______________。
解释反应速率不同的原因: _____________________。
3.Na与水(滴有酚酞)反应的实验现象及结论实验现象实验结论浮.在水面上熔.化成闪亮的银白色小球四处游.动,发出嘶嘶的响.声在反应后的溶液中滴入酚酞试液,溶液变成红.色【例题2】将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有沉淀产生的是_______。
①MgSO4溶液②NaCl溶液③Na2SO4溶液④饱和澄清石灰水⑤Ca(HCO3)2溶液【答案】1.银白;小;大;低于2.Na2O;Na2O2;2Na+2H2O===2Na++2OH-+H2↑;2Na+2H+===2Na++H2↑;2Na+2C2H5OH―→2C2H5ONa+H2↑;2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑;2Na+2H2O+Cu2+===Cu(OH)2↓+2Na++H2↑3.钠的密度比水小;钠的熔点低,钠与水反应为放热反应;钠与水剧烈反应,产生气体;钠与水反应生成碱性物质【例题1】③>①>②;钠与上述三种物质反应的实质都是钠与H+间的置换反应,H+浓度的大小决定了反应速率的快慢,由三种物质电离H+的能力可知H+浓度的大小顺序为③>①>②,因而反应速率为③>①>②。
【教育专用】人教版高三化学总复习练习:第三章 金属及其化合物 3-1-2c(学后即练)含解析
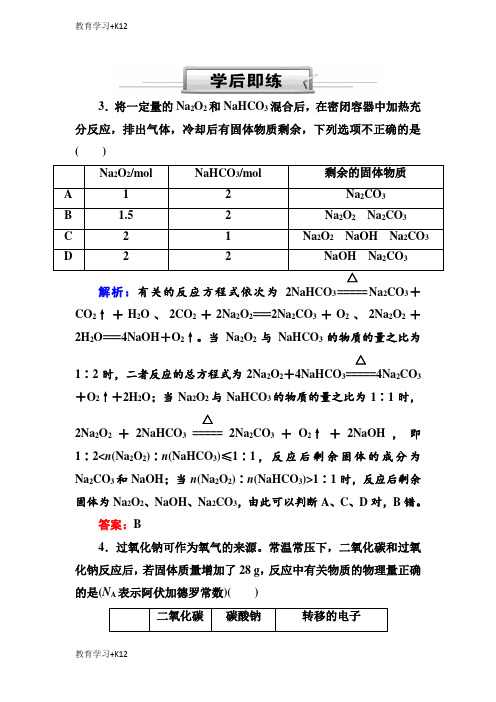
3.将一定量的Na 2O 2和NaHCO 3混合后,在密闭容器中加热充分反应,排出气体,冷却后有固体物质剩余,下列选项不正确的是( )解析:有关的反应方程式依次为2NaHCO 3=====Na 2CO 3+CO 2↑+H 2O 、2CO 2+2Na 2O 2===2Na 2CO 3+O 2、2Na 2O 2+2H 2O===4NaOH +O 2↑。
当Na 2O 2与NaHCO 3的物质的量之比为1∶2时,二者反应的总方程式为2Na 2O 2+4NaHCO 3=====△4Na 2CO 3+O 2↑+2H 2O ;当Na 2O 2与NaHCO 3的物质的量之比为1∶1时,2Na 2O 2+2NaHCO 3=====△2Na 2CO 3+O 2↑+2NaOH ,即1∶2<n (Na 2O 2)∶n (NaHCO 3)≤1∶1,反应后剩余固体的成分为Na 2CO 3和NaOH ;当n (Na 2O 2)∶n (NaHCO 3)>1∶1时,反应后剩余固体为Na 2O 2、NaOH 、Na 2CO 3,由此可以判断A 、C 、D 对,B 错。
答案:B4.过氧化钠可作为氧气的来源。
常温常压下,二氧化碳和过氧化钠反应后,若固体质量增加了28 g ,反应中有关物质的物理量正确的是(N A 表示阿伏加德罗常数)( )2222222CO3+O2,根据反应前后“固体质量关系”可知,相当于Na2O2只吸收了CO2中的“CO”,可看作发生反应“Na2O2+CO===Na2CO3”。
若固体质量增加了28 g(相当于吸收了 1 mol “CO”),则消耗 1 mol CO2(常温常压下,体积大于22.4 L),生成1 mol Na2CO3(质量为106 g)。
根据“电子转移关系”可知,消耗1 mol CO2时,反应中转移1 mol 电子(即N A个)。
答案:C5.200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了 3.6 g,则原混合气体的总物质的量是()A.0.125 mol B.0.25 molC.0.5 mol D.1 mol解析:根据质量守恒定律可知,生成O2的质量为11.6 g-3.6 g=8 g,n(O2)=8 g32 g·mol-1=0.25 mol,根据Na2O2与H2O(g)、CO2反应的物质的量的关系可知CO2和H2O(g)的物质的量之和为0.25 mol×2=0.5 mol。
人教版高中化学必修一第三章金属及化合物综合练习(含答案)(K12教育文档)

人教版高中化学必修一第三章金属及化合物综合练习(含答案)(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(人教版高中化学必修一第三章金属及化合物综合练习(含答案)(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为人教版高中化学必修一第三章金属及化合物综合练习(含答案)(word版可编辑修改)的全部内容。
第三章金属及其化合物综合练习可能用到的相对原子质量:H—1 C—12 O-16 N—14 Na-23 Mg—24 Al-27 Fe—56一、选择题(本题包括16小题,每小题3分,共48分.每小题只有一个选项符合题意)1.等物质的量的两块钠,第一块在足量的氧气中加热,第二块在足量的氧气在常温中充分反应,则下列说法正确的是()A.第二块钠消耗的氧气多 B.两块钠失去的电子一样多C.第二块钠的反应产物质量大 D.两块钠的反应产物的质量一样2.下列说法不正确的()A.生铁和钢都属于合金B.明矾可用作混凝剂除去水中的悬浮物C.实验室用氢化钠溶液与硫酸铝溶液制备氢氧化铝D.0。
1mol钠与氧气在加热条件下完全反应转移0.1mol电子3.磁流体是电子材料的新秀。
将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55nm的磁流体.下列说法中正确的是()A.用光束照射该分散系能产生丁达尔效应 B.所得的分散系属于悬浊液C.所得的分散系中分散质为Fe2O3 D.分散系胶粒直径即Fe(OH)3分子直径4.下列是对某溶液进行离子检测的方法和结论,其中正确的是()A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定不含钾离子B.加入足量的BaCl2溶液,产生白色沉淀,再加入足量的稀盐酸,沉淀不溶解,则溶液中一定含有大量的SO42 -C.加入盐酸,能产生使澄清石灰水变浑浊的无色无味气体,则溶液中一定含有CO32 —D.加入NaOH溶液后加热产生能使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含有NH错误! 5.在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )A.B.C.D.6.实验室配制NaOH溶液时,下列实验操作会使配得的溶液浓度偏大是( )A.转移溶液后未洗涤烧杯和玻璃棒就直接定容B.在容量瓶中进行定容时仰视刻度线C.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度D.NaOH固体溶解后立即转入容量瓶7.下列盛放物质的方法错误的是( )A。
2020届人教版高三化学一轮复习《第三章 金属及其化合物》过关检测试卷含答案

绝密★启用前人教版高三化学一轮复习《第三章金属及其化合物》过关检测卷本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分第Ⅰ卷一、单选题(共20小题,每小题3.0分,共60分)1.Al、Fe、Cu都是重要的金属元素。
下列说法正确的是()A.三种金属单质在常温下均可溶于浓硫酸B.三种金属单质放置在空气中均只能生成氧化物C.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、AlD.制备AlCl3、FeCl3、CuCl2三种固体物质,均不能采用将溶液直接蒸干的方法2.铝在下列应用时应加以控制的是 ()①制铝合金②制电线③制炊具④明矾净水⑤明矾和苏打制食品膨松剂⑥用氢氧化铝凝胶制胃舒平药品⑦银色漆颜料⑧制易拉罐⑨包装糖果和小食品A.全部B.③⑤⑧⑨C.⑥⑧⑨D.③④⑤⑥⑧⑨3.Fe2O3、Fe3O4、CuO的固体混合粉末6.42 g,在加热的条件下用足量的CO还原,将生成的CO2气体用足量的澄清石灰水吸收后,产生10.00 g白色沉淀,则反应得到金属混合物的质量是()A. 3.58 gB. 3.21 gC. 4.82 gD.无法计算4.焰火“脚印”,“笑脸”,“五环”,让北京奥运会开幕式更加辉煌,浪漫,这与高中化学中“焰色反应”知识相关。
下列说法中正确的是 ()A.非金属单质燃烧时火焰均为无色B.所有金属及其化合物灼烧时火焰均有颜色C.焰色反应均应透过蓝色钴玻璃观察D. NaCl与Na2CO3灼烧时火焰颜色相同5.下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应的是()①NaHCO3②(NH4)2SO3③Al2O3④Al(OH)3⑤Al⑥NaHSO4⑦AlCl3⑧Na2SiO3A.①②③④⑤⑥⑦⑧B.①②③④⑤C.③④⑤⑥⑦D.②③④⑤⑧6.Al、Cu都是重要的金属元素。
下列说法正确的是()A.两者对应的氢氧化物均为碱B.两者的单质都能与稀硫酸反应产生氢气C.常温条件下,两种金属都能溶解于浓硫酸中D.制备AlCl3、CuCl2,均不能采用将其溶液直接蒸干的方法7.下列叙述正确的是 ()A.碱金属性质相似均为银白色金属B.随原子序数的增大碱金属的密度依次增大C.钠可保存在煤油中而锂不能D.碳酸氢盐的溶解度大于其正盐的溶解度8.取少量由MgO,Al2O3,Fe2O3,SiO2四种氧化物组成的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。
人教版高三化学总复习练习:第三章 金属及其化合物 3-1-1a(基础小题快练)含解析.doc

一、钠的性质及应用1.关于钠的叙述中,不正确的是()A.金属钠与水反应生成氢气,但是实验室中不能用金属钠与水反应制备氢气B.金属钠放在石棉网上加热时,先熔化成银白色小球,然后剧烈燃烧,发出黄色火焰C.金属钠在空气中放置生成氧化钠,在空气中燃烧生成过氧化钠D.金属钠与氧气反应的产物取决于氧气的用量解析:金属钠与氧气反应的产物取决于反应条件:在空气中放置被氧气氧化,生成氧化钠;在空气中燃烧生成过氧化钠。
答案:D2.在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是()A.将一小块Na投入水中,钠浮于水面,说明钠的密度比水小B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na 没有Cu活泼D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成解析:钠比铜的活泼性强,将一小块钠投入CuSO4溶液中,Na 首先与水反应生成NaOH和H2,然后NaOH再与CuSO4发生复分解反应,生成蓝色Cu(OH)2沉淀,故在水溶液中Na不能置换出Cu。
答案:C3.观察是研究物质性质的一种基本方法。
某同学将一小块金属钠露置于空气中,观察到下列现象:银白色――→①变灰暗――→②变白色――→③出现液滴――→④白色固体,则下列说法正确的是( )A .①发生氧化还原反应生成了过氧化钠B .④只发生物理变化C .③是碳酸钠吸收空气中的水蒸气形成了溶液D .②变白色主要是因为生成了氢氧化钠解析:金属钠露置于空气中发生的一系列变化为:Na ――→①O 2常温下Na 2O ――→②H 2O NaOH ――→③吸水潮解NaOH 溶液――→④吸收CO 2Na 2CO 3,分析对照选项判断,D 项正确。
答案:D4.有关钠的叙述正确的是( )A .2.3 g 钠与97.7 g 水反应后,溶液中溶质的质量分数等于4%B .钠跟CuSO 4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出了金属铜C .将金属钠与水反应后的溶液中通入适量氯气后,溶液中含有两种溶质D .钠在空气中的缓慢氧化与其在空气中点燃的产物都一样 解析:根据反应方程式,2.3 g 钠与水反应生成4.0 g NaOH ,放出0.1 g 氢气,溶液的质量为99.9 g ,所以NaOH 的质量分数大于4%,A 错误;选项B ,Na 与H 2O 反应生成NaOH ,NaOH 再与Cu 2+反应生成Cu(OH)2,因Na与H2O发生的反应是放热反应,可导致生成的Cu(OH)2表面部分分解为CuO(黑色)而非Cu;选项C,金属钠与H2O反应得到NaOH溶液,通入适量的Cl2与NaOH反应生成NaCl、NaClO,所以溶液中含有两种溶质;选项D,Na在空气中缓慢氧化生成Na2O,钠在空气中点燃或加热时生成淡黄色固体Na2O2。
人教版高三化学总复习练习:第三章 金属及其化合物 3-1-3b(学后即练)含解析.doc

1.向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。
下列判断正确的是()A.在0~a范围内,只发生中和反应B.ab斜段发生反应的离子方程式为CO2-3+2H+===H2O+CO2↑C.a=0.3D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2解析:向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,发生的反应依次为OH-+H+===H2O,CO2-3+H+===HCO-3,HCO-3+H+===CO2↑+H2O,据此可以解答。
在0~a范围内,发生的反应应该是OH-+H+===H2O,CO2-3+H+===HCO-3,不只发生中和反应,A错误;ab段发生反应的离子方程式为HCO-3+H+===CO2↑+H2O,B错误;从图象知生成CO20.01 mol,根据方程式HCO-3+H+===CO2↑+H2O可知消耗盐酸的物质的量为0.01 mol,故a=0.3,C正确;根据方程式和图象可知Na2CO3的物质的量是0.01 mol,共计消耗盐酸0.02 mol,所以与氢氧化钠反应的盐酸是0.04 mol-0.02mol=0.02 mol,则氢氧化钠的物质的量为0.02 mol,因此原混合液中,NaOH与Na2CO3的物质的量之比为2∶1,D错误。
答案:C2.现有25 mL 2 mol·L-1的Na2CO3溶液和75 mL 1 mol·L-1的稀盐酸。
(1)将Na2CO3溶液逐滴滴入稀盐酸中;(2)将稀盐酸逐滴滴入Na2CO3溶液中。
两操作的现象及结果(标准状况下)为() A.现象相同,所得气体的体积相等B.现象相同,所得气体的体积不等C.现象不同,所得气体的体积相等D.现象不同,所得气体的体积不等解析:把Na2CO3溶液逐滴加到盐酸中,开始时盐酸过量,则发生反应Na2CO3+2HCl===2NaCl+H2O+CO2↑,开始就有气体放出。
人教版高三化学总复习练习:第三章 金属及其化合物 3-1-2b(学后即练)含解析.doc

1.比较下列四组反应,回答下列问题:一组:①Na2O2+CO2②Na2O2+SO2二组:③Na2O2+FeCl3(溶液)④Na2O2+FeCl2(溶液)三组:⑤SO2通入品红溶液中,加热⑥Na2O2加入到品红溶液中,加热四组:⑦NaOH溶液滴入紫色石蕊溶液中⑧Na2O2固体加入到紫色石蕊溶液中(1)写出①反应的化学方程式:______________,有同学类比①的反应写出②的反应方程式为2Na2O2+2SO2===2Na2SO3+O2,你认为是否合理?________(填“合理”或“不合理”)。
(2)比较分析③、④反应中可能发生的现象,相同点:______________________,差异:__________________________。
(3)预测⑤可能的现象:________________,⑥可能的现象:___________________。
(4)判断⑦、⑧反应中可能发生的现象:⑦______________________________________;⑧______________________________________。
解析:(1)Na2O2具有强氧化性,发生:Na2O2+SO2===Na2SO4。
(2)FeCl3与NaOH反应生成Fe(OH)3,Fe(OH)3是不溶性的红褐色沉淀;④中Fe2+具有强还原性,易被Na2O2氧化并生成Fe(OH)3,Na2O2与溶液中的水剧烈反应会有O2产生。
(3)SO2的漂白性是由于它能与某些有色物质生成易分解的无色物质,Na2O2的漂白性是因其具有强氧化性。
(4)Na2O2与H2O反应生成NaOH,呈碱性,同时Na2O2又有漂白性。
答案:(1)2Na2O2+2CO2===2Na2CO3+O2不合理(2)均会有红褐色沉淀生成并有气体逸出④中气体明显少于③中气体(3)溶液红色褪去,加热后又恢复红色溶液红色褪去,加热后不能恢复红色(4)溶液变蓝溶液先变蓝后褪色2.为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。
这样操作的理由是_______________________________________________
_________________________________________________________。
解析:(1)稀硫酸抑制Fe2+水解,铁屑防止Fe2+被氧化。
(3)Fe(OH)2很容易被氧化,实验过程中要确保在无氧条件下进行。
答案:(1)稀硫酸、铁屑(2)加热煮沸(3)避免生成的Fe(OH)2与氧气接触而被氧化
5.如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。
实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________。
A中反应的离子方程式是_________________________
_______________________________________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:_______________________
________________________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为__________________。
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
解析:Fe+2H+===Fe2++H2↑,当关闭活塞a时,由于H2的压力使溶液压入B中,从而发生Fe2++2OH-===Fe(OH)2↓;Fe2+在空气中很容易被氧化,即4Fe(OH)2+O2+2H2O===4Fe(OH)3。
因此在H2的环境中就不易被O2侵入,从而可以较长时间看到Fe(OH)2白色沉淀。
答案:(1)铁屑Fe+2H+===Fe2++H2↑
(2)打开
(3)关闭活塞a,使FeSO4溶液压入B中进行反应
(4)4Fe(OH)2+2H2O+O2===4Fe(OH)3
(5)①②③⑤。
