人教版高中化学必修2第一章第一节卤素单质的性质教案
(完整word版)化学第一章第一节碱金属元素和卤素学案(人教版新课标必修2)
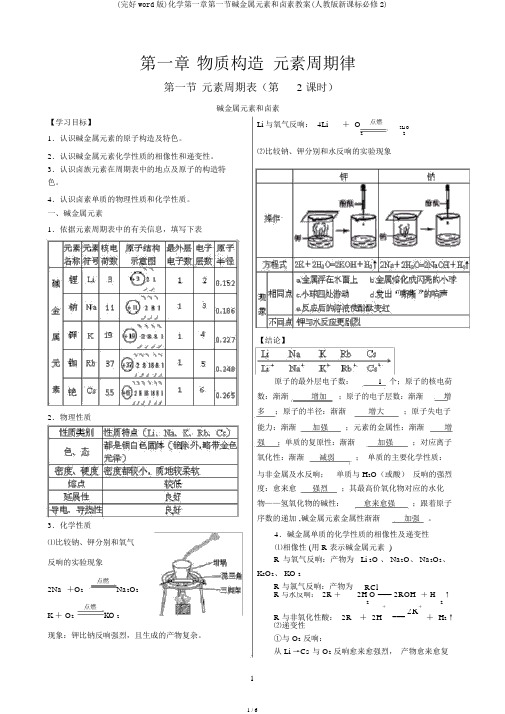
第一章物质构造元素周期律第一节元素周期表(第 2 课时)碱金属元素和卤素【学习目标】1.认识碱金属元素的原子构造及特色。
2.认识碱金属元素化学性质的相像性和递变性。
3.认识卤族元素在周期表中的地点及原子的构造特色。
4.认识卤素单质的物理性质和化学性质。
一、碱金属元素1.依据元素周期表中的有关信息,填写下表2.物理性质3.化学性质⑴比较钠、钾分别和氧气反响的实验现象点燃2Na +O2Na2O2点燃K + O2KO 2现象:钾比钠反响强烈,且生成的产物复杂。
Li 与氧气反响: 4Li+ O点燃2Li O22⑵比较钠、钾分别和水反响的实验现象【结论】原子的最外层电子数: 1 个;原子的核电荷数:渐渐增加;原子的电子层数:渐渐增多;原子的半径:渐渐增大;原子失电子能力:渐渐加强;元素的金属性:渐渐增强;单质的复原性:渐渐加强;对应离子氧化性:渐渐减弱;单质的主要化学性质:与非金属及水反响;单质与 H2O(或酸)反响的强烈度:愈来愈强烈;其最高价氧化物对应的水化物——氢氧化物的碱性:愈来愈强;跟着原子序数的递加 ,碱金属元素金属性渐渐加强。
4.碱金属单质的化学性质的相像性及递变性⑴相像性 (用 R 表示碱金属元素 )R与氧气反响:产物为 Li 2O 、 Na2O、 Na2O2、K2O2、 KO 2R 与氯气反响:产物为RClR 与水反响: 2R +2H O === 2ROH+ H↑22 R 与非氧化性酸: 2R+++ 2H===2R+ H2↑⑵递变性①与 O2反响:从 Li →Cs 与 O2反响愈来愈强烈,产物愈来愈复杂。
如 Li 与 O 2 反响只好生成 Li 2O ,Na 与 O 2 反响还 从 Li →Cs,与 H 2O(或酸 ) 反响愈来愈强烈,如 K能够生成 Na 2O 、 Na 2O 2,而 K 与 O 2 反响能够生成与 H 2O 反响可能会发生稍微爆炸, Rb 与 Cs 遇水发K 2O 、 K 2O 2、 KO 2 等。
2016教师资格备考资料:人教版高中化学必修2第一章第一节卤素单质的性质教案

人教版高中化学必修2第一章第一节卤素单质的性质教案一、教学目标【知识与技能】卤族元素在元素周期表中的位置及其性质的递变规律,单质的性质和原子结构的关系。
【过程与方法】在元素周期表教学中,体验科学探究的过程,学习运用以实验为基础的实证研究方法。
【情感态度与价值观】在元素周期表的教学中,通过探究规律,体验科学探究的艰辛和喜悦,感受化学世界的奇妙与和谐。
二、教学重难点【重点】(1)卤族元素在元素周期表中的位置及其性质的递变规律。
(2) 卤族元素性质和原子结构的关系。
【难点】(1)卤族元素在元素周期表中的位置及其性质的递变规律。
(2) 卤族元素性质和原子结构的关系。
三、教学过程(一)投影展示,问题导入。
【投影】PPT投影氟氯溴碘四种单质:【提出问题】通过观察,能说出这四种单质哪些性质和特点?【回答】F2是淡绿色气体,Cl2是黄绿色气体,Br2是深红棕色液体,I2是紫黑色固体。
【提问】那么它们之间有什么共同点和不同点呢?卤素单质的性质会不会和碱金属一样存在一定的周期性变化呢?我们一起来学习一下。
(二)联系旧知,探究新知【投影】资料卡片(学生可以看书)【提问】这些性质之间有什么变化规律吗?【回答】从F2到I2颜色变深了,状态由气态变为液态又变为固态,密度也增大,沸点也升高了,呈现了规律性的变化。
填写“卤素单质的物理性质”的表格:(见板书设计)【提问】我们看到的单质图片中的溴有什么发现?它从瓶底到瓶口有什么变化?这个试剂瓶中是纯溴吗?碘能不能溶于水呢?若能,会有什么现象呢?【讲解】图片的试剂瓶中是溴溶于水后的溶液,我们叫做溴水,讲解出分层现象及每一层是什么(也可以让同学猜一下每一层是什么),再讲解出碘溶于水后的现象以及它易升华的特性以及应用。
在PPT上投影出来结论:(三)知识升华,深入探讨与学习碱金属类似,学完物理性质就该讲化学性质了(可以让学生形成这种探究元素及化合物的学习方法的思维)【自主画图】画出F、Cl、Br、I四种元素的原子结构示意图。
【高一化学精品学案】人教版必修2第一章:卤族元素递变规律
2Fe+3X2 2FeX3(X=F、Cl、Br)
Fe+X2 FeX2(X=I)
4.卤素单质间的置换反应
实验操作
实验现象
化学方程式、离方程式
静置后,液体分层,上层
,
下层
静置后,液体分层,上层
,
下层
静置后,液体分层,上层
,
下层
【总结】再次证明
【阅读】卤化银的性质
1.卤化银
卤化银
AgF
AgCl
AgBr
AgI
颜色及水溶性
溶于水
白色沉淀
浅黄色沉淀
黄色沉淀
2.卤化银的用途:
⑴卤化银都有感光性,在光的照射下会发生分解反应。例如:2AgBr 2Ag +Br2
卤化银的这种感光性质,常被用于制作感光材料。
⑵变色镜(常用的变色镜粒含有卤化银、少量的氯化铜和稀土金属)。
⑶AgI常用于人工降雨。
【目标五】非金属性强弱判断
比较元素非金属性的强弱,其实质是看元素原子得电子的难易程度,越易得电子,非金属性越强。
1.从元素原子结构判断
⑴当电子层数相同时,核电荷数越多,非金属性越强。
即:同周期,自左至右,元素非金属性增强。如:
⑵当最外层电子数相同时,核电荷数越多,非金属性越弱。
即:同主族,自上至下,元素非金属性减弱。如:
元素名称
元素符号
核电荷数
原子结构示意图
最外层电子数
电子
层数
原子半径
(nm)
卤族元素
氟
0.07
氯
0.099
溴
0.114
碘
0.133
相似性:最外层电子数相同,均为;
卤素单质高中化学教案

卤素单质高中化学教案学科:化学年级:高中课题:卤素单质教学目标:1. 了解卤素元素的特性和性质。
2. 掌握卤素单质的物理性质和化学性质。
3. 掌握卤素单质在实际生活中的应用。
教学重点:1. 卤素元素的特性和性质。
2. 卤素单质的物理性质和化学性质。
教学难点:1. 卤素单质的化学性质的理解和掌握。
2. 卤素单质的应用。
教学准备:1. 实验器材:卤素单质、试管、试管夹、燃烧器等。
2. 实验材料:氯、溴、碘等卤素单质。
教学过程:一、导入(5分钟)向学生提出问题:卤素是哪些元素?卤素元素有哪些特性和性质?请同学们做好心理准备,接下来我们将学习卤素单质的知识。
二、讲解(15分钟)1. 讲解卤素元素的特性和性质,包括氯、溴、碘等卤素元素的性质。
2. 讲解卤素单质的物理性质和化学性质,重点介绍卤素单质的熔沸点、电负性和与金属的反应等内容。
三、实验(20分钟)1. 实验一:利用氯、溴和碘的单质,分别进行不同实验,观察其物理性质和化学性质。
2. 实验二:利用卤素单质与金属反应的实验,观察卤素单质与不同金属的反应情况。
四、讨论(10分钟)总结实验结果,让学生发表自己的观点和看法,引导学生思考卤素单质的应用领域。
五、作业(5分钟)布置作业:查阅资料,了解卤素单质在实际生活中的应用,撰写一份简短的报告。
六、课堂小结(5分钟)对本节课的重要内容进行回顾和总结,强调重点和难点知识,强化学生的理解和记忆。
教学反思:本节课通过理论讲解和实验操作相结合的方式,使学生更加深入地了解卤素单质的特性和性质,提高了学生的动手能力和实验操作能力。
但需要注意的是,在实验操作过程中要注意安全,确保实验的顺利进行。
人教版高中化学必修二 1.1.3 卤族元素的结构与性质 教案 (1)

C.砹易溶于有机溶剂D.砹 是白色固体
4.下列叙述正确的是( AD )
A.卤素离子(X-)只有还原性而无氧化性
B.某元素由化合态变成游离态,该元素一定被氧化
C.失电子难的原子获得电子的能力一定强
D.负一价卤素离子的还原性在同一族中从上至下逐渐增强
规律:原子核对外层电子的吸引能力逐渐减小,得电子能力越来越差,非金属性减弱
℃
溶解度
(100g水中)
F2
淡黄绿色气体
1.69g/l(15℃)
-188.1
-21.6
反应
Cl2
黄绿色气体
3.214g/l(0℃)
-34.6
-101
226cm3
Br2
深红棕色液体
3.119g/cm3(20℃)
58.78
-7.2
4.17g
I2
紫黑色固体
4.93g/cm3
184.4
113.5
0.029g
元素名称
元素符号
核电荷数
原子结
构示意图
最外层
电子数
电子层数
原子半径
卤族元素
氟
0.71nm
氯
0.99nm
溴
1.14nm
碘
1.33nm
相似性:最外层电子数相同,均为7;
递变性:卤素随着荷电荷数的增加,电子层数逐渐增加,原子半径逐渐增大,原子核对外层电子的吸引能力逐渐减小,得电子能力越来越差,非金属性减弱。
教学难点
金属族的性质递变判断;金属活泼性强弱的判断规律
教学方法
探究法、实验法
教学媒体
多媒体
教学内容
师生活动
高中化学卤素教案

高中化学卤素教案科目:化学年级:高中课题:卤素教学目标:1. 了解卤素的特性和性质;2. 掌握卤素的常见化合物及其制备方法;3. 理解卤素在日常生活和工业生产中的应用。
教学重点:1. 卤素元素的性质和特点;2. 卤素的常见化合物和制备方法;3. 卤素的应用领域。
教学难点:1. 掌握卤素的化学性质和反应特点;2. 理解卤素在化工生产中的重要作用。
教学准备:1. 教材:化学教科书;2. 实验器材:试管、试剂瓶等。
教学流程:一、导入(5分钟)教师引导学生回顾上一节课学过的内容,简要介绍卤素元素在周期表中的位置和基本性质。
二、讲解卤素的性质(15分钟)1. 讲解卤素的通用性质,如物理性质、化学性质等;2. 分别介绍氟、氯、溴和碘的特点及常见化合物。
三、实验演示(20分钟)教师进行一些简单的实验演示,展示卤素元素的化学性质和反应特点。
四、讲解卤素的制备方法(10分钟)1. 介绍卤素的常见制备方法,包括从矿石中提取和实验室合成等;2. 强调各种制备方法的优缺点以及应用领域。
五、小组讨论(15分钟)让学生分成小组,讨论卤素在日常生活和工业生产中的应用,并给出相关实例。
六、总结(5分钟)教师对本节课的内容进行总结,强调卤素在化学领域的重要性和应用前景。
七、作业布置(5分钟)布置相关作业,要求学生复习本节课内容,并准备下节课的学习。
教学反思:本节课主要介绍了卤素元素的性质、制备方法和应用领域,通过实验演示和小组讨论活动,激发了学生的学习兴趣,并提高了他们的实践能力和团队合作能力。
同时,也要求学生在课后深入思考和总结,提高他们的学习效果和理解水平。
人教版高中化学必修二 1.1.3 卤族元素的结构与性质 教案 (1)

溶解度
(100g水中)
F2
淡黄绿色气体
1.69g/l(15℃)
-188.1
-21.6
反应
Cl2
黄绿色气体
3.214g/l(0℃)
-34.6
-101
226cm3
Br2
深红棕色液体
3.119g/cm3(20℃)
58.78
-7.2
4.17g
I2
紫黑色固体
4.93g/cm3
184.4
113.5
0.029g
F2+H2=2HF(氟化氢)
Cl2
在光照或点燃下发生反应,生成的氯化氢较稳定
Cl2+H2=2HCl(氯化氢)
Br2
在加热至一定温度下才能反应,生成的溴化氢不如氯化氢稳定
Br2+H2=2HBr(溴化氢)
I2
持续加热,缓慢的化合,碘化氢不稳定同时发生分解
I2+H2=2HI(碘化氢)
卤素单质与水、碱反应的比较
A.HAt很稳定B.AgAt易溶于水
C.砹易溶于有机溶剂D.砹 是白色固体
4.下列叙述正确的是( AD )
A.卤素离子(X-)只有还原性而无氧化性
B.某元素由化合态变成游离态,该元素一定被氧化
C.失电子难的原子获得电子的能力一定强
D.负一价卤素离子的还原性在同一族中从上至下逐渐增强
规律:原子核对外层电子的吸引能力逐渐减小,得电子能力越来越差,非金属性减弱
金属性强弱的判断1.和水反应的剧烈程度2.最高阶氧化物对应水化物的碱性。
单质易溶于有机溶剂可用四氯化碳等有机溶剂萃取
可逆反应
通式X2+H2O=HX+HXO
Cl2+ NaBr
=NaCl+Br2
高中化学必修二卤素教案

高中化学必修二卤素教案教案目标:1. 理解卤素元素的特性和周期表位置;2. 掌握卤素元素的物化性质及反应类型;3. 能解释卤素元素与其他元素的反应机理;4. 对卤素元素在生产和日常生活中的应用有所了解。
教学重点:1. 卤素元素的性质和周期表位置;2. 卤素元素的物理性质和化学性质;3. 卤素元素的反应类型和反应机理;4. 卤素元素的应用领域。
教学难点:1. 理解卤素元素的电子结构及其化学性质;2. 掌握卤素元素与其他元素的反应机理;3. 探讨卤素元素在实际生活中的应用。
教学过程:一、导入(5分钟)通过展示卤素元素的性质和周期表位置,激发学生对卤素元素的兴趣,引导学生思考卤素元素在化学中的重要性。
二、学习卤素元素的性质(15分钟)1. 讲解卤素元素的周期表位置和电子结构;2. 分析卤素元素的物理性质和化学性质;3. 演示卤素元素与其他元素的反应类型。
三、讨论卤素元素的反应机理(20分钟)1. 分析卤素元素与金属的反应机理;2. 探讨卤素元素与非金属的反应机理;3. 解释卤素元素在化学反应中的作用及影响。
四、应用实例展示(10分钟)1. 分析卤素元素在工业生产中的应用;2. 探讨卤素元素在日常生活中的应用;3. 讨论卤素元素在医学和农业领域的应用。
五、总结反思(5分钟)回顾本节课所学内容,让学生总结卤素元素的重要性和应用领域,提出自己的见解和思考。
六、作业布置(5分钟)布置相关习题和实验,加深学生对卤素元素的理解,扩展知识视野。
教学方式:1. 讲授教学结合案例分析;2. 实验教学和讨论学法结合;3. 小组合作学习和个人独立思考结合。
教学手段:1. PowerPoint 等教学软件;2. 实验仪器和材料;3. 课堂讨论和小组合作。
教学评估:1. 学生课堂表现;2. 实验报告和作业表现;3. 学生学习笔记和总结。
教学反馈:及时收集学生对本课程的反馈意见和建议,以便及时调整和改进教学方式,提高教学效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人教版高中化学必修2第一章第一节卤素单质的性质教案【教材版本】人教版高中化学必修2
【教学内容】第一章第一节卤素单质的性质
【教学目标】
1. 了解卤素单质的性质,明确其特点。
2. 掌握卤素单质化学反应的原理及过程。
3. 练习运用化学方程式描述反应过程。
4. 培养学生观察能力和实验操作能力,提高实验安全意识和实验技能。
【教学重点】
1. 卤素单质的物理和化学性质。
2. 卤素单质化学反应的原理和过程。
【教学难点】
1. 培养学生观察能力和实验操作能力,提高实验安全意识和实验技能。
2. 掌握卤素化学反应的原理及过程。
【教学方法】
1. 讲述教学法:通过讲解教材内容及相关实验,让学生了解卤素单质的性质。
2. 实验教学法:实验中让学生亲手操作,理解卤素单质的化学反应。
【教学过程】
1. 导入环节
通过举例子了解卤素单质的应用。
例如:氯乙烯、氯化胆碱。
2. 讲解卤素单质的性质
在介绍卤素单质性质时,首先让学生看图,了解卤素单质的外观及状态。
随后通过对比分析发现,卤素单质外观都是颜色较深的液体或固体。
在此基础上,讲解各个卤素单质的物理性质(沸点、熔点、密度等)和化学性质(易受热、惰性、利用化学反应进行物质转化等)。
3. 渐进式教学
(1)分析卤素单质的化学反应,通过图示、化学方程式等形式详细介绍卤素单质化学反应。
(2)了解卤素单质化学反应的原理及反应产生的现象。
例如
热氯播设、碘化钾反应、氟化钙反应等常见反应。
(3)进行实验,让学生亲手操作,加深对卤素单质的认识。
4. 实验设计
(1)设备:圆底烧瓶、临时胶管、滴液管、温度计、导管放
热式反应管等。
(2)实验内容:
a. 观察氯的反应:将少量氯气通入劣质黄色的二碳酸钠溶液中。
氯气+二碳酸钠溶液→二氧化碳气体+水+氯化钠
b. 观察溴的反应:将一小块溴放入烧杯中加热,观察其变化。
溴→褐色气体
c. 观察碘的反应:将一小块碘放入烧杯中加热,观察其变化。
碘→紫色气体
【教学资源】
1. 教材及教具,如实验装置、实验用品等。
2. 多媒体设备、PPT等。
3. 实验指导书。
【板书设计】
第一章第一节卤素单质的性质
一、卤素单质的外观与状态
二、卤素单质的物理性质
三、卤素单质的化学性质
(一)卤素化学反应的原理及过程
(二)卤素化学反应中的产物
【课堂反馈】
1. 提问学生,问及卤素单质的性质,有何特点?
2. 有条件的话,组织学生前往化学实验室观察卤素单质的实际反应,加深对各种卤素单质的认识,助于加深学生对卤素单质的理解。
3. 完成分组提问任务,鼓励学生针对课堂所学内容展开思考,搜集相关信息,积累知识素养,成就学业自我。
【拓展延伸】
1. 通过教查资料的方式,让学生了解卤素含量的测定方法,以此深入理解卤素在现代工程、生活生产中的应用。
2. 进一步了解卤素单质的半导体性质及实际应用。
3. 探索卤素纳米材料的制备、性质及应用,并组织学生进行实验操作,培养其动手能力和创新思维。
