LFB髓鞘染色
LFB髓鞘染色
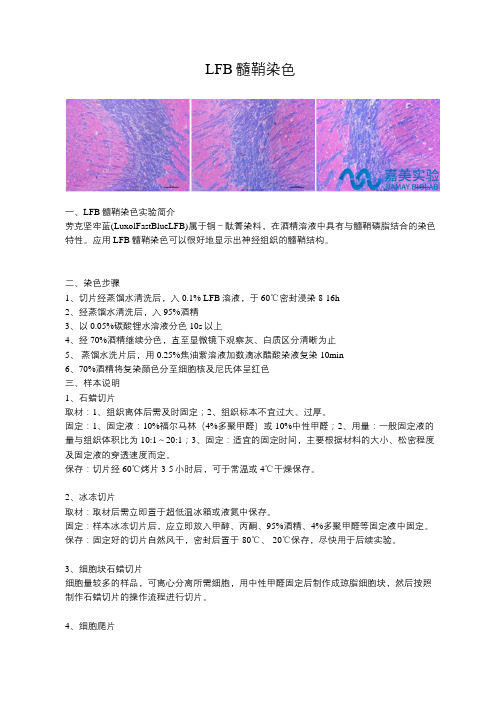
LFB髓鞘染色一、LFB髓鞘染色实验简介劳克坚牢蓝(LuxolFastBlueLFB)属于铜-酞箐染料,在酒精溶液中具有与髓鞘磷脂结合的染色特性。
应用LFB髓鞘染色可以很好地显示出神经组织的髓鞘结构。
二、染色步骤1、切片经蒸馏水清洗后,入0.1% LFB溶液,于60℃密封浸染8-16h2、经蒸馏水清洗后,入95%酒精3、以0.05%碳酸锂水溶液分色10s以上4、经70%酒精继续分色,直至显微镜下观察灰、白质区分清晰为止5、蒸馏水洗片后,用0.25%焦油紫溶液加数滴冰醋酸染液复染10min6、70%酒精将复染颜色分至细胞核及尼氏体呈红色三、样本说明1、石蜡切片取材:1、组织离体后需及时固定;2、组织标本不宜过大、过厚。
固定:1、固定液:10%福尔马林(4%多聚甲醛)或10%中性甲醛;2、用量:一般固定液的量与组织体积比为10:1~20:1;3、固定:适宜的固定时间,主要根据材料的大小、松密程度及固定液的穿透速度而定。
保存:切片经60℃烤片3-5小时后,可于常温或4℃干燥保存。
2、冰冻切片取材:取材后需立即置于超低温冰箱或液氮中保存。
固定:样本冰冻切片后,应立即放入甲醇、丙酮、95%酒精、4%多聚甲醛等固定液中固定。
保存:固定好的切片自然风干,密封后置于-80℃、-20℃保存,尽快用于后续实验。
3、细胞块石蜡切片细胞量较多的样品,可离心分离所需细胞,用中性甲醛固定后制作成琼脂细胞块,然后按照制作石蜡切片的操作流程进行切片。
4、细胞爬片在孔板里做的细胞爬片,爬片取出后,用PBS洗涤2次(根据研究目的,PBS洗涤可选择不做),用4%多聚甲醛4℃固定15分钟,将表面液体吹干,置于-20℃保存。
若在短时间内即开展实验,可在加固定液后,于4℃冰箱中放置一段时间。
5、细胞涂片细胞涂片常用的固定液有95%酒精(最为常用)、酒精-冰醋酸液、乙醚-酒精液和Carney’s液等。
四、注意事项1、常用的固定液为中性甲醛和4%多聚甲醛,能使大多数抗原保存良好,适用于免疫组织化学。
大鼠脑髓鞘坚牢蓝染色的两种不同复染方法比较

doi:10.3969/j.issn.1001—1633.2018.03.023
广 东 省 省 级 科 技 计 划 项 目 (2016A020225007)
第 1作者 E-mail:609763643@qq.corn
△通信作者 ,E-mail:liulq1227@163.COrn
收 稿 日期 :2017-06—21;修 回 日期 :2017—12—26
仔 鼠出生后第 14天 ,母 鼠和仔 鼠在 1O 水 合氯醛 (0.3 ml/ 100 g)腹腔 注射麻醉下 ,以 0.9 生 理盐 水冲洗 和 4 多聚 甲醛 溶 液灌注 ,灌 注固定后取脑置 于 4 多 聚甲醛 中 固定 48 h,组织 常规 脱水和石蜡包埋 ,用于坚牢蓝染色 。 1.3 LFB 染 色及 复 染
在 中枢神 经系统中 ,髓 鞘 是 由少 突胶 质细 胞 的突起缠 绕神 经元轴突所形成 的管状 节段性 结构 ,其主要 成分是 7O 脂 类 和 3O 蛋 白质构成 的鞘磷脂 结构 [】],而 有髓 神经 纤维是 大脑 白质 的重要组成部分 。 目前 ,检测髓鞘脂类 表达 的方 法有多种 ,其 中 劳克坚牢蓝 (1uxol fast blue,LFB)染 色是一 种较为 常用 的髓鞘 染 色 方 法 [2 ]。但 LFB 染 色 也 有 不 同 的 复 染 方 法 ,其 染 色 效 果 亦 有 差 异 。本 研 究 通 过 对 成 年 鼠和 幼 鼠 2种 不 同 鼠龄 阶 段 的 大 脑髓鞘 LFB染 色 ,比较焦油紫 和伊 红 2种 不 同复 染方法 的优缺 点 ,为相关 研究提供合适 的染 色方法 。
Com parison of two counterstaining methods of luxol fast blue in m yelin sheath of rat brain
病理学技术——特殊染色最全总结

结缔组织染色法1.Mallory三色染色法蓝色:胶原和网状纤维淡蓝色:软骨、粘液、淀粉样变物质红色:神经胶原纤维、肌纤维、酸性颗粒橘红色:髓鞘、红细胞2.Masson三色染色法绿色:胶原纤维红色:肌纤维橘红色:红细胞3.显示胶原、网状和弹性纤维的三联染色法红色:胶原纤维黑色:网状纤维绿色:弹性纤维淡黄色:肌肉、红细胞胶原纤维染色法1.Van Gieson(V.G)苦味酸-酸性品红法黄色:肌纤维、细胞质、红细胞蓝褐色:胞核2.天狼星红(Sirius red)苦味酸染色法红色:胶原纤维绿色:细胞核黄色:其他网状纤维染色Gordon-Sweets银氨染色法黑色:网状纤维红色:胞核(核固红复染)黄棕色:胶原纤维淡红色:细胞质(红液复染)弹性纤维染色Gomori醛复红染色法*甲醛生理盐水液固定的染色效果最佳显示弹性、胶原纤维的双重组合染色法蓝绿色:弹性纤维红色:胶原纤维黄色:背景肌肉组织染色△横纹肌组织染色Mallory磷钨酸苏木精染色法(PTAH)蓝色:胞核、纤维、肌肉、神经胶质纤维、纤维蛋白、横纹肌黄色或枚红色:胶原纤维、网状纤维软骨基质、骨微紫色:粗弹性纤维(有时)紫蓝色或棕黄色:缺血缺氧早期病变的心肌△早期心肌病变组织染色1.Nagar-Olsen染色法(1974年)红色:缺氧心肌、红细胞黄色或黄棕色:正常心肌蓝色:细胞核2.Poley显示缺氧心肌染色法(1964年)红色:缺氧心肌紫色:胞核绿色:其他组织糖类染色过碘酸-Schiff(PAS)染色法红色:糖原及其他PAS反应阳性物质蓝色:细胞核黏液物质(黏多糖)染色1.Mowry阿尔辛蓝过碘酸雪夫(ABPAS)染色法(1956)红色:中性黏液物质蓝色:酸性黏液物质紫红色:混合性黏液物质2.爱先蓝(PH2.5)法蓝色:唾液酸、弱硫酸化黏液物质、一般粘液红色:胞核不着色:强硫酸化黏液物质3、爱先蓝(PH1.0)法蓝色:含硫酸黏液物质不着色:非硫酸化酸性黏液物质红色:复染后的胞核黑色素染色1.Masson-Fontana黑色素银浸染色法黑色:黑色素及嗜银细胞颗粒红色:胶原纤维浅黄色:背景2.Lillie亚铁染色法暗绿色:黑色素浅绿或不着色:背景黄色:肌纤维和背景含铁血黄素染色Perls blue(普鲁士蓝)反应显示三价铁蓝色:含铁血黄素浅红色:其他组织胆色素染色三氯醋酸染色法绿色:胆色素红色和黄色:其他纤维蛋白染色1.Lendrum等MSB染色法*本法的MSB指马休黄猩红蓝法红色:纤维蛋白紫色:陈旧性纤维蛋白蓝色:细胞核黄色:红细胞2.Gram甲紫染色法蓝黑色:纤维蛋白红色:背景淀粉样物质染色1.刚果红染色法红色:淀粉样物质蓝色:细胞核2.Jurgens甲紫染色法红色或紫红色:淀粉样物质蓝色:细胞核真菌染色1.Grocott六胺银染色法*真菌均被着色黑褐色:菌丝和孢子红色:细胞核淡绿色:背景2.高碘酸复红染色法(1994年)紫红色:真菌浅黄色:红细胞细菌染色1.Gram碱性复红结晶紫染色法蓝色:革兰阳性菌红色:革兰阴性菌、细胞核2.Ziehl-Neelsen抗酸杆菌染色法红色:抗酸杆菌3.胃幽门螺杆菌棕黑色或黑色:胃幽门螺杆菌淡黄色:背景螺旋体染色1.Giemsa染色法蓝—淡紫色:螺旋体、细菌蓝色:细胞质橘黄色:红细胞2.Ryu碳酸钠碱性复红法红色:螺旋体病毒包涵体染色Macchiavello包涵体染色法乙型肝炎表面抗原染色1.Shikata地衣红染色法(1974年)棕色:HBsAg阳性2.醛复红改良染色法(1988年)紫色:乙型肝炎表面抗原阳性物质红色:结缔组织黄色:红细胞及基质3.维多利亚蓝染色法蓝绿色:乙型肝炎表面抗原物质红色:细胞核神经组织染色△神经细胞尼氏小体染色方法1.焦油紫(cresyl violet)染色法紫色:尼氏小体淡紫色:胶质细胞2.Einarson棓酸青蓝染色法黑蓝—紫色:尼氏小体蓝色:核浅灰色:背景3.甲苯胺蓝染色方法深蓝色:尼氏小体淡蓝色:细胞核无色:背景△神经纤维的染色方法1.Holmes神经纤维染色方法黑色:神经纤维灰紫色:背景2.Bielschowsky神经纤维染色方法黑色:神经纤维紫色:背景3.V on Braunmubl神经纤维、扣结、老年斑染色方法黑色:神经纤维、扣结、老年斑浅灰色:背景4.Eager退变神经纤维的染色方法黑色:退变神经纤维浅棕色:背景△神经髓鞘的染色方法1.Weigert—Pal髓鞘染色方法黑蓝色:髓鞘淡灰色:背景2.Weil髓鞘染色方法蓝黑色:髓鞘淡灰色:背景3.Kultshitzky髓鞘染色方法(Heidenhains改良法)蓝黑色:髓鞘淡黄色:背景4.Luxol fast blue髓鞘染色方法蓝色:髓鞘紫色:核仁、尼氏小体5.变色酸2R—亮绿髓鞘染色方法深红色:神经髓鞘绿色:轴索、间质不着色:脱髓鞘纤维6.Marchi退变髓鞘染色方法黑色:退变髓鞘浅棕色:背景△神经胶质细胞染色方法1.Cajal星形细胞染色方法(冷冻切片法)紫黑色:原浆性及纤维性星形细胞2.Naoumenko和Feigin改良的Cajal染色方法(石蜡切片法)黑紫色:星形细胞粉红色:背景3.Weil及Davenport小胶质细胞及少突胶质细胞染色方法黑色:神经胶质细胞、少突胶质细胞黄棕色:背景4.Naou menko及Feigin小胶质细胞石蜡切片染色方法黑色:小胶质细胞灰色:背景神经内分泌细胞染色△亲银反应1.Lillie—Masson二胺银反映法黑色:亲银颗粒细胞红色:细胞核灰黄色:背景ori—Burtner六胺银法黑色:亲银细胞浅红色:背景△嗜银反应1.De Grandi改良硝酸银反应法(1970年)棕黑色:嗜银细胞颗粒红色:细胞核2.碱性重氮反应法橘红色至红色:嗜银细胞颗粒蓝色:细胞核黄色:胞质嗜铬细胞染色1.Giemsa改良染色法红色至紫红色:嗜铬细胞蓝色:皮质细胞粉红色:红细胞2.Wiesel染色法黄绿色:嗜铬细胞质红色:细胞核蓝色:其他肥大细胞染色1.甲苯胺蓝改良染色法紫红色:肥大细胞颗粒蓝色:细胞核2.醛复红法深紫色:肥大细胞颗粒橘黄色:红细胞黄色:其他组织DNA染色1.酸水解—无色品红法紫红色:DNA绿色:细胞质、其他成分2.甲基绿—派洛宁法红紫色:细胞质和核仁内的核糖核酸(RNA)绿色或绿蓝色:细胞核染色质内的脱氧核糖核酸(DNA)脂肪染色苏丹Ⅲ—Mayer苏木精染色(冷冻切片)橘红色:中性脂肪蓝色:细胞核。
神经生物学实验讲义
神经⽣物学实验讲义实验⼀⿏脑灌注固定和取材⼀、原理固定是⽤⼈为的⽅法尽可能使组织细胞的形态结构和化学成分保持⽣活状态,防⽌组织细胞的溶解和腐败,并保持其原来的细微结构及原位保持⽣物活性物质的活性;能使细胞内蛋⽩质、脂肪、糖、等各种成分沉淀⽽凝固,尽量保持它原有的结构;使细胞内的成分产⽣不同的折射率,造成光学上的差异,使得原本在⽣活情况下看不清楚的结构,变得清晰可见;使得组织细胞各部经媒染作⽤容易染⾊;经过固定,使组织硬化,以利于以后切⽚时切薄⽚。
体循环:左⼼室→升主动脉→主动脉的各级分⽀→⽑细⾎管→各级静脉→上下腔静脉→右⼼房,完成体循环的整个循环。
⼆、实验步骤1、正常Sprague-Dawley⼤⿏,150~250g,或昆明⼩⿏,20g左右,雌雄不拘;2、动物⿇醉后,⽤左⼿持镊⼦夹起腹部⽪肤,右⼿持剪⼑⾃胸⾻剑突下腹部剪⼀⼩⼝,由此沿腹中线和胸⾻剑突中线向上将⽪肤剪⾄下颌,分离⽪下组织,将⽪肤翻向两侧,再沿腹中线和胸⾻中线向上剪开胸⾻,沿膈肌向两侧剪开,并⽤⽌⾎钳将胸⾻和胸部的⽪肤钳紧,将⽌⾎钳翻向外侧以充分暴露⼼脏,⼩⼼⽤镊⼦将⼼包膜打开;3、将灌注针(⼤⿏12#,⼩⿏7#)插⼊左⼼室并送⾄升主动脉内,⽤⽌⾎钳把灌注针固定在⼼脏上,打开灌注泵开关,同时剪开右⼼⽿,使⾎液排出。
先快速灌注0.9%NaCl(⼤⿏80-120ml,⼩⿏30ml),⾄肝脏逐渐变⽩⾊或右⼼⽿流出清亮液体为⽌,再灌注4℃预冷的固定液(⼤⿏200ml,⼩⿏50ml,根据动物体重定量),其中前1/3量快速灌注,后2/3量慢灌注,共在30分钟内灌注完;4、固定液进⼊⾎管后,⼤⿏四肢和尾巴开始抽动,表明灌注液进⼊⼤⿏⼤脑,待抽动完全停⽌,全⾝组织器官变硬后即可停⽌灌注;5、断头后,剥离颅⾻、剪断脑神经、离断脑于脊髓,取出整脑。
6、后固定(post-fixed):剥出⿏脑后,切取含⽬的区域的脑段,放⼊相同固定液4~12h,4℃。
附4%多聚甲醛的配制:40g多聚甲醛⽤0.1mol/L PB(pH7.4)溶解后定容⾄1L,过滤后置于4℃保存。
易误诊的脱髓鞘假瘤10例临床分析

易误诊的脱髓鞘假瘤10例临床分析(作者:___________单位: ___________邮编: ___________)【摘要】目的探讨脱髓鞘假瘤的误诊原因及鉴别诊断。
方法回顾性分析临床疑为脑占位病变而病理诊断脱髓鞘病、或者临床考虑脱髓鞘病而病理不支持或诊断脑肿瘤的10例病例的临床病史、辅助检查、影像学资料以及组织病理学表现,并行α1AT、CD3、CD20、CD45RO、CD68、CD79α、κ、λ、GFAP、NF和Vimentin免疫组织化学染色以及PAS、髓鞘(LFB)和轴突组织化学染色。
结果临床主要表现为头痛、肢体抽搐、意识障碍、言语不能和视物模糊,腱反射活跃;5例脑脊液潘氏试验阳性;4例脑电图弥散性θ波增多。
MRI 表现为不完全的环形增强和明显占位效应的增强肿块,周围脑实质水肿,相邻脑室受压,2例累及胼胝体。
组织病理学检查显示胶质细胞增生,多量单核巨噬细胞浸润,病变中央坏死,淋巴细胞血管套结构。
组织化学染色可见髓鞘脱失,单核巨噬细胞吞噬髓鞘,轴突仍保存。
免疫组织化学染色反应性胶质细胞GFAP阳性,大部分淋巴细胞CD3和CD45RO阳性,单核巨噬细胞α1ACT、CD68阳性。
结论不典型临床表现的脱髓鞘假瘤诊断应结合临床病史、实验室检查、影像学和病理学特点综合分析,避免误诊。
【关键词】脱髓鞘疾病脑肿瘤磁共振成像病理学诊断鉴别中枢神经系统脱髓鞘假瘤也称为瘤块样脱髓鞘病(tumefactive demyelinating lesion,TDL),不是一种真性的肿瘤,而是一种特殊类型的炎性疾病,临床表现为脑实质占位和神经系统功能缺损,影像学表现为伴有瘤周水肿的占位性效应,常被误诊而进行手术。
病理活检取材局限时诊断困难。
笔者回顾性分析2000年9月~2007年1月10例脱髓鞘病的临床病史、辅助检查结果、影像学资料、组织病理学表现以及免疫组织化学、组织化学染色特点,旨在进一步提高脱髓鞘病(假瘤)的诊断水平。
髓鞘染色操作步骤 5.9

髓鞘染色操作步骤Reagent:Luxol fast blue MBS(solvent blue 38),Alcohol,Lithium carbonate,Glacial acetic acid,试剂:Luxol 固蓝MBS(solvent blue 38),乙醇,碳酸锂,冰醋酸,Section:15-25 um切片:15-25umsolutions溶液1 0.1% Luxol fast blue solution:1 0.1% 固蓝溶液Luxol fast blue MBS(solvent blue 38)0.1 g固蓝0.1 gEthyl Alcohol,95% 100 ml95% 乙醇100 mlGlacial acetic acid 0.02 ml冰醋酸0.02 ml取固蓝0.1g 加入95%乙醇,在温度50-60℃条件下,于磁力搅拌器中搅拌,用10冰乙酸调PH至4.3。
2 0.05% Lithium carbonate solution:2 0.05%碳酸锂溶液Lithium carbonate 0.05 g碳酸锂0.05 gDistilled water 100 ml去离子水100 ml充分混均。
备注:此液需经常更换。
3 0.1%cresyl violet acetate solution0.1%甲苯粉紫溶液cresyl violet acetate 0.1g甲苯粉紫0.1gDistilled water 100ml去离子水100mLAcetic acid 0.1mL冰乙酸0.1mLMeasure 0.1g cresyl violet acetate ,add to 100mL distilled water and stir until it is dissolved,add to 0.1mL acetic acid make PH to 3.7.This solution should be prepared 16-20h prior to use.称取0.1甲苯粉紫醋酸盐粉末,加100ml去离子水搅拌至完全溶解,加入0.1ml冰乙酸,调节ph至3.7。
lfb染色原理

lfb染色原理
LFB染色是指利用卢戈氏液(Lugol's fluid)、富马酸(fumaric acid)和伊红(eosin)等染料来染色生物组织中脂质物质的一种方法,也称为Lugol染色或Lugol-Iodine染色。
LFB染色的原理是利用卢戈氏液中的碘离子与脂肪酸甘油酯等脂质物质中的双键和三键结合,形成深棕色的碘化物。
在加入富马酸后,碘化物被还原为无色物质,而未被染色的其他物质则保持不变。
最后,再用伊红染色,使脂质物质呈现出红色,而其他物质则呈现出不同的颜色。
LFB染色主要用于神经组织和髓鞘的染色,可以清晰地显示出髓鞘中的脂质物质。
在神经科学研究中,LFB染色被广泛应用于研究多种疾病,如多发性硬化症、白质脑病等,以及神经退行性疾病。
总之,LFB染色是一种简单而有效的染色方法,可用于显示生物组织中的脂质物质,有助于深入研究神经系统相关疾病的机制和治疗方法。
熊果酸对小鼠坐骨神经损伤后神经功能恢复作用及PSD-95蛋白表达的影响

*通讯作者文章编号:1007-4287(2019)04-0696-04熊果酸对小鼠坐骨神经损伤后神经功能恢复作用及PSD-95蛋白表达的影响曹 剑,张丽敏*(赤峰学院附属医院,内蒙古赤峰024000)摘要:目的 探讨BALB/c小鼠坐骨神经损伤后应用熊果酸后对坐骨神经PSD-95蛋白表达变化及神经髓鞘形态学变化。
方法 健康成年BALB/c小鼠320只,单侧坐骨神经切断吻合后,随机分组给药,不同时间获取坐骨神经损伤段,用Real time-PCR检测坐骨神经损伤段PSD-95蛋白的表达变化,同时进行髓鞘LFB染色观察坐骨神经的恢复情况。
结果 Realtime-PCR结果显示高剂量和中剂量组12h,24h,3d,5d,1w,2w,4w,PSD-95表达量明显低于低剂量组和空白对照组,8w各组比较无明显差异。
LFB染色表明高中剂量组坐骨神经恢复情况明显优于低剂量组和对照组。
结论 坐骨神经损伤后应用熊果酸对坐骨神经损伤段细胞中PSD-95的活化起到抑制作用,为神经损伤后再生及修复提供有利的内环境。
关键词:周围神经;损伤修复;PSD-95蛋白;再生中图分类号:R651.3文献标识码:AEffects of ursolic acid on recovery of nerve function and expression of PSD-95protein after sciatic nerve injury in mice CAO Jian,ZHANG Li-min.(Affiliated Hospital of Chifeng University,Chifeng024000,China)Abstract:Objective To investigate the changes of SPD-95protein expression and nerve myelin sheath morphologyin BALB/c mice after sciatic nerve injury treated with ursolic acid.Methods 320healthy adult BALB/c mice were ran-domly assigned to receive the drug after unilateral sciatic nerve anastomosis.The injured sciatic nerve segment was ob-tained at different times.The changes in the expression of the protein PSD-95in the injured sciatic nerve segment weredetected by Real-time PCR,and the recovery of the sciatic nerve was observed by myelin sheath LFB staining.Results Realtime-PCR results showed that the expression levels of PSD-95in the high-dose group and the medium-dose groupwere significantly lower than those in the low-dose group and the blank control group at 12h,24h,3d,5d,1w,2w,4w,and 8w,respectively.LFB staining showed that the recovery of sciatic nerve in the high dose group was signifi-cantly better than that in the low dose group and the control group.Conclusion After sciatic nerve injury,ursolic acidcan inhibit the activation of PSD-95in sciatic nerve injured cells,reduce the infiltration of inflammatory cells and thuspromote nerve regeneration.Key words:sciatic nerve;injury repair;PSD-95protein;nerve regeneration(Chin J Lab Diagn,2019,23:0696) 本实验制作小鼠周围神经损伤模型,应用熊果酸(ursolic acid,UA)进行干预,观察神经损伤后PSD95蛋白表达的变化及髓鞘的形态学变化,分析二者的相关性,探讨神经损伤后熊果酸对损伤后修复与再生的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
LFB髓鞘染色
一、LFB髓鞘染色实验简介
劳克坚牢蓝(LuxolFastBlueLFB)属于铜-酞箐染料,在酒精溶液中具有与髓鞘磷脂结合的染色特性。
应用LFB髓鞘染色可以很好地显示出神经组织的髓鞘结构。
二、染色步骤
1、切片经蒸馏水清洗后,入0.1% LFB溶液,于60℃密封浸染8-16h
2、经蒸馏水清洗后,入95%酒精
3、以0.05%碳酸锂水溶液分色10s以上
4、经70%酒精继续分色,直至显微镜下观察灰、白质区分清晰为止
5、蒸馏水洗片后,用0.25%焦油紫溶液加数滴冰醋酸染液复染10min
6、70%酒精将复染颜色分至细胞核及尼氏体呈红色
三、样本说明
1、石蜡切片
取材:1、组织离体后需及时固定;2、组织标本不宜过大、过厚。
固定:1、固定液:10%福尔马林(4%多聚甲醛)或10%中性甲醛;2、用量:一般固定液的量与组织体积比为10:1~20:1;3、固定:适宜的固定时间,主要根据材料的大小、松密程度及固定液的穿透速度而定。
保存:切片经60℃烤片3-5小时后,可于常温或4℃干燥保存。
2、冰冻切片
取材:取材后需立即置于超低温冰箱或液氮中保存。
固定:样本冰冻切片后,应立即放入甲醇、丙酮、95%酒精、4%多聚甲醛等固定液中固定。
保存:固定好的切片自然风干,密封后置于-80℃、-20℃保存,尽快用于后续实验。
3、细胞块石蜡切片
细胞量较多的样品,可离心分离所需细胞,用中性甲醛固定后制作成琼脂细胞块,然后按照制作石蜡切片的操作流程进行切片。
4、细胞爬片
在孔板里做的细胞爬片,爬片取出后,用PBS洗涤2次(根据研究目的,PBS洗涤可选择不做),用4%多聚甲醛4℃固定15分钟,将表面液体吹干,置于-20℃保存。
若在短时间内即
开展实验,可在加固定液后,于4℃冰箱中放置一段时间。
5、细胞涂片细胞涂片常用的固定液有95%酒精(最为常用)、酒精-冰醋酸液、乙醚-酒精液和Carney’s液等。
四、注意事项
1、常用的固定液为中性甲醛和4%多聚甲醛,能使大多数抗原保存良好,适用于免疫组织化学。
2、病理实验切片最好是防脱片,以免实验过程中出现掉片。
若客户提供切片,应告知切片有无防脱处理。
3、骨组织、皮肤组织或脂肪含量较高的样本,实验过程中有较高的掉片几率。
4、客户可提供组织块(以10%福尔马林、4%多聚甲醛或10%中性甲醛固定,如组织块极小请事先说明)、蜡块或切片(使用免疫组化专用切片,以避免实验过程中掉片)
5、待检测蛋白的种属、实验分组情况及实验背景资料、其他具体要求等需事先说明。
6、若客户提供骨组织或钙化程度较高的组织进行实验,需进行脱钙处理。
7、浸泡在固定液中的组织样本,在运输中容器需密封,防止破碎、渗漏。
