β内酰胺类抗生素β内酰胺酶抑制剂合剂临床应用专家共识
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)

β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)一、概述革兰阴性菌及少数革兰阳性菌对β-内酰胺类抗生素耐药的最重要机制是产生各种β-内酰胺酶。
β-内酰胺酶抑制剂能够抑制部分β-内酰胺酶,避免β-内酰胺类抗生素被水解而失活。
因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂(简称β-内酰胺酶抑制剂复方制剂)是临床治疗产β-内酰胺酶细菌感染的重要选择。
我国临床使用的β-内酰胺酶抑制剂复方制剂的种类和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。
二、主要β-内酰胺酶及产酶菌流行情况β-内酰胺酶是由细菌产生的,能水解β-内酰胺类抗生素的一大类酶。
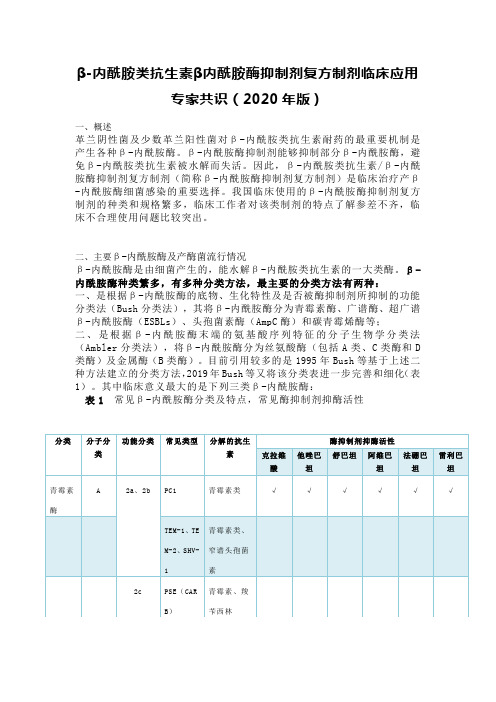
β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种:一、是根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),其将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶(ESBLs)、头孢菌素酶(AmpC酶)和碳青霉烯酶等;二、是根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶(包括A类、C类酶和D 类酶)及金属酶(B类酶)。
目前引用较多的是1995年Bush等基于上述二种方法建立的分类方法,2019年Bush等又将该分类表进一步完善和细化(表1)。
其中临床意义最大的是下列三类β-内酰胺酶:表1 常见β-内酰胺酶分类及特点,常见酶抑制剂抑酶活性1、ESBLs主要属2be\2br\2ber类酶,是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M 型、OXA型和其他型共5大类型。
2、AmpC酶属C类酶,通常由染色体介导,可以被β-内酰胺类抗生素诱导。
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识

β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)一、概述革兰阴性菌及少数革兰阳性菌对β-内酰胺类抗生素耐药的最重要机制是产生各种β-内酰胺酶。
β-内酰胺酶抑制剂能够抑制部分β-内酰胺酶,避免β-内酰胺类抗生素被水解而失活。
因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂(简称β-内酰胺酶抑制剂复方制剂)是临床治疗产β-内酰胺酶细菌感染的重要选择。
我国临床使用的β-内酰胺酶抑制剂复方制剂的种类和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。
二、主要β-内酰胺酶及产酶菌流行情况β-内酰胺酶是由细菌产生的,能水解β-内酰胺类抗生素的一大类酶。
β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种:一、是根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),其将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶(ESBLs)、头孢菌素酶(AmpC酶)和碳青霉烯酶等;二、是根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler 分类法),将β-内酰胺酶分为丝氨酸酶(包括A类、C类酶和D类酶)及金属酶(B类酶)。
目前引用较多的是1995年Bush等基于上述二种方法建立的分类方法,2019年Bush等又将该分类表进一步完善和细化(表1)。
其中临床意义最大的是下列三类β-内酰胺酶:表1常见β-内酰胺酶分类及特点,常见酶抑制剂抑酶活性1、ESBLs主要属2be\2br\2ber类酶,是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M型、OXA型和其他型共5大类型。
2、AmpC酶属C类酶,通常由染色体介导,可以被β-内酰胺类抗生素诱导。
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)一、概述革兰阴性菌及少数革兰阳性菌对β-内酰胺类抗生素耐药的最重要机制是产生各种β-内酰胺酶。
β-内酰胺酶抑制剂能够抑制部分β-内酰胺酶,避免β-内酰胺类抗生素被水解而失活。
因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂(简称β-内酰胺酶抑制剂复方制剂)是临床治疗产β-内酰胺酶细菌感染的重要选择。
我国临床使用的β-内酰胺酶抑制剂复方制剂的种类和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。
二、主要β-内酰胺酶及产酶菌流行情况β-内酰胺酶是由细菌产生的,能水解β-内酰胺类抗生素的一大类酶。
β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种:一、是根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),其将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶(ESBLs)、头孢菌素酶(AmpC酶)和碳青霉烯酶等;二、是根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶(包括A类、C类酶和D 类酶)及金属酶(B类酶)。
目前引用较多的是1995年Bush等基于上述二种方法建立的分类方法,2019年Bush等又将该分类表进一步完善和细化(表1)。
其中临床意义最大的是下列三类β-内酰胺酶:表1 常见β-内酰胺酶分类及特点,常见酶抑制剂抑酶活性素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M 型、OXA型和其他型共5大类型。
2、AmpC酶属C类酶,通常由染色体介导,可以被β-内酰胺类抗生素诱导。
部分由质粒介导,常呈持续高水平表达。
内酰胺类抗生素内酰胺酶抑制剂合剂临床应用专家共识

内酰胺类抗生素内酰胺酶抑制剂合剂临床应用专家共识一、本文概述《内酰胺类抗生素内酰胺酶抑制剂合剂临床应用专家共识》旨在汇集国内外关于内酰胺类抗生素与内酰胺酶抑制剂合剂在临床应用中的最新研究成果和实践经验,为临床医生提供科学、规范、实用的用药指导。
内酰胺类抗生素是一类具有广泛应用价值的抗菌药物,而内酰胺酶抑制剂则能够增强抗生素的疗效,减少耐药性的产生。
本文将从合剂的临床应用、作用机制、适应症、用法用量、不良反应、药物相互作用等方面进行全面深入的探讨,以期为广大临床医生提供有益的参考和借鉴。
本文也期望能够促进内酰胺类抗生素与内酰胺酶抑制剂合剂在临床实践中的合理应用,提高抗生素的治疗效果,降低耐药性的风险,保障患者的用药安全。
二、内酰胺类抗生素概述内酰胺类抗生素,也称为β-内酰胺类抗生素,是一类广泛应用于临床的抗菌药物。
这类药物的主要作用机制是通过抑制细菌细胞壁的合成,从而达到杀菌或抑菌的目的。
β-内酰胺类抗生素主要包括青霉素类、头孢菌素类、碳青霉烯类、单环β-内酰胺类等多个亚类。
自首个内酰胺类抗生素青霉素问世以来,这类药物在感染性疾病的治疗中发挥了重要作用。
随着药物研发的深入,新型的内酰胺类抗生素不断涌现,其抗菌谱更广,对耐药菌的活性更强,不良反应也更少。
然而,随着抗生素的广泛使用,细菌对内酰胺类抗生素的耐药性也逐渐增强,这成为了全球公共卫生面临的一大挑战。
为了应对这一挑战,研究人员在开发新型内酰胺类抗生素的同时,也在探索如何通过联合用药、优化治疗方案等方式,提高内酰胺类抗生素的临床治疗效果。
内酰胺类抗生素酶抑制剂合剂的出现,为解决这一问题提供了新的思路。
酶抑制剂能够抑制细菌产生的β-内酰胺酶,从而保护内酰胺类抗生素免受水解失活,增强抗生素的抗菌活性。
通过合理的合剂组合,可以进一步拓宽内酰胺类抗生素的抗菌谱,提高其对耐药菌的治疗效果。
因此,对于内酰胺类抗生素及其酶抑制剂合剂的临床应用,需要制定科学、规范的专家共识,以指导临床医师合理、有效地使用这些药物,提高治疗效果,减少耐药性的发生,保障患者的用药安全。
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)

3-内酰胺类抗生素B内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)一、概述革兰阴性菌及少数革兰阳性菌对3 -内酰胺类抗生素耐药的最重要机制是产生各种3 -内酰胺酶。
3 -内酰胺酶抑制剂能够抑制部分3 -内酰胺酶,避免3 -内酰胺类抗生素被水解而失活。
因此,3 -内酰胺类抗生素/ 3-内酰胺酶抑制剂复方制剂(简称3 -内酰胺酶抑制剂复方制剂)是临床治疗产3 -内酰胺酶细菌感染的重要选择。
我国临床使用的3 -内酰胺酶抑制剂复方制剂的种类和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。
二、主要3-内酰胺酶及产酶菌流行情况3-内酰胺酶是由细菌产生的,能水解3 -内酰胺类抗生素的一大类酶。
3-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种:一、是根据3 -内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),其将3 -内酰胺酶分为青霉素酶、广谱酶、超广谱3-内酰胺酶(ESBLs)、头抱菌素酶(AmpC酶)和碳青霉烯酶等;二、是根据3-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将3 -内酰胺酶分为丝氨酸酶(包括A类、C类酶和D类酶)及金属酶(B类酶)。
目前引用较多的是1995年Bush等基于上述二种方法建立的分类方法,2019年Bush等又将该分类表进一步完善和细化(表1)。
其中临床意义最大的是下列三类3 -内酰胺酶:表1常见B-内酰胺酶分类及特点,常见酶抑制剂抑酶活性1、E SBLs主要属2be\2br\2ber 类酶,是由质粒介导的能水解青霉素类、头抱菌素及单环酰胺类等B -内酰胺类抗生素的B -内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M型、OXA型和其他型共5大类型。
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020版)

β-内酰胺类抗生素β 内酰胺酶抑制剂复方制剂临床应用专家共识( 2020 年版)一、概述革兰阴性菌及少数革兰阳性菌对β-内酰胺类抗生素耐药的最重要机制是产生各种β-内酰胺酶。
β-内酰胺酶抑制剂能够抑制部分β-内酰胺酶,避免β-内酰胺类抗生素被水解而失活。
因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂(简称β-内酰胺酶抑制剂复方制剂)是临床治疗产β-内酰胺酶细菌感染的重要选择。
我国临床使用的β-内酰胺酶抑制剂复方制剂的种类和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。
二、主要β-内酰胺酶及产酶菌流行情况β-内酰胺酶是由细菌产生的,能水解β-内酰胺类抗生素的一大类酶。
β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种:一、是根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法( Bush 分类法),其将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶( ESBLs)、头孢菌素酶( AmpC 酶)和碳青霉烯酶等;二、是根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler 分类法),将β-内酰胺酶分为丝氨酸酶(包括 A 类、C 类酶和D 类酶)及金属酶( B 类酶)。
目前引用较多的是 1995 年 Bush 等基于上述二种方法建立的分类方法,2019 年Bush 等又将该分类表进一步完善和细化(表1)。
其中临床意义最大的是下列三类β-内酰胺酶:表 1 常见β-内酰胺酶分类及特点,常见酶抑制剂抑酶活性1、ESBLs 主要属 2be\2br\2ber 类酶,是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
ESBLs 主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
根据编码基因的同源性,ESBLs 可分为 TEM 型、SHV 型、CTX-M 型、OXA 型和其他型共 5 大类型。
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)

β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)一、概述革兰阴性菌及少数革兰阳性菌对β-内酰胺类抗生素耐药的最重要机制是产生各种β-内酰胺酶。
β-内酰胺酶抑制剂能够抑制部分β-内酰胺酶,避免β-内酰胺类抗生素被水解而失活。
因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂(简称β-内酰胺酶抑制剂复方制剂)是临床治疗产β-内酰胺酶细菌感染的重要选择。
我国临床使用的β-内酰胺酶抑制剂复方制剂的种类和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。
二、主要β-内酰胺酶及产酶菌流行情况β-内酰胺酶是由细菌产生的,能水解β-内酰胺类抗生素的一大类酶。
β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种:一、是根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),其将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶(ESBLs)、头孢菌素酶(AmpC酶)和碳青霉烯酶等;二、是根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶(包括A类、C类酶和D 类酶)及金属酶(B类酶)。
目前引用较多的是1995年Bush等基于上述二种方法建立的分类方法,2019年Bush等又将该分类表进一步完善和细化(表1)。
其中临床意义最大的是下列三类β-内酰胺酶:表1 常见β-内酰胺酶分类及特点,常见酶抑制剂抑酶活性1、ESBLs主要属2be\2br\2ber类酶,是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M型、OXA型和其他型共5大类型。
2、AmpC酶属C类酶,通常由染色体介导,可以被β-内酰胺类抗生素诱导。
抗菌药物概论(β-内酰胺类药物)

不良反应:胃肠道反应多见、过敏反应(皮疹多见)、二重感染等
◆ 抗铜绿作用:哌拉西林>美洛西林、替卡西林>羧苄西林 ◆ 临床常用:哌拉西林/他唑巴坦、替卡西林/克拉维酸的复合制剂
β-内酰胺类
分类
青霉烯类 (法罗培南)
03
典型β-内酰胺类
典型β-内酰胺类
青霉素类药物
天然青霉素类
耐酶青霉素类
广谱青霉素类
抗假单胞菌 青霉素类
青霉素G 青霉素V 普鲁卡因青霉素 苄星青霉素
抗菌谱几乎一致 但各有特点
甲氧西林 苯唑西林 奈夫西林 双氯西林
临床较少使用
氨苄西林 阿莫西林
口服吸收好; 抗菌谱广,临床应用多
抗菌谱并不一致
用法用量、 疗程不适宜
• 门诊患者20岁男 性,咳嗽、发热, 诊断CAP
• 初始治疗方案首 选头孢他啶2g ivd q8h
• 头孢曲松2g q12h常规使用
• 青霉素类qd使 用
• 疗程从入院到出 院
未能正确认识 过敏、交叉过敏
• 青霉素过敏(不 具体询问何时过 敏,皮试还是输 液过敏,是不是 过敏,严重程度)
典型β-内酰胺类
天然青霉素
共性
抗菌谱:对G+球菌(链球菌、敏感葡萄球菌、粪肠球菌)有效 对G-球菌(脑膜炎球菌)作用强 对白喉杆菌、李斯特菌、螺旋体和部分拟杆菌有作用
药动学:t1/2短,建议一日多次给药; 大部分原型经肾脏排出,中重度肾功能不全酌情减量 青霉素G可透过血脑屏障(BBB)
临床应用:敏感菌所致的上下呼吸道感染、皮肤软组织感染等 钩端螺旋体病、梅毒等首选药物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识一、概述革兰阴性菌是我国细菌感染性疾病最常见的病原体。
近年来,革兰阴性菌对β-内酰胺类抗生素的耐药性不断增加,最重要的耐药机制是细菌产生各种β-内酰胺酶。
β-内酰胺酶抑制剂能够抑制大部分β-内酰胺酶,恢复β-内酰胺类抗生素的抗菌活性。
因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂在临床抗感染中的地位不断提升,已成为临床治疗多种耐药细菌感染的重要选择。
目前我国临床使用的β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的种类和规格繁多,临床医师对该类合剂的特点了解不够,临床不合理使用问题较突出。
为规范β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的临床应用,延缓其耐药性的发生和发展,特制定本共识。
二、主要β-内酰胺酶及β-内酰胺酶抑制剂β-内酰胺酶是由细菌产生的能水解β-内酰胺类抗生素的一大类酶。
β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶、头孢菌素酶和碳青霉烯酶等;根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶和金属酶。
目前引用较多的是基于上述2种方法建立的分类方法。
见表1。
表1:β-内酰胺酶的分类和3种主要酶抑制剂的作用功能分类分子分型主要底物可被抑制代表性酶克拉维酸舒巴坦他唑巴坦1 C 头孢菌素类- - - AmpC,ACT-1,CMY-2,FOX-1,MIR-1 2a A 青霉素类+ + + 青霉素酶2b A 青霉素类,窄谱头孢菌素类+ + + TEM-1,TEM-2,SHV-12be A 青霉素类,超广谱头孢菌素类,单环酰胺类+ + + TEM-3,SHV-2,CTX-M-15,PER-1,VER-1 2br A 青霉素类- - - TEM-30,SHV-10,TRC-12ber A 超广谱头孢菌素类,单环酰胺类- - - TEM-502c A 青霉素类,羧苄西林+ + + PSE-1,CARB-32d D 青霉素类,氯唑西林±±±OXA-1, OXA-102df D 碳青霉烯类±±±OXA-23, OXA-482e A 超广谱头孢菌素类+ + + CepA2f A 碳青霉烯类±±±KPC-2,IMI-1,NMC-A,SME-1 3 B β-内酰胺类(不包括氨曲南)- - - IMP-1,VIM-1,NDM-1,L1,CcrA(注:“+”示有抑制作用,“±”示抑制作用不明确,“-”示无抑制作用)超广谱β-内酰胺酶(ESBLs)是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
这类酶可被β-内酰胺酶抑制剂如克拉维酸、舒巴坦及他唑巴坦等抑制。
ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
到目前为止,全世界共发现了200余种ESBLs。
根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M型、OXA型和其他型共5大类型。
头孢菌素酶(AmpC酶)通常是由染色体介导,对第一、二、三代头孢菌素水解能力强,但其对碳青酶烯类抗生素和第四代头孢菌素的水解能力弱,克拉维酸钾不能抑制其活性,他唑巴坦和舒巴坦有部分抑酶作用,氯唑西林抑制头孢菌素酶作用强。
该酶主要存在于肠杆菌属、柠檬酸杆菌属、普鲁菲登菌属、粘质沙雷菌属和摩根菌属等细菌。
染色体介导的头孢菌素酶可以被β-内酰胺类抗生素诱导和选择。
近年来,质粒介导的头孢菌素酶陆续被报道,主要出现于肺炎克雷伯菌、大肠埃希菌及沙门菌属细菌中,常呈持续高水平表达,可通过质粒广泛传播。
根据其与染色体介导的头孢菌素酶的同源性,可分为CMY-2组、CMY-1组、MIR-1/ACT-1组、DHA-1组和ACC-1组等。
碳青霉烯酶是指能水解碳青霉烯类抗生素的一大类β-内酰胺酶,分别属于Ambler 分子分类中的A类、B类和D类酶。
A类、D类为丝氨酸酶,B类为金属酶,以锌离子为活性中心。
A类碳青霉烯酶可以由染色体介导,也可由质粒介导,前者包括SME、NMC和IMI 酶等,后者包括KPC和GES酶等。
KPC酶是近年来肠杆菌科细菌尤其是肺炎克雷伯菌对包括碳青霉烯类抗生素在内的几乎所有β-内酰胺类抗生素耐药的最主要机制,我国最常见的是KPC-2,其对头孢吡肟和头孢他啶的水解能力较弱。
A类碳青霉烯酶可部分被克拉维酸所抑制,但不被乙二胺四乙酸(EDTA)所抑制。
D类碳青霉烯酶(OXA酶)对苯唑西林水解活性强,主要见于不动杆菌属细菌。
包括OXA-23、OXA-24/OXA-40、OXA-48、OXA-58和OXA-51酶等。
目前临床应用的酶抑制剂对其没有很好的抑制作用,且不同OXA酶对碳青霉烯类抗生素水解活性不同,β-内酰胺酶抑制剂的抑酶活性也不同。
B类碳青霉烯酶(金属酶)能灭活青霉素类、头孢菌素类、碳青霉烯类抗生素,但对氨曲南水解活性弱,不能被β-内酰胺酶抑制剂所抑制,可被EDTA或巯基类化合物抑制。
常见于铜绿假单胞菌、不动杆菌属细菌和肠杆菌科细菌,包括IMP、VIM、GIM、SPM、SIM、NDM酶等。
β-内酰胺酶抑制剂能抑制细菌产生的大部分β-内酰胺酶,常与β-内酰胺类抗生素联合使用,能使抗生素中的β-内酰胺环免遭水解,保护β-内酰胺类抗生素的抗菌作用。
临床上常用的β-内酰胺酶抑制剂主要有:克拉维酸、舒巴坦、他唑巴坦,三者均含有β-内酰胺环结构,为不可逆竞争性抑制剂。
β-内酰胺酶抑制剂的出现很大程度上解决了β-内酰胺类抗生素的耐药问题(表1)。
三、主要β-内酰胺酶的流行情况CHINET耐药监测网和国家卫计委细菌耐药监测网的数据显示,近8年来我国ESBLs 在大肠埃希菌的发生率在50%~60%,大肠埃希菌所产ESBLs基因型90%以上为CTX-M 型,各地区产ESBLs大肠埃希菌CTX-M型分布有一定差异。
产ESBLs大肠埃希菌对碳青霉烯类抗生素、头孢哌酮/舒巴坦和哌拉西林/他唑巴坦的耐药率均低于15%。
肺炎克雷伯菌产生的ESBLs基因型情况与大肠埃希菌相似,以CTX-M型为主。
据国家卫计委细菌耐药监测网分析,2013年我国各地区肺炎克雷伯菌的ESBLs检出率介于15.9%~46.7%,而CHINET监测16家三甲医院2013年肺炎克雷伯菌ESBLs检出率为31.8%。
产ESBLs 肺炎克雷伯菌对亚胺培南、头孢哌酮/舒巴坦和哌拉西林/他唑巴坦的耐药率分别为6.0%、17.8%和23.5%。
据2013年CHINET耐药监测网数据显示,肺炎克雷伯菌对碳青霉烯类抗生素耐药超过10.0%。
我国肠杆菌科中流行的碳青霉烯酶为KPC-2,在大肠埃希菌、肺炎克雷伯菌、粘质沙雷菌、奇异变形杆菌等等肠杆菌科细菌中均有发现,流行地区包括浙江、上海、江苏、湖南、北京、山东等多个省市。
由于产KPC-2的菌株常常同时产生ESBLs和(或)AmpC酶,甚至同时合并有外膜蛋白缺失,常表现为广泛耐药或全耐药。
CHINET近5年数据显示,我国碳青霉烯类抗生素耐药鲍曼不动杆菌检出率从2008年的49.3%上升至2013年的62.8%,产碳青霉烯酶OXA-23是介导鲍曼不动杆菌对碳青霉烯类抗生素耐药的主要机制。
四、主要β-内酰胺酶的检测及耐药表型根据不同β-内酰胺酶水解底物范围、活性及对酶抑制剂抑酶活性的差异,建立了多种β-内酰胺酶表型检测方法,其对临床合理选用抗菌药物有重要的参考价值,但其检测结果易受多种因素的影响,必要时可采用生物分子学技术进一步确认酶的类型。
1. ESBLs的检测:目前实验室通常采用CLSI推荐的ESBLs初筛和表型确证试验,也可采用三维试验、Etest条、双纸片协同试验、自动化仪器等。
ESBLs种类繁多,耐药表型不一,国内大肠埃希菌和克雷伯菌中主要流行CTX-M型,通常对头孢噻肟和头孢曲松耐药,部分菌株可对头孢他啶体外敏感,对碳青霉烯类抗生素、含酶抑制剂复合制剂头孢哌酮/舒巴坦钠和哌拉西林/他唑巴坦敏感率高。
2. AmpC酶的检测:实验室没有常规开展AmpC酶的检测,其检测方法主要有头孢西丁三维试验、AmpC酶纸片法、头孢西丁琼脂法等,也可以硼酸(30ug/ml)为抑制剂,采用类似于美国临床和试验标准化委员会(CLSI)推荐的ESBLs检测方法和判断标准。
产AmpC酶菌株的典型耐药表型为头孢吡肟敏感、头孢西丁耐药,部分菌株可同时产ESBLs,造成第四代头孢菌素头孢吡肟耐药,仅对碳青霉烯类抗生素敏感。
克拉维酸与三代头孢菌素或氨曲南对产头孢菌素酶细菌无协同作用。
3.碳青霉烯酶的检测:碳青霉烯酶的表型检测方法主要有两种:改良Hodge试验和EDTA协同试验。
改良Hodge试验不能区分碳青霉烯酶类型,主要用于检测肠杆菌科细菌中的碳青霉烯酶,对KPC酶灵敏度较和特异性较高,对金属酶会出现假阴性,菌株如高产ESBLs或AmpC酶合并外膜孔蛋白丢失,改良Hodge试验也会出现假阳性。
EDTA 协同试验用于检测金属酶,以EDTA作为抑制剂,美罗培南或亚胺培南作为指示药物,采用类似于CLSI推荐的ESBLs检测方法和判断标准。
产碳青霉烯酶菌株往往对碳青霉烯类抗生素耐药,对目前临床使用的含酶抑制剂复合制剂、广谱头孢菌素也常表现为耐药。
五、β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的组成原则β-内酰胺类抗生素与/β-内酰胺酶抑制剂组成合剂必须考虑组方和配比的合理性。
基本组成原则如下:(1)β-内酰胺类抗生素与/β-内酰胺酶抑制剂的药代动力学特征基本吻合,如消除半衰期相近和分布相似,两者在体内的有效浓度能共同维持足够的作用时间,以发挥更好的协同杀菌效果。
(2)β-内酰胺类抗生素与酶抑制剂组方后毒理学试验表明合剂与单药相比毒性未显着增加,并且临床研究结果显示联合后不良反应无明显增加。
(3)母体和酶抑制剂均需适当剂量。
在已上市的β-内酰胺类抗生素与/β-内酰胺酶抑制剂合剂基础上增加新配比的品种,必须有充足理由说明现有配比不能完全满足临床需要,临床前和临床研究结果证明新配比合剂与已上市配比合剂相比,在有效性或安全性上具有临床价值的明显优势和(或)新配比合剂有特殊适应症范围等。
目前国内外临床上应用的主要β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂包括:(1)阿莫西林/克拉维酸(针剂5:1,口服4:1或2:1);(2)替卡西林/克拉维酸(15:1);(3)氨苄西林/舒巴坦(2:1);(4)头孢哌酮/舒巴坦(2:1或1:1);(5)哌拉西林/他唑巴坦(8:1)。
