氮在自然界中的存在方式及绪论..共88页
氮的知识点总结
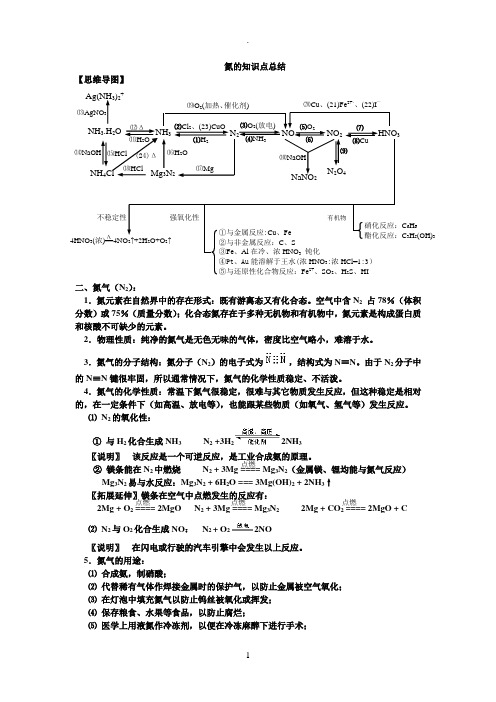
氮的知识点总结【思维导图】二、氮气(N 2):1.氮元素在自然界中的存在形式:既有游离态又有化合态。
空气中含N 2 占78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素。
2.物理性质:纯净的氮气是无色无味的气体,密度比空气略小,难溶于水。
3.氮气的分子结构:氮分子(N 2)的电子式为,结构式为N ≡N 。
由于N 2分子中的N ≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
4.氮气的化学性质:常温下氮气很稳定,很难与其它物质发生反应,但这种稳定是相对的,在一定条件下(如高温、放电等),也能跟某些物质(如氧气、氢气等)发生反应。
⑴ N 2的氧化性:① 与H 2化合生成NH 3 N 2 +3H 22NH 3〖说明〗 该反应是一个可逆反应,是工业合成氨的原理。
② 镁条能在N 2中燃烧 N 2 + 3Mg ==== Mg 3N 2(金属镁、锂均能与氮气反应)Mg 3N 2易与水反应:Mg 3N 2 + 6H 2O === 3Mg(OH)2 + 2NH 3↑〖拓展延伸〗镁条在空气中点燃发生的反应有: 2Mg + O 2 ==== 2MgO N 2 + 3Mg ==== Mg 3N 2 2Mg + CO 2 ==== 2MgO + C ⑵ N 2与O 2化合生成NO : N 2 + O 22NO〖说明〗 在闪电或行驶的汽车引擎中会发生以上反应。
5.氮气的用途:⑴ 合成氨,制硝酸;⑵ 代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑶ 在灯泡中填充氮气以防止钨丝被氧化或挥发;⑷ 保存粮食、水果等食品,以防止腐烂;⑸ 医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⒆O 2(加热、催化剂) 4HNO 3(浓)==4NO 2↑+2H 2O+O 2↑ 强氧化性 不稳定性 HNO 3 NaNO 2 ⑽NaOH ⒄Mg N 2O 4 ⒃H 2O NH 3.H 2O NH 3 N 2 NO NO 2 Ag(NH 3)2+ NH 4Cl ⒀AgNO 3 ⒁NaOH ⒂HCl ⑿Δ ⑾H 2O Mg 3N 2 ⑵Cl 2、(23)CuO ⑴H 2 ⑶O 2(放电) ⑷NH 3 ⑸O 2 ⑹ ⑺ ⑻Cu ⒅HCl ⒇Cu 、(21)Fe 2+、、(22)I — ①与金属反应:Cu 、Fe ②与非金属反应:C 、S ③Fe 、Al 在冷、浓HNO 3 钝化④Pt 、Au 能溶解于王水(浓HNO 3:浓HCl=1:3) ⑤与还原性化合物反应:Fe 2+、SO 2、H 2S 、HI 有机物 硝化反应:C 6H 6 酯化反应:C 3H 5(OH)3 ⑼ Δ (24)Δ 点燃 点燃 点燃 点燃⑹ 利用液氮制造低温环境,使某些超导材料获得超导性能。
第1课时 自然界中氮的循环 氮气及

( C )
根据反应 3NO2+H2O===2HNO3+NO 中元素化
合价的变化可判断。 2 中氮元素化合价既有升高也有 NO 降低。
11
5.下列关于氮气的性质的说法中,错误的是 ( B ) .下列关于氮气的性质的说法中, A.通常情况下,氮气性质很不活泼 .通常情况下,ห้องสมุดไป่ตู้B.可在氧气中燃烧,生成一氧化氮 .可在氧气中燃烧, C.通常情况下,氮气在水中的溶解度很小 .通常情况下, D.跟氢气在一定条件下发生反应时,氮气是氧化剂 .跟氢气在一定条件下发生反应时,
19
(2)若 NO2 过量,设过量的 NO2 体积为 y 3NO2+H2O===2HNO3+NO 3 y=6 mL 1 2 mL
则参加反应的 NO2 和 O2 总体积:12 mL-6 mL=6 mL V(O2)=6×(1/5)=1.2 mL, V(NO2)=12-1.2=10.8 mL。
答案 1.2 mL
15
该题有两个要求:一是必须加入氧化剂, 解析 该题有两个要求 :一是必须加入氧化剂,二是 一次反应就能完成;反应 ( 、 (3 、 (4 一次反应就能完成;反应(1)(3)(4)从化合价 角度来看都升高,但反应(1 )N2→NO 2 不能一次反应 角度来看都升高,但反应( 就能完成;而反应( 就能完成;而反应(3)NO2→HNO3 虽然氮的化合价升 高 , 但 不 加 氧 化 剂 也 能 实 现 , 如 3NO2 + H2O===2HNO3+ NO,在该反应中,NO 2 既是氧化剂 ,在该反应中, 又是还原剂。只有反应( 又是还原剂。只有反应(4)N2→NO 必须加入氧化剂 且一次反应就能完成。 且一次反应就能完成。
2
二、氮气 1.物理性质 颜色 状态 气味 无色 气体 无味 水中的溶解性 难溶于水
高中化学 氮元素在自然界中的存在形式

氮气的性质和用途①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
氮元素在自然界中的存在形式既有游离态又有化合态。
空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素•氮气的物理性质和化学性质:(1)物理性质:纯净的氮气是无色气体,密度比空气略小,氮气在水中的溶解度很小,在常压下101kPa,-195.8℃氮气变成无色液体,-209.9℃变成雪花状固体。
氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N,由于N2分子中的N≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
(2)化学性质:氮分子化合价为0价,既可以升高也可以降低,说明氮气既有氧化性又有还原性。
①N2与H2化合生成NH3:说明:该反应是一个可逆反应,是工业合成氨的原理。
②N2与金属反应(Mg Ca Sr Ba)反应:③N2与O2化合生成NO:说明:在闪电或行驶的汽车引擎中会发生以上反应。
1.氮气(1)氮的固定使空气中游离态的氮转化为化合态氮的过程。
(2)氮气的性质①物理性质纯净的N2是一种无色无味的气体,难溶于水,在空气中约占总体积的4/5。
②化学性质通常情况下,N2化学性质很稳定,只在高温、放电、催化剂等条件下才能发生一些化学反应。
a.与H2反应:N2+3H2高温、高压催化剂2NH3。
b.与O2反应:N2+O2放电或高温2NO。
2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成NO和NO2的比较表:特别提醒(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
(4)NO2:既有氧化性又有还原性,以氧化性为主。
高一化学 知识点总结 必修一 3.2 氮的循环

3.2 氮的循环一、自然界中氮的循环:1.氮的存在形态氮是地球上含量丰富的一种元素,以游离态的形式存在于大气中,以化合态的形式存在于动植物体、土壤和水体中。
2.氮在自然界中的循环➢在自然界中豆科植物根部的根瘤菌把空气中的氮气转变为硝酸盐等含氮的化合物。
➢在放电条件下,空气中少量的N2与O2化合生成NO,NO和O2迅速生成NO2并随水进入土壤和水体。
➢人们通过化学方法把空气中的N2转化为NH3,再根据需要进一步转化成各种含氮化合物(如HNO3、氮肥等)。
二、氮气:1.物理性质➢色味态:无色无味气体➢溶解性:难溶于水➢密度:比空气略小2.化学性质放电2NO➢与氧气:N2+O2=====➢与氢气:N2+3H22NH3➢与镁:N2+3Mg点燃Mg3N23.用途➢氮气是合成氨,制硝酸的重要原料➢氮气因为性质稳定,经常用作保护气,比如用于焊接金属➢液氮可用作冷冻剂,应用于医学领域4、氮的固定(1) 概念:使空气中游离态的氮转化为含氮化合物的过程(2) 分类:➢自然固氮:主要包括生物固氮和高能固氮➢人工固氮:主要包括合成氨固氮和仿生固氮三、氮的氧化物:12. 注意事项:➢酸酐的问题:N2O3是亚硝酸的酸酐,N2O5是硝酸的酸酐➢颜色的问题:只有NO2是红棕色气体,其余均为无色气体➢污染的问题:氮的氧化物都具有毒性,而且都是大气污染物,3. NO和NO2(1)物理性质➢色味态:NO是无色无味气体,NO2是红棕色有刺激性气味的气体➢溶解性:NO难溶于水,NO2易溶于水➢密度:NO比空气略小,NO2比空气大(2) 相互转换➢NO→NO2:2NO+O2====2NO2➢NO2→NO:3NO2+ H2O====2HNO3 + NO(3)影响➢NO:是传递神经信息的“信使分子”,但容易与血红蛋白结合而使人体缺氧。
➢NO2:能损坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用。
四、氨气:1.物理性质(1)NH3是无色、有刺激性气味、极易溶于水的气体,常温时,1体积水大约溶解700体积的氨气。
高中氮的循环知识点

氮的循环一、氮在自然界中循环1、氮的固定使空气中游离态的氮转化为含氮化合物的过程叫氮的固定,简称固氮。
正是通过氮的固定,开始了氮在自然界中的循环,氮的固定有自然固氮和人工固氮两种方式。
2、自然固氮(1)生物固氮:大豆、蚕豆等豆科植物的根部含有根瘤菌,能把空气中的N2转变为硝酸盐,被植物吸收。
故豆类植物不需要施用氮肥,这种固氮方式占整个自然固氮的90%。
(2)高能固氮:通过闪电等高能量途径把N2固定的方式为高能固氮。
涉及到的反应主要有:N2+O22NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO可知,N2最终变成HNO3,即正常的雨水略呈酸性。
HNO3与土壤中的矿物作用,得到硝酸盐,被植物吸收,这就是“雷雨发庄稼”的科学道理。
3、人工固氮人们在工业生产中把N2转化为氮的化合物的方法为人工固氮,又叫工业固氮。
常见的方法有:(1)N2与H2合成NH3:,该反应为工业制HNO3的基础反应。
(2)仿生固氮:用某些金属有机化合物做催化剂,实现常温、常压固氮,这些金属有机物类似于根瘤菌,故又叫仿生固氮,这是目前科学界较为关注的研究性课题。
4、氮在自然界中的循环人们在生产活动中也涉及到了氮的循环,其中主要是利用N2与H2合成工业中重要的生产原料——NH3,即人工固氮。
涉及到两种很重要的物质:NH3、HNO3。
二、氮循环中的重要物质及其变化1、氮气,常况下是一种无色无味的气体,难溶于水,通常无毒。
氮气占空气体积总量的78.12%,是空气的主要成份。
氮气的化学性质很不活泼,只在特殊条件下,才能以下反应。
①与氧气反应:通常状况下氮气和氧气不反应,但在放电条件下,却可以直接化合生成NO。
反应的化学方程式为:★N2+O2闪电2NO②与氢气反应:在高温、高压、催化剂作用下,氮气和氢气可以反应制得氨气。
反应的化学方程式为:★N2 + 3H22NH3 此反应是工业合成氨的反应③与金属镁反应:金属镁可以在氮气中燃烧,生成氮化镁。
高一化学必修二氮知识点归纳

高一化学必修二氮知识点归纳氮是化学元素周期表中的第7号元素,原子序数为7,符号为N,它是自然界中广泛存在的元素之一。
氮具有多种化合价,可以形成丰富的化合物,对于我们的生活以及工业生产都有着重要的作用。
接下来,我们将对高一化学必修二的氮知识点进行归纳,以便更好地理解和掌握相关的知识。
一、氮的性质1. 物理性质氮是一种无色、无臭、无味的气体,密度较空气略大,极不溶于水,并不支持动物的呼吸。
由于氮气的稳定性较高,能够稳定地存在于大气中,占据空气的78%。
2. 化学性质氮是一种相对惰性的元素,不易与其他元素发生反应。
它在常温常压下,不与大部分金属和非金属直接反应,但它能够与一些高活性的金属(如锂、铝等)和氧气在高温高压下反应生成相应的氮化物。
3. 物理性质在高温高压下,氮能够与氢气反应生成氨气(NH3)。
氨气是一种无色气体,具有刺激性气味,能够溶于水,形成氨水溶液,呈碱性。
二、氮的存在形式及重要化合物1. 氮的存在形式氮主要存在于空气中,占据空气的78%。
此外,在土壤中也存在着大量的氮,通过植物吸收和生物循环,进入到生物体中。
氮还以无机形式存在于水体中,例如硝酸盐(NO3-)和铵离子(NH4+)。
2. 氮的重要化合物氮与氧气反应可生成氮氧化物,其中最常见的是一氧化氮(NO)和二氧化氮(NO2)。
这两种氮氧化物对于空气质量影响较大,可引发酸雨等环境问题。
另外,氨(NH3)是氮的重要化合物之一。
氨广泛用于农业中的肥料生产,也用于工业上的合成反应。
此外,硝酸(HNO3)和硫酸(H2SO4)是含氮的酸性氧化物,用于制备氮酸盐和肥料。
三、氮的应用1. 农业应用氮是植物所需的重要营养元素之一,对植物的生长发育具有重要影响。
因此,在农业生产中,善于利用氮肥可以提高作物产量和质量。
例如,尿素是一种常用的氮肥,可有效地为植物提供氮元素。
2. 工业应用氮在工业领域有着广泛的应用。
气体氮可以作为惰性气体用于包装、保护和储存易氧化的物质。
氮元素的循环解读

通过上一节的学习,我们知道,在一百多种元素中,组成单质及化合物种类最多的元素是碳元素。
那么,你知道地球上含量最丰富的一种元素是什么元素吗?那就是氮元素,氮元素广泛存在于大气、水体、动植物体以及土壤中。
那么,你知道这些氮元素是如何循环的吗?氮元素的循环对我们的环境和地球上的生命又有什么意义呢?研习教材重难点研习点1 氮在自然界中的循环1.自然界中氮元素循环示意图2.主要形式(1)游离态→化合态①是豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮化合物;②放电条件下,与氧气结合为氮氧化合物,并随降水进入水体中;③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成氮气。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
【领悟·整合】氮是维持高等动植物生命活动的必须元素,因此,氮的循环涉及到地球上生物圈的各个方面。
人类活动也在逐渐的影响到氮循环。
所以,认识氮的循环,就把我们将要学习的物质置于“氮的循环”这个大的背景下,将会更有利于同学们掌握氮及其化合物的性质。
3.氮气与氮的固定(1)氮气的物理性质:无色无味气体,难溶于水,与空气密度相近。
(2)氮气的化学性质:【知识·链接】氮气属于双原子分子,两个氮原子之间的作用非常强。
因此,氮气分子稳定,化学性质不活泼,但要注意,N 2一旦吸收能量变为N 原子则性质较活泼。
在高温或放电时可与某些物质反应,N 表现为既有氧化性,又有还原性。
①与O 2的反应在放电条件下,氮气跟氧气能直接化合生成无色的一氧化氮(NO )。
反应式为:N 2+O 22NO说明:在雷雨天气,汽车的发动机中均可以发生该反应。
在该反应中,N 2表现出还原性。
②与H 2反应N 2+3H 2高温、高压催化剂2NH 3说明:a 该反应是工业上合成氨的反应原理,具有非常重要的现实意义。
高考化学总复习课件氮及其重要化合物

成了蛋白质的基本骨架。
氮在蛋白质中的存在形式
02
蛋白质中的氮主要以酰胺键(-CONH-)的形式存在,连接氨
基酸形成多肽链。
蛋白质中氮的含量与蛋白质的质量关系
03
蛋白质中氮的含量是评价蛋白质质量的重要指标之一,高质量
的蛋白质通常含有较高的氮。
生物固氮与氮肥的生产和使用
生物固氮的概念
生物固氮是指某些微生物能够将大气中的氮气转化为氨或其他含氮 化合物的过程。
05
氮及其化合物的实验探究
氨的实验室制法
1 2
反应原理
利用氮气和氢气在高温高压下催化合成氨气。
实验装置
包括合成塔、热交换器、冷凝器、分离器等。
3
实验步骤
将氮气和氢气按一定比例混合,通过合成塔中的 催化剂层,在高温高压下反应生成氨气,经过冷 凝器冷却后得到液态氨。
铵盐的性质实验
铵盐的溶解性
铵盐易溶于水,且溶解度随温度升高而增大。
解题速度和准确性。
模拟试题与答案解析
模拟试题一
以氮的氧化物和氨的合成为背景,考查化学反应原理和化学计算。通过解析该题,可以检 验学生对相关知识点的掌握情况。
模拟试题二
涉及氮的固定、转化和铵盐的性质等知识点,考查学生综合运用知识解决问题的能力。答 案解析详细分析了解题思路和方法。
模拟试题三
以氮及其化合物的应用为背景,考查学生实验探究能力和创新思维。答案解析提供了多种 可能的实验方案和设计思路。
备考策略与建议
01
02
03
04
系统复习氮及其重要化合物的 性质、转化关系等基础知识,
形成完整的知识网络。
重视实验探究,掌握氮及其化 合物的实验方法和操作技能, 培养实验设计和分析能力。
