线型缩聚反应动力学讲义
高分子化学-线型缩聚动力学
的活性作用减弱,因而官能团活性相近。 2)官能团的活性与基团的碰撞频率有关,不决 定于整个大分子的扩散速率。
Flory对此进行了解释 ,同时指出,官能团等活 性理论是近似的,不是绝对的。
4.4.3 线型缩聚动力学
以二元酸和二元醇的聚酯化反应为例
4
1) 不可逆条件下的线型缩聚反应动力学
缩聚反应不断排出低分子副产物情况下,符合不可逆条件。 酯化或聚酯化是酸催化反应,机理如下: 第一步 羧酸先质子化:
聚合度与单体起始浓度和反应时间 t 是线性关
系,即随反应时间增加而线性增长,由直线的斜
率可以求k′→k
• 有实验数据证明当P(或聚合度)在一定范围内, 1/(1-P)—t的线性关系良好,这也证明了官能 团等活性的假定是正确的。 • 工业生产总是以外加酸作催化剂来加速反应
(2)自催化聚酯化动力学
• 在无外外加酸的情况下,二元酸单体作催化剂。但有机羧酸 电离度较少,特别是随着聚合度的提高,体系将从少量电离 逐步趋向不电离,催化作用减弱,情况比较复杂,分两种情 况分析。
6
k3是最慢的一步反应,由于不可逆, k4暂不考虑,聚酯反应速 率用羧基消失速率来表示:
d[COOH ] Rp - k 3[C (OH )2][OH ] dt
(7-5)
[C+(OH)2]是质子化羧基的浓度,难以确定,设法消去,令
+ - k 1 [ C ( OH ) 2 ][ A ] , K = = k2 [ COOH ][ HA ]
t 时水未排出 C 水部分排出 C
聚酯反应净速率是正、逆反应速率之差 水未排出时速率
dC 2 2 ( ) - = k1 C - k 1 - C -1 dt
(7-19a)
缩聚反应的机理动力学和聚合度讲课文档

第四十一页,共59页。
4.5.3 线型缩聚反应分子量的控制方法
第四十二页,共59页。
(1)单体过量法(改变原料摩尔比)
对于aAa和bBb反应体系,其中bBb单体稍过量,
设:Na、Nb分别为官能团a、b 的起始数目,Pa 为
官能团a 的反应程度。
第四十三页,共59页。
表明聚合度与基团数比r 、反应程度P 的关系式
第二十六页,共59页。
图4-4 对甲苯磺酸催化己二酸与二元醇缩聚反应动力学曲线
第二十七页,共59页。
② 无外加酸的自催化聚酯化动力学
任何酯化反应都要酸作催化剂;
若无外加酸作催化剂,则反应物羧酸本身提供的
H+起自催化作用。则[H+]=[-COOH]。
假设羧基与羟基浓度相等,以C(mol/L)表示,
逐步特征
第四页,共59页。
第五页,共59页。
链增长主要依赖官能团之间的缩合反应来实现,是逐步
的平衡反应,无链引发阶段。
反应初期,体系中单体很快转化成低聚物,单体浓度
下降很快,转化率几乎与时间无关。在缩聚反应中,
转化率无实际意义;以反应程度来描述反应的进度。
不同大小的分子的官能团都有相同的反应活性,发生分子
下讨论的,而实际上的操作都是在基团比不相
等的情况下进行的,进行理论分析时需引入两
种基团数比或摩尔比r,工业上则多用过量摩尔
百分比或摩尔分数q表示。
对于aAa和bBb反应体系,其中bBb单体稍过量,
设:Na、Nb分别为官能团a、b 的起始数目,Pa
为官能团a 的反应程度。
第四十页,共59页。
(1 r)
间反应形成大分子。
相对分子质量随反应时间增加而逐步增大,很少超过几万,
线型平衡缩聚产物分子量讲义

线型缩聚反应动力学
1.聚合度与平衡常数及反应程度的关系
若将体系中的低分子副产物不断排出,则反应不可逆地向正方向进行。
如聚酯反应采用减压脱水使平衡向产物方向移动,符合不可逆的条件。
若将体系中的低分子副产物不断排出,则反应不可逆地向正方向进行。
如聚酯反应采用减压脱水使平衡向产物方向移动,符合不可逆的条件。
2.线形缩聚反应分子量控制
聚酯化反应平衡常数K值较小,小分子副产物若不及时排除,逆反应不能忽视。
令羧基的起始浓度为C0,t时刻的浓度为C,分别考虑水不排除和部分排除(残留水的浓度为nw)两种情况:
缩聚反应大多呈现可逆条件下的动力学,所以要达到高分子量,副产物尽可能除尽,工业上采取高温、高真空的方法。
3.影响线形逐步聚合反应聚合度的因素
4.线形平衡缩聚反应的其他影响因素。
4.3 线形缩聚动力学

4.3 线形缩聚动力学
4.3 线形缩聚动力学
一、官能团等活性概念
官能团等活性设:反应物的两个官能团的反 应活性是相等的,它与链的长短无关;与另一 个官能团是否已经反应也无关。 在官能团等活性假设下,缩聚反应的每一步 反应的速率常数都相同。
二、线形缩聚动力学
以二元酸和二元醇的聚酯化反应为例,按小分 子酯化反应动力学的方法(酸催化反应)来处理。
二、线形缩聚动力学
−
d [COOH ] = k 3 K [COOH ][OH ][ HA] dt
2. 外加酸催化聚合反应
为了在期望的反应时间内得到高分子量聚合物, 可以加少量强酸,作为聚酯反应的催化剂。 因为催化剂([HA])的浓度在反应中保持不 变,当酸和醇等当量时:
− d [ M ] dt = k ' [ M ]
HA
k2
k3 OH k4
OH(A )
在非平衡条件下,聚酯反应速率可用第三步速率 来表示:
− d [COOH ] Rp = = k 3 [C + (OH ) 2][OH ] dt
k1 [C + (OH ) 2] = K= k 2 [COOH ][ HA]
质子化反应平衡表达式:
d [COOH ] − = k 3 K [COOH ][OH ][ HA] dt
1 (1 − p ) = 2 [ M ] k t + 1
2 2 0
二、线形缩聚动力学 1. 自催化聚合反应 (1)实验结果
转化率低于80% 和 高于93% 时,实验点偏 离了直线关系。
2 1 (1 − p ) 2 = 2 [ M ] 0 k t + 1
图 己二酸和一缩二乙二醇 在166°C下自催化聚酯化反 应三级动力学曲线
2.1.1高分子化学第三讲线形缩聚反应的概述

按聚合机理或 动力学分类:
连锁聚合:活性中心引发单体,迅速连锁增长。 逐步聚合:无活性中心,单体官能团间相互反应而逐步增长。
逐步聚合反应的种类
1)缩聚反应:官能团间的缩合聚合反应,同时有小分子产生。
如二元酸与二元醇的聚酯化反应,二元胺与二元酸的聚酰胺化反应
2)聚加成反应:形式上是加成,机理是逐步的。含活泼氢功能基的亲核 化合物与含亲电不饱和功能基的亲电化合物之间的聚合。
2.1 缩聚反应
逐步聚合反应的种类
3)开环反应:部分为逐步反应,如水、酸引发己内酰胺的开环生成尼龙-6
4)氧化耦合:单体与氧气缩合反应,如2,6-二甲基苯酚和氧气形成聚苯撑 氧,也称聚苯醚(PPO)
2.1 缩聚反应
1)缩聚反应:官能团间经多次缩合形成聚合物的反应。如己二胺和己二酸合成尼龙66
2)缩聚反应的体系:官能度(Functionality):一个分子中能参与反应的官能团数
官能团:OH,NH2,COOH,COOR,COCl,(CO)2O,SO3H 为了明确官能团和官能度的关系,来看一些具体实例
2.1 缩聚反应
3)缩聚反应的分类:
缩合反应 (Condensation)
1-1、1-2、1-3体系:如乙酸乙酯、二 甲基丙烯酸乙二醇酯等。
根据体系 官能度不同
线型缩聚 (Linear Polycondeபைடு நூலகம்sation)
2-2或2体系:单体含有两个官能团,形成的大 分子向两个方向增长,得到线形缩聚物的反应。
如涤纶聚酯、尼龙等。
体型缩聚 (Tridimensional Polycondensation)
2-3、2-4等多官能度体系:至少有一单体含两个 以上官能团,形成大分子向三个方向增长,得到体 形结构缩聚物的反应。如酚醛树脂、环氧树脂。
4.2 线形缩聚反应的机理

k1 [−OCO −][ H 2O ] K= = k − 1 [−OH ][−COOH ]
二、线形缩聚机理---逐步和平衡
3. 线形缩聚反应的平衡常数
三、缩聚过程中的副反应
(3) 环化反应(发生于大分子链内的副反应) 使聚合反应无法进行,使分子量降低。 (4)官能团分解反应(如高温下脱羧、氧化等) (发生于大分子链内的副反应) 危及聚合反应的顺利进行,使分子量降低。
R 2 H2 N R COOH O C NH R NH C O
+
2 H 2O
一、线形缩聚与成环倾向
1. 可能的环化反应
A-A型单体加B-B型单体:二聚体以上的反 应物可能成环
H
O
R OCO R'
CO
n
H
O
R OCO R'
CO
n
一、线形缩聚与成环倾向
2. 热力学分析
五、六元环最稳定,七元环有一定的稳定性(适 用于C和O、C和N构成的环)。 A-B型单体:只有当单体可以形成五元、六元或 七元环时,即 R=3∼5 原子时,成环问题才会出现. 例: 4-羟基丁酸 HO(CH2)3COOH; 5-羟基戊酸 HO(CH2)4COOH; 4-氨基丁酸 H2N(CH2)3COOH; 5-氨基戊酸 H2N(CH2)4COOH 这四种双官能团化 合物均不能聚合。
例: 2 HO(CH2)5COOH 转化率:100% H O(CH2)5CO OH + H2O 2
; 反应程度:50%
第二章 缩聚中基本概念 线形缩聚动力学

结果呈现:将分析结果以图表、报告等形式呈现,便于理解与交流
P线A形R缩T聚6动力学的发展趋势与
展望
动力学模型的发展趋势
复杂系统建模:随着对复杂系统研究的深入,动力学模型将更加精细和复杂,以模拟真实 系统的行为。
动力学参数的确定
动力学方程:描述反应速率与反应物浓度的关系 反应速率常数:表示反应的快慢程度 活化能:表示反应的活化能大小 动力学参数的确定方法:通过实验数据拟合和计算得出
PART 4
线形缩聚动力学模型
模型建立的原则
简化为线性模型 忽略非线性效应 假设系统是线性的 考虑时间演化过程
模型建立的步骤
PART 1
单击添加章节标题
PART 2
线形缩聚动力学的定义
缩聚反应的定义
缩聚反应:由单体通过聚合反 应生成高分子化合物的过程
反应特点:反应过程中不断产 生小分子,如水、醇等
反应类型:加成聚合、缩合聚 合等
影响因素:温度、压力、催化 剂等
线形缩聚反应的特点
反应过程中分子量逐渐增加 反应速率逐渐降低 反应体系粘一种单体进行的聚合反应
共聚反应:由两种或两种以上的单体进行的聚合反应
连锁聚合反应:在引发剂或催化剂的作用下,单体分子中的双键打开,不断加成聚合成 长链高聚物的聚合反应 逐步聚合反应:单体在聚合过程中,逐步由单体双键打开加成到高聚物分子链上,同时 生成水或其他小分子的聚合反应
确定研究问题
求解数学模型
添加标题
添加标题
建立数学模型
添加标题
线型缩聚反应讲义

线形缩聚反应的机理
1. 缩聚反应的定义
参与反应的单体只含两个功能基团,大分子链只会向两个方向增长,分子量逐步增大,体系的粘度逐渐上升,获得的是可溶可熔的线形高分子。
2. 平衡线形缩聚
指缩聚过程中生成的产物可被反应中伴生的小分子降解,单体分子与聚合物分子之间存在可逆平衡的逐步聚合反应。
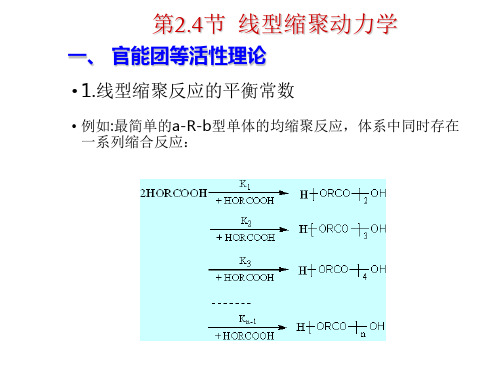
线形缩聚的机理:逐步和可逆 n HORCOOH H [ORCO]OH n 该反应事实上包括n-1个反应,当然就存在n-1个平衡常数。
H [ORCO]OH HORCOOH HORCOOH
12H [ORCO]OH HORCOOH
23H [ORCO]OH HORCOOH +
34………………
H [ORCO]OH HORCOOH +n-1n
线形缩聚 平衡线形缩聚 不平衡线形缩聚
3. 反应程度和聚合度
反应程度
将已反应的官能团的数目与起始官能团的数目之比定义为反应程度,用以表征缩聚反应进行的程度(深度)。
平均聚合度
平均进入大分子链的单体数
0X n N N
N0----体系中起始的分子总数(总mol 数) N----t 时刻体系中除小分子而外的分子总数(总mol 数)
4. 缩聚反应中的副反应
化学降解(链裂解反应)----发生于缩聚物分子链与小分子之间的副反应,水解、醇解、酸解、胺解等。
使合成产物相对分子质量降低。
链交换反应----发生于两个大分子链间的副反应,相对分子质量不变,分子量分布变窄。
环化反应和官能团分解反应----这是发生于大分子链内的副反应,严重影响反应进行。
线形逐步聚合反应中存在两种环化反应:分子内环化与单体单元环化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
线型缩聚反应动力学
1.不可逆线形缩聚动力学
若将体系中的低分子副产物不断排出,则反应不可逆地向正方向进行。
如聚酯反应采用减压脱水使平衡向产物方向移动,符合不可逆的条件。
若将体系中的低分子副产物不断排出,则反应不可逆地向正方向进行。
如聚酯反应采用减压脱水使平衡向产物方向移动,符合不可逆的条件。
2.可逆平衡线性缩聚动力学
聚酯化反应平衡常数K值较小,小分子副产物若不及时排除,逆反应不能忽视。
令羧基的起始浓度为C0,t时刻的浓度为C,分别考虑水不排除和部分排除(残留水的浓度为nw)两种情况:
缩聚反应大多呈现可逆条件下的动力学,所以要达到高分子量,副产物尽可能除尽,工业上采取高温、高真空的方法。
