第十一章 含氮化合物的代谢(新)
合集下载
第十一章含氮有机化合物 Microsoft PowerPoint 演示文稿

当氮原子上连有4个烃基时, 形成季铵类化合物。
NH4 X
+
-
4R
[R4N] X
季铵盐
+
-
R 可以相同或不同
X 为卤原子或酸根
R4
+ NX
OH
R4
+ N OH
季铵碱
(二)命名
1、简单胺命名时,以胺为母体,
烃基作取代基。 烃基名称+胺
①烃基相同: 烃基数目+烃基名称+胺
H5C2 NH2
乙胺
H3C N CH3 CH3
HO—C—OH
O=
(一)尿素 (脲)
O H2N C NH2
是人和哺乳动物蛋白质代谢的最终产 物,可配成注射液,可降低颅内压及眼 内压,用于治疗急性青光眼和脑水肿。
1.弱碱性
O H2N C NH2
O
+HNO3
H2N
C
NH2
﹒HNO
3
硝酸脲
硝酸脲不溶于水,易结晶,借此可以 从尿液中提取尿素。
2.水解反应
C2H5
H2N COOCH2CH2N+HCl-
C2H5
作用于外周神经产生传导阻滞作
用,依靠浓度梯度以弥散方式穿 透神经细胞膜,在内侧阻断钠离 子通道,使神经细胞兴奋阈值升 高,丧失兴奋性和传导性,信息 传递被阻断,具有良好的局部麻 醉作用。
用于浸润麻醉,溶液浓度多为
0.25%~0.5%,每次用量 0.05~0.25g,每小时不可 超过1.5g。用作腰麻,1次量 不宜超过0.15g,用5%溶液。 用于四肢的局部静脉麻醉, 0.5%溶液40~150ml。神经 传导阻滞时用 1%~2%溶液,1次不超过1g。
O C NH C C O NH O
第十一章胺和生物碱

O
[
S O
NR H
]
-
Na+
S
O
O S O
+
R 2N H
S O
N R 2 N aOH
不溶解
Cl
+
R N
3
不反应
(三)与亚硝酸的反应 不同类型的胺与HNO2反应,生成不 同的产物。由于亚硝酸不稳定,在反应中 用NaNO2与 HCl(或H2SO4)作用产生。 1. 伯胺
芳香伯胺若在低温强酸性溶液与亚
硝酸反应,生成重氮盐,称为重氮化反应。
2-甲基-3-氨基戊烷
CH3 CH3CHCHNHCH3 CH3
2-甲基-3-甲氨基丁烷
4.季铵盐和季铵碱(命名同无机铵类化 合物) [(CH3)3NC2H5 ]+Br [(CH3)4N]+OH氢氧化四甲基铵
溴化三甲基乙基铵
必须注意“氨、胺、铵”字的用法, 氨用来表示气态氨(NH3)或基团,如氨
基(—NH2),亚氨基( NH);胺用来
2. 仲胺
脂肪仲胺与芳香仲胺与亚硝酸反应,
都是在氮上进行亚硝化,生成N-亚硝基
胺类化合物,强致癌物。
CH3CH2NHCH2CH3 + HNO2 CH3CH2 N CH2CH3 + H2O N O N-亚硝基二乙胺(黄色油状)
N=O NHCH3 + HNO2 N CH3 + H2O
N-甲基苯胺
N-甲基-N-亚硝基-苯胺
的性质。
1. 氧化反应 芳胺很容易被氧化,氧化的产物很复
杂,这取决于氧化剂的性质和反应的条件。
NH2 MnO2 + H2SO4 O
O
对苯醌
2. 亲电取代反应 由于氨基使苯环活化,所以苯胺很 容易发生亲电取代反应。
有机化学课件——Chapter 11 含氮和含磷有机化合物

C6H5NH3+ · Cl氯化苯铵
(C2H5NH3+)2 · SO42硫酸二乙铵
(CH3)3N+CH2C6H5 · Br- [(C2H5)2NH2+]2 · SO42溴化三甲基苄铵 硫酸二(二乙铵)
??? ???
C4H9N+ · OH四丁基氢氧化铵
有机化学课件
(C2H5)2NH2+ · HSO4硫酸氢二乙铵
有机化学课件 22 第11章 含氮和含磷有机化合物
一、胺的碱性
N上的未共用电子对能接受一个质子,能与大多数的无机酸成 盐,所以胺具有碱性.
R
NH2 + HCl
R
+NH Cl 3
碱性强弱顺序: 脂肪胺 > NH3 > 芳香胺 pKb 3—4.5 4.75 9—10
在脂肪胺中: RNH2 < R2NH > R3N 一级 二级 三级
Na+
(2) 与羰基化合物缩合
CH3 NO2
-
CH2 NO2
O + R C R'(H)
H2O
OH R C CH2NO2 R'(H)
有机化学课件
10
第11章 含氮和含磷有机化合物
五、硝基对芳环的影响
硝基是强吸电子基, 当其与苯环直接相连时, 使芳环上的亲电取代 反应活性降低, 以致不能进行(如F-C反应). 但在卤代芳烃卤原子(如-Cl)的邻、对位引入-NO2时,卤原子的 反应活性增加,易于发生亲核取代反应.
有机化学课件 25 第11章 含氮和含磷有机化合物
二、胺的酸性
伯、仲胺中N-H键可以电离.
R2NH
R 2N - + H +
第十一章 含卤和含氮有机化合物

醇
R-CH=CH2 + NaX + H2O
X X Hβ '
+ 2NaOH
乙醇
+ 2NaX + 2H2O
基础化学
第十一章 含卤和含氮含 磷有机化合物
1)消除反应的活性: 3°RX > 2°RX > 1°RX 2) 2°、3°RX脱卤化氢时,遵守扎依采夫(Sayzeff)规则— —主要产物是生成双键碳上连接烃基最多的烯烃。例如:
基础化学
第十一章 含卤和含氮含 磷有机化合物
2)与金属钠的反应(Wurtz 武兹反应) 2R—X + 2 Na R—R + 2NaX 此反应可用来从卤代烷制备含偶数碳原子,结构对称的烷烃 (只适用于同一伯卤代烷,不同烷基无实用价值)。 3)与金属锂反应 卤代烷与金属锂在非极性溶剂(无水乙醚、石油醚、苯)中 作用生成有机锂化合物:
基础化学
第十一章 含卤和含氮含 磷有机化合物
RMgX与醛、酮、酯、二氧化碳、环氧乙烷等反应,生成醇、 酸等一系列化合物。所以RMgX在有机合成上用途极广。格林 尼亚因此而获得1912年的诺贝尔化学奖(41岁)。
用于合成其它有机金属化合物
3RMgCl + AlCl3 2RMgCl + CdCl2 4RMgCl + SnCl4 R3Al + 3MgCl2 R2Cd + 2MgCl2 R4Sn + 4MgCl2
次
CH3 + CH3
极少
CH3 CH2
基础化学
第十一章 含卤和含氮含 磷有机化合物
3 与金属的反应
卤代烃能与某些金属发生反应,生成有机金属化合物——金属 原子直接与碳原子相连接的化合物。 1)与金属镁的反应
十 一含氮有机化合物

N上取代烃基越少
溶剂化效应
1o > 2 o > 3 o
——铵正离子与水的溶剂化作用(胺的 氮原子上的氢与水形成氢键的作用)。
H OH2 H OH2 H OH2
R N
> R2 N
H OH2 H OH2
> R3 N H O 碱性越弱 碱性越强
H H
胺分子溶剂化程度越弱 胺分子溶剂化程度越强 脂肪胺的碱性
10.1.1 胺的分类和命名 脂肪胺 根据N上所 连烃基种类 芳香胺 CH3NH2
NH2
NH2
脂环胺
根据分子中 胺基的数目
一元胺 CH3CH2NH2 多元胺 H2NCH2CH2NH2
RNH2
根据N上所 连烃基数目
1°胺 (伯胺) 2°胺 (仲胺) 3°胺 (叔胺) 4°胺 (季铵盐)
R2NH
R3N R4N+
+
硫酸乙铵 乙胺硫酸盐
CH3 氢氧化甲 基三乙铵
10.1.2胺的构性分析
SP3
胺分子的官能团
R CH2 N R1 R2
N R R'' R'
氨基中的氮原子是不等性SP3杂化,其中三个SP 3轨 道分别与氢原子或碳原子形成三个键(N-H、C-N)。 剩余的一个SP3轨道被未共用电子对占据。胺分子的 构型呈棱锥形。
NHCH3
苯 胺
N-甲基苯胺
系统命名法:选含氮最长的碳链作为母体,称 某胺。氮上其它烃基作为取代基,并用N定其 位。比较复杂的胺,以烃做母体,氨或取代氨 基作为取代基命名:
CH3 N(C2H5) CH3CH2CH CHCH3
CH3
NH2
CH3CHCH2CHCH3 C2H5NHCH2CH2NH2
《有机化学导论》第十一章 含氮化合物
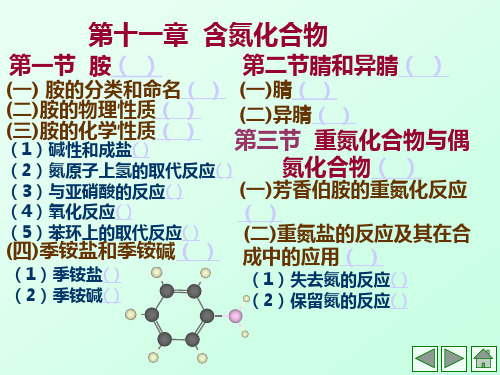
第十一章
第一节 胺( )
含氮化合物
第二节腈和异腈( )
(一) 胺的分类和命名( )(一)腈( ) (二)胺的物理性质( ) (二)异腈( ) (三)胺的化学性质( )
第三节 重氮化合物与 (1)碱性和成盐( ) 偶氮化合物( ) (2)氮原子上氢的取代反应( ) (3)与亚硝酸的反应( ) (一)芳香伯胺的重氮化反应 (4)氧化反应( ) ( ) (5)苯环上的取代反应( ) (二)重氮盐的反应及其在合
RNH2 > NH3 (脂肪胺)
> ArNH2 (芳香胺)
烷基对胺碱性的影响: .. CH3 NH2 烷基供电效应使胺的碱性加强. p-π共轭的结果, 苯环对芳胺碱性的影响:
N
H H
使电子对向苯环移 动,氮原子上电子 NH2 云密度降低,碱性 减弱.
——碱性和成盐——
(B)成盐
CH3(CH2)9NH2
NH3 氨 RNH2 伯胺(1º 胺) R2NH 仲胺(2º 胺) R3N 叔胺(3º 胺) CH3 与醇不同之处: CH C OH CH CH3 3 3 C NH2 CH3 CH3 叔碳 叔醇 伯胺 一个烃基
——胺的分类——
(B)按分子中氨基的数目 胺可分为一元胺、二元胺和三元胺等,如:
CH3CH2NH2 一元胺 H2NCH2CH2NH2 二元胺
NH2
Br2,
Br
H2O, OH- 或H+
Br
——苯环上的取代反应——
(B)硝化 硝酸是强的氧化剂,而胺又易被氧化,为 避免氧化,需要保护氨基。可用乙酰化法或 先将芳胺溶于浓硫酸生成硫酸氢盐。
NH3HSO4NH3HSO4-
NH2
浓H2SO4
HNO3,
H2O,OHNO2
第一节 胺( )
含氮化合物
第二节腈和异腈( )
(一) 胺的分类和命名( )(一)腈( ) (二)胺的物理性质( ) (二)异腈( ) (三)胺的化学性质( )
第三节 重氮化合物与 (1)碱性和成盐( ) 偶氮化合物( ) (2)氮原子上氢的取代反应( ) (3)与亚硝酸的反应( ) (一)芳香伯胺的重氮化反应 (4)氧化反应( ) ( ) (5)苯环上的取代反应( ) (二)重氮盐的反应及其在合
RNH2 > NH3 (脂肪胺)
> ArNH2 (芳香胺)
烷基对胺碱性的影响: .. CH3 NH2 烷基供电效应使胺的碱性加强. p-π共轭的结果, 苯环对芳胺碱性的影响:
N
H H
使电子对向苯环移 动,氮原子上电子 NH2 云密度降低,碱性 减弱.
——碱性和成盐——
(B)成盐
CH3(CH2)9NH2
NH3 氨 RNH2 伯胺(1º 胺) R2NH 仲胺(2º 胺) R3N 叔胺(3º 胺) CH3 与醇不同之处: CH C OH CH CH3 3 3 C NH2 CH3 CH3 叔碳 叔醇 伯胺 一个烃基
——胺的分类——
(B)按分子中氨基的数目 胺可分为一元胺、二元胺和三元胺等,如:
CH3CH2NH2 一元胺 H2NCH2CH2NH2 二元胺
NH2
Br2,
Br
H2O, OH- 或H+
Br
——苯环上的取代反应——
(B)硝化 硝酸是强的氧化剂,而胺又易被氧化,为 避免氧化,需要保护氨基。可用乙酰化法或 先将芳胺溶于浓硫酸生成硫酸氢盐。
NH3HSO4NH3HSO4-
NH2
浓H2SO4
HNO3,
H2O,OHNO2
第十一章含氮物

N
CH3 CH3
+
HNO 2
ON
对 亚硝 基 -N,N-二 甲苯 胺 绿色叶片状
***区别芳香族第一、第二、第三胺。
第十一章 含氮化合物—胺 6、氧化: 易氧化。(1)加入氧,(2)脱氢。
H5C2 NH 2 H2O2 R- CH =N -O H 肟 R NH R R H2O2 R N OH 羟胺
第十一章 含氮化合物—胺 7、芳胺的特性: (1)氧化:
第十一章 含氮化合物—胺 三、胺的物理性质(自阅) 四、胺的化学性质: 1、碱性: 胺中的N原子上有一孤对电子,能与质子 结合,故有碱性。 胺与酸反应成盐:
R
NH2
+
HX
R
+ NH3
X-
第十一章 含氮化合物—胺 胺的水溶液和氨水一样也显碱性:
R NH2
+
H2O
R
+ NH3
+
HO
-
胺的碱性很弱,它的盐可发生下列反应:
第十一章 含氮化合物—教学要求
[教学目的] 通过本章学习,掌握含N化合物性质 [教学重点] 胺类的碱性规律,重氮盐的生成及其 在合成上的应用 [教学基本要求]
第十一章 含氮化合物—教学要求
一、胺类 1、胺类的结构 2、胺类的化学性质 (1)碱性 (2)N上的取代反应 (3)与亚硝酸的作用 (4)氧化反应 二、重氮、偶氮和迭氮化合物 1、重氮化反应 2、重氮盐反应及其在合成上的应用
NH2
>
NH
>
N
第十一章 含氮化合物—胺 2、酸性: 伯仲胺的氮原子上还有H,能失去质子显酸性
H3C NH 2 + Na Fe Na
《有机化学(第二版)》第11章:有机含氮化合物

Cl -
高T,高P NaOH液 CH - 3 Na2CO3液 130℃ OH -
OH -
- NO2
NO2- Cl -
- NO2
OH - NO2- -NO2 - NO2
-NO2
硝基对苯环亲核取代反应影响:硝基吸电子作用, 使其邻位对位碳原子电子云密度降低,亲核取代 反应容易进行。
- NO2
Na2CO3液 温热
R 3N
+ HNO 2
R 3NH + 2 NO
(CH 3) 2 N
+ HNO 2
(CH 3) 2 N
NO
+H 2O
19:46
第二节 胺
5.氧化反应 胺有还原性,易被氧化。芳香族胺更易被氧 化,空气中氧即可将苯胺氧化。如苯胺可被氧化 生成对苯醌,因此在有机合成中,如果要氧化芳 胺环上其它基团,必须首先要保护氨基。
酮式
R-CH2 -N
R-CH=N O
OH O
烯醇式 假酸式
19:46
第一节 硝基化合物
与羰基化合物缩合 含有α-氢的伯或仲硝基化合物,由于α-氢的活性, 在碱性条件下,还能与醛或酮发生缩合反应。
CHO
+
R-CH2 -NO2
C2 H5 ONa
CH=C-NO2 R
19:46
第一节 硝基化合物
(二)还原反应 硝基化合物可被还原剂(铁、锡和盐酸或硫化物) 或催化还原成伯胺.
+ _ (CH3)4N OH _ + (CH3)3N C2H5Cl
氢氧化四甲铵
氯化三甲基乙基铵
注意:氨—气体 NH3,–NH2;胺—有机胺;铵– N为四价
19:46
第二节 胺
高T,高P NaOH液 CH - 3 Na2CO3液 130℃ OH -
OH -
- NO2
NO2- Cl -
- NO2
OH - NO2- -NO2 - NO2
-NO2
硝基对苯环亲核取代反应影响:硝基吸电子作用, 使其邻位对位碳原子电子云密度降低,亲核取代 反应容易进行。
- NO2
Na2CO3液 温热
R 3N
+ HNO 2
R 3NH + 2 NO
(CH 3) 2 N
+ HNO 2
(CH 3) 2 N
NO
+H 2O
19:46
第二节 胺
5.氧化反应 胺有还原性,易被氧化。芳香族胺更易被氧 化,空气中氧即可将苯胺氧化。如苯胺可被氧化 生成对苯醌,因此在有机合成中,如果要氧化芳 胺环上其它基团,必须首先要保护氨基。
酮式
R-CH2 -N
R-CH=N O
OH O
烯醇式 假酸式
19:46
第一节 硝基化合物
与羰基化合物缩合 含有α-氢的伯或仲硝基化合物,由于α-氢的活性, 在碱性条件下,还能与醛或酮发生缩合反应。
CHO
+
R-CH2 -NO2
C2 H5 ONa
CH=C-NO2 R
19:46
第一节 硝基化合物
(二)还原反应 硝基化合物可被还原剂(铁、锡和盐酸或硫化物) 或催化还原成伯胺.
+ _ (CH3)4N OH _ + (CH3)3N C2H5Cl
氢氧化四甲铵
氯化三甲基乙基铵
注意:氨—气体 NH3,–NH2;胺—有机胺;铵– N为四价
19:46
第二节 胺
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑥AIR合成酶
7
8
9
11
10
IMP生成总反应过程
IMP的合成要点:
• 在磷酸核糖分子上逐步合成嘌呤环; • PRPP是重要的中间代谢物,它不仅参与
嘌呤核苷酸的从头合成,而且参与嘧啶
核苷酸的从头合成及两类核苷酸的补救
合成。是5-磷酸核糖的活性供体。
• PRPP合成酶和酰胺转移酶为关键酶。
2、AMP和GMP的生成
α-酮酸1
R2-CH-COO| NH+3
转氨酶
(辅酶:磷酸吡哆醛)
α-氨基酸2
磷酸吡哆醛的作用机理
GOT(谷丙转氨酶) GPT (谷草转氨酶)
谷氨酰胺的生成和利用
ATP +NH2 ADP+Pi Mg2+ +H2O
谷氨酰胺合成酶
+2H
谷氨酸合成酶
联合脱氨基作用
(1)概念
转氨基作用和 氧化脱氨基作 用联合进行的 脱氨基作用方 式。
氨基酸中碳骨架的去路
(1)再氨基化生成氨基酸
(2)转变成糖或脂肪 (3)进入EMP-TCA彻底氧化
丙氨酸 苏氨酸 葡萄糖 异亮氨酸 亮氨酸 丙酮酸 乙酰CoA 缬氨酸
苯丙氨酸 酪氨酸 亮氨酸 赖氨酸 色氨酸 乙酰乙酰CoA
甘氨酸
丝氨酸 PEP 半胱氨酸
天冬氨酸 天冬酰氨
苯丙氨酸 酪氨酸 天冬氨酸 异亮氨酸 甲硫氨酸 缬氨酸
Gln
Asp
CO2
嘧啶环
(乳清酸)
①
②
CTP dTMP
UMP
③
R-5-P (PRPP)
1)
2) 3)
UMP——尿苷酸
CTP——三磷酸胞苷 dTMP——脱氧胸苷酸
UMP
ATP
磷酸 激酶
ATP
ATP Gln Mg+
UDP UTP CTP
二磷酸核糖还原酶
dUDP
dUMP
TMP合成酶 甲基化
CTP合成酶
草酰乙酸 谷氨酸 延胡索酸 柠檬酸 谷氨酰胺 精氨酸 组氨酸 脯氨酸
琥珀酰CoA
-酮戊二酸
氨基酸碳骨架进入三羧酸循环的途径
二、核苷酸代谢概况
• 合成代谢
– 从头合成途径 (de novo synthesis pathway) – 补救合成途径 (salvage synthesis pathway)
酮酸
进一步氧化或转 变为糖、脂肪
脱氨基作用 氧化脱氨基作用 转氨基作用 联合脱氨基作用
氧化脱氨基作用
氨基酸在酶的催化下脱去氨基生成相应 的α -酮酸的过程称为氧化脱氨基作用。主 要有以下两种类型:
谷氨酸+ H2O
L-谷氨酸脱氢酶
-酮戊二 酸+ NH3
NAD(P)+
NAD(P)H
R-CH-COO- 氨基酸氧化酶(FAD、FMN) R-C-COO-+NH3 | || + NH 3 O H2O+O2 H 2O2 α-酮酸 α -氨基酸
第十一章 含氮化合物 的代谢
氮素是生命元素
—蛋白质、核 酸、脂类
氮素代谢非常复杂
—注意掌握轮廓
一、氨基酸的代谢
• 合成 • 分解
氨基酸代谢概况
食物蛋白质 体蛋白 生物固氮 硝酸还原 NH4+ NH3 -酮酸 CO2 胺 氨基酸 特殊途径
(次生物质代谢)
激素 卟啉 嘧啶 嘌呤
糖及其代谢 鸟氨酸 中间产物 循环
•合成过程
腺嘌呤 + PRPP 次黄嘌呤 + PRPP 鸟嘌呤 + PRPP
APRT
HGPRT
AMP + PPi IMP + PPi GMP + PPi
HGPRT
•参与补救合成的酶
腺嘌呤磷酸核糖转移酶 (adenine phosphoribosyl transferase, APRT) 次黄嘌呤-鸟嘌呤磷酸核糖转移酶(hypoxanthineguanine phosphoribosyl transferase, HGPRT) 腺苷激酶(adenosine kinase)
IMP是AMP和GMP的前体。
HN NH 2 N N AMP N R-5'-P
O HN N IMP N N
C6氨基化 (Asp) GTP
C2氧化 (NAD ) 氨基化 (Gln)
O N N GMP N R-5'-P
R-5'-P
ATP
HN H2N
脱氧核糖核苷酸的生成 4种NDP(A、G、C及U)经还原反应生成4种 相应的dNDP
AA的相互转化
丝氨 酸族
His 和 芳香族
丙氨 酸族
天冬氨 酸族 谷氨酸族
(1 )
(2)
(3)
(4 )
(5)
丝氨 酸族
丙氨 酸族
2 4 3
5 1
His 和芳 香族
天冬氨酸 族
谷氨酸族
2、氨基酸的分解
脱羧基作用 胺
CO2 氨基酸 脱氨基作用 NH4 +
生理活性物质
释放或重新利用
尿素和嘧啶等
dTMP
脱氨基
dCMP
嘌呤核苷酸的分解代谢
GMP
NH3
AMP
腺嘌呤
NH3
鸟嘌呤
黄嘌呤
黄 嘌 呤 氧 化 酶
次黄嘌呤
黄嘌呤氧化酶
OH
尿 酸
N HO N
N OH N H
嘧啶核苷酸的分解代谢
CMP GMP dTMP
O N O=C C N H CH CH
胞嘧啶
尿嘧啶 脱氨、 还原、 水解
胸腺嘧啶
• 分解代谢
嘌呤核苷酸的合成
•嘌呤碱合成的元素来源
CO2 甘氨酸
天冬氨酸 甲酰基 (一碳单位) 甲酰基 (一碳单位)
谷氨酰胺 (酰胺基)
口
• 左一碳,右一碳; 中间夹个甘氨酸; 头顶CO2; 脚踏谷氨酰胺; 剩下一氮天冬酸。
诀
1天2碳3酰胺; 4,5,7氮Gly; 8-2,9-3来源同; 6-C来自碳酸酐。
CO2 + NH3 + -氨基酸
Gln CO2 ATP
PRPP 氨基甲酰磷酸
乳清酸
OMP
UMP
UDP
β-丙氨酸 UTP 二氢尿嘧啶 NH3 Gln 脱氨 CO2 CTP β-氨基异丁酸
合成代谢
dCMP
CDP
分解代谢
dCDP
dUDP
dUMP
TMP(dTMP)
dTDP
dTTP
嘌呤和嘧啶核苷酸的合成在医药研究中有广泛的用途
(2)类型
a、转氨酶与L-谷氨酸脱氢酶作用相偶联
b、转氨基作用与嘌呤核苷酸循环相偶联
转氨酶与L-谷氨酸脱氢酶作用相偶联
α -氨基酸 α-酮戊二酸
NH3+NADH
转氨酶 L-谷氨酸脱氢酶
H20+NAD+
α-酮酸
L-谷氨酸
转氨基作用与嘌呤核苷酸循环相偶联
次黄苷酸
α-氨基酸
α-酮戊二酸
天冬氨酸
α-酮酸
脂肪及其代 谢中间产物
尼克酰氨 SO4 2 衍生物 H2 O 尿酸 肌酸胺
TCA
NH4+ 尿素 CO2
1、氨基酸的合成
直接合成 AA的合成 转氨基作用
AA的相互转化 直接合成
-酮戊二 酸+ NH3
L-谷氨酸脱氢酶
谷氨酸+ H2O
NAD(P)+
NAD(P)H
转氨基作用
谷丙转氨酶 (GPT)
谷草转氨酶 (GOT)
天冬氨酸(Asp)
一碳单位
嘌呤环合成原料 谷氨酰胺(Gln)
甘氨酸(Gly)
CO2 合成嘌呤核苷酸: 还需R-5-P参与
•过程
1. IMP的合成
2. AMP和GMP的生成
1、IMP的合成过程
P O CH2 O H H H H P ATP AMP Mg
2+
O CH2 O H H H P H O P
转氨基作用
在转氨酶的催化下, α -氨基酸的氨基转移到α -酮酸的酮基碳原子
上,结果原来的α -氨基酸生成相应的α -酮酸,而原来的α -酮酸则形成 了相应的α -氨基酸,这种作用称为转氨基作用或氨基移换作用。
R1-CH-COONH+3
α -氨基酸1
|
R2-C-COO|| O
α-酮酸2
R1-C-COO|| O
OH PRPP合成酶 OH OH
O OH OH
5- 磷酸核糖
磷酸核糖焦磷酸 (PRPP ) 谷氨酰胺
PPi 酰胺转移酶
P
O CH2 O H H H
谷氨酸
NH2 H
OH OH
1- 氨基-5'- 磷酸核苷 (5- 磷酸核糖胺,PRA )
① ② ③ ④ ⑤
③ GAR合成酶 ④转甲酰基酶
⑥
⑤ FGAM合成酶
腺嘌呤核苷经腺苷激酶催化生成AMP
• 参与合成的酶 腺苷激酶(adenosine kinase)
腺嘌呤核苷
腺苷激酶
ATP ADP
AMP
嘧啶核苷酸的合成
嘧啶核苷酸的结构
嘧啶碱合成的元素来源
N
N
CO2
嘧啶环合成原料
谷氨酰胺(Gln)
天冬氨酸(Asp)
合成嘧啶核苷酸:
还需R-5-P参与
(二)合成过程:
线 粒 体
基质
氨基酸中氨基的去路
1、重新形成氨基酸 2、形成酰胺(Gln 和Asn ,消除NH3 毒害,贮存NH3 ) 3、和有机酸形成铵盐。 4、尿素的生成和鸟氨酸循环 在哺乳动物体内,氨的主要去路是在肝脏中合成尿 素并随尿排出体外。在部分植物体内尿素的形成既能解 除氨毒,又是氨的一种贮存形式。
7
8
9
11
10
IMP生成总反应过程
IMP的合成要点:
• 在磷酸核糖分子上逐步合成嘌呤环; • PRPP是重要的中间代谢物,它不仅参与
嘌呤核苷酸的从头合成,而且参与嘧啶
核苷酸的从头合成及两类核苷酸的补救
合成。是5-磷酸核糖的活性供体。
• PRPP合成酶和酰胺转移酶为关键酶。
2、AMP和GMP的生成
α-酮酸1
R2-CH-COO| NH+3
转氨酶
(辅酶:磷酸吡哆醛)
α-氨基酸2
磷酸吡哆醛的作用机理
GOT(谷丙转氨酶) GPT (谷草转氨酶)
谷氨酰胺的生成和利用
ATP +NH2 ADP+Pi Mg2+ +H2O
谷氨酰胺合成酶
+2H
谷氨酸合成酶
联合脱氨基作用
(1)概念
转氨基作用和 氧化脱氨基作 用联合进行的 脱氨基作用方 式。
氨基酸中碳骨架的去路
(1)再氨基化生成氨基酸
(2)转变成糖或脂肪 (3)进入EMP-TCA彻底氧化
丙氨酸 苏氨酸 葡萄糖 异亮氨酸 亮氨酸 丙酮酸 乙酰CoA 缬氨酸
苯丙氨酸 酪氨酸 亮氨酸 赖氨酸 色氨酸 乙酰乙酰CoA
甘氨酸
丝氨酸 PEP 半胱氨酸
天冬氨酸 天冬酰氨
苯丙氨酸 酪氨酸 天冬氨酸 异亮氨酸 甲硫氨酸 缬氨酸
Gln
Asp
CO2
嘧啶环
(乳清酸)
①
②
CTP dTMP
UMP
③
R-5-P (PRPP)
1)
2) 3)
UMP——尿苷酸
CTP——三磷酸胞苷 dTMP——脱氧胸苷酸
UMP
ATP
磷酸 激酶
ATP
ATP Gln Mg+
UDP UTP CTP
二磷酸核糖还原酶
dUDP
dUMP
TMP合成酶 甲基化
CTP合成酶
草酰乙酸 谷氨酸 延胡索酸 柠檬酸 谷氨酰胺 精氨酸 组氨酸 脯氨酸
琥珀酰CoA
-酮戊二酸
氨基酸碳骨架进入三羧酸循环的途径
二、核苷酸代谢概况
• 合成代谢
– 从头合成途径 (de novo synthesis pathway) – 补救合成途径 (salvage synthesis pathway)
酮酸
进一步氧化或转 变为糖、脂肪
脱氨基作用 氧化脱氨基作用 转氨基作用 联合脱氨基作用
氧化脱氨基作用
氨基酸在酶的催化下脱去氨基生成相应 的α -酮酸的过程称为氧化脱氨基作用。主 要有以下两种类型:
谷氨酸+ H2O
L-谷氨酸脱氢酶
-酮戊二 酸+ NH3
NAD(P)+
NAD(P)H
R-CH-COO- 氨基酸氧化酶(FAD、FMN) R-C-COO-+NH3 | || + NH 3 O H2O+O2 H 2O2 α-酮酸 α -氨基酸
第十一章 含氮化合物 的代谢
氮素是生命元素
—蛋白质、核 酸、脂类
氮素代谢非常复杂
—注意掌握轮廓
一、氨基酸的代谢
• 合成 • 分解
氨基酸代谢概况
食物蛋白质 体蛋白 生物固氮 硝酸还原 NH4+ NH3 -酮酸 CO2 胺 氨基酸 特殊途径
(次生物质代谢)
激素 卟啉 嘧啶 嘌呤
糖及其代谢 鸟氨酸 中间产物 循环
•合成过程
腺嘌呤 + PRPP 次黄嘌呤 + PRPP 鸟嘌呤 + PRPP
APRT
HGPRT
AMP + PPi IMP + PPi GMP + PPi
HGPRT
•参与补救合成的酶
腺嘌呤磷酸核糖转移酶 (adenine phosphoribosyl transferase, APRT) 次黄嘌呤-鸟嘌呤磷酸核糖转移酶(hypoxanthineguanine phosphoribosyl transferase, HGPRT) 腺苷激酶(adenosine kinase)
IMP是AMP和GMP的前体。
HN NH 2 N N AMP N R-5'-P
O HN N IMP N N
C6氨基化 (Asp) GTP
C2氧化 (NAD ) 氨基化 (Gln)
O N N GMP N R-5'-P
R-5'-P
ATP
HN H2N
脱氧核糖核苷酸的生成 4种NDP(A、G、C及U)经还原反应生成4种 相应的dNDP
AA的相互转化
丝氨 酸族
His 和 芳香族
丙氨 酸族
天冬氨 酸族 谷氨酸族
(1 )
(2)
(3)
(4 )
(5)
丝氨 酸族
丙氨 酸族
2 4 3
5 1
His 和芳 香族
天冬氨酸 族
谷氨酸族
2、氨基酸的分解
脱羧基作用 胺
CO2 氨基酸 脱氨基作用 NH4 +
生理活性物质
释放或重新利用
尿素和嘧啶等
dTMP
脱氨基
dCMP
嘌呤核苷酸的分解代谢
GMP
NH3
AMP
腺嘌呤
NH3
鸟嘌呤
黄嘌呤
黄 嘌 呤 氧 化 酶
次黄嘌呤
黄嘌呤氧化酶
OH
尿 酸
N HO N
N OH N H
嘧啶核苷酸的分解代谢
CMP GMP dTMP
O N O=C C N H CH CH
胞嘧啶
尿嘧啶 脱氨、 还原、 水解
胸腺嘧啶
• 分解代谢
嘌呤核苷酸的合成
•嘌呤碱合成的元素来源
CO2 甘氨酸
天冬氨酸 甲酰基 (一碳单位) 甲酰基 (一碳单位)
谷氨酰胺 (酰胺基)
口
• 左一碳,右一碳; 中间夹个甘氨酸; 头顶CO2; 脚踏谷氨酰胺; 剩下一氮天冬酸。
诀
1天2碳3酰胺; 4,5,7氮Gly; 8-2,9-3来源同; 6-C来自碳酸酐。
CO2 + NH3 + -氨基酸
Gln CO2 ATP
PRPP 氨基甲酰磷酸
乳清酸
OMP
UMP
UDP
β-丙氨酸 UTP 二氢尿嘧啶 NH3 Gln 脱氨 CO2 CTP β-氨基异丁酸
合成代谢
dCMP
CDP
分解代谢
dCDP
dUDP
dUMP
TMP(dTMP)
dTDP
dTTP
嘌呤和嘧啶核苷酸的合成在医药研究中有广泛的用途
(2)类型
a、转氨酶与L-谷氨酸脱氢酶作用相偶联
b、转氨基作用与嘌呤核苷酸循环相偶联
转氨酶与L-谷氨酸脱氢酶作用相偶联
α -氨基酸 α-酮戊二酸
NH3+NADH
转氨酶 L-谷氨酸脱氢酶
H20+NAD+
α-酮酸
L-谷氨酸
转氨基作用与嘌呤核苷酸循环相偶联
次黄苷酸
α-氨基酸
α-酮戊二酸
天冬氨酸
α-酮酸
脂肪及其代 谢中间产物
尼克酰氨 SO4 2 衍生物 H2 O 尿酸 肌酸胺
TCA
NH4+ 尿素 CO2
1、氨基酸的合成
直接合成 AA的合成 转氨基作用
AA的相互转化 直接合成
-酮戊二 酸+ NH3
L-谷氨酸脱氢酶
谷氨酸+ H2O
NAD(P)+
NAD(P)H
转氨基作用
谷丙转氨酶 (GPT)
谷草转氨酶 (GOT)
天冬氨酸(Asp)
一碳单位
嘌呤环合成原料 谷氨酰胺(Gln)
甘氨酸(Gly)
CO2 合成嘌呤核苷酸: 还需R-5-P参与
•过程
1. IMP的合成
2. AMP和GMP的生成
1、IMP的合成过程
P O CH2 O H H H H P ATP AMP Mg
2+
O CH2 O H H H P H O P
转氨基作用
在转氨酶的催化下, α -氨基酸的氨基转移到α -酮酸的酮基碳原子
上,结果原来的α -氨基酸生成相应的α -酮酸,而原来的α -酮酸则形成 了相应的α -氨基酸,这种作用称为转氨基作用或氨基移换作用。
R1-CH-COONH+3
α -氨基酸1
|
R2-C-COO|| O
α-酮酸2
R1-C-COO|| O
OH PRPP合成酶 OH OH
O OH OH
5- 磷酸核糖
磷酸核糖焦磷酸 (PRPP ) 谷氨酰胺
PPi 酰胺转移酶
P
O CH2 O H H H
谷氨酸
NH2 H
OH OH
1- 氨基-5'- 磷酸核苷 (5- 磷酸核糖胺,PRA )
① ② ③ ④ ⑤
③ GAR合成酶 ④转甲酰基酶
⑥
⑤ FGAM合成酶
腺嘌呤核苷经腺苷激酶催化生成AMP
• 参与合成的酶 腺苷激酶(adenosine kinase)
腺嘌呤核苷
腺苷激酶
ATP ADP
AMP
嘧啶核苷酸的合成
嘧啶核苷酸的结构
嘧啶碱合成的元素来源
N
N
CO2
嘧啶环合成原料
谷氨酰胺(Gln)
天冬氨酸(Asp)
合成嘧啶核苷酸:
还需R-5-P参与
(二)合成过程:
线 粒 体
基质
氨基酸中氨基的去路
1、重新形成氨基酸 2、形成酰胺(Gln 和Asn ,消除NH3 毒害,贮存NH3 ) 3、和有机酸形成铵盐。 4、尿素的生成和鸟氨酸循环 在哺乳动物体内,氨的主要去路是在肝脏中合成尿 素并随尿排出体外。在部分植物体内尿素的形成既能解 除氨毒,又是氨的一种贮存形式。
