化学方程式、化学式、微观反应
必考填空题20微观反应、化合价、化学式(原卷版+解析)

必考填空题 20 微观反应、化合价、化学式题型分析:该题主要考察化学反应的微观模型及元素周期表的局部、元素的表达图。
以此为依托,考察化学反应类型、物质分类、化学反应方程式、化学式、化合价、微观粒子结构等知识。
考察面非常广,但难度不大。
题型常见于杭州卷的第22或23题,全省各地市几乎每年必考一、填空题1.(2020·衢州)用高能粒子轰击原子核是研究微观粒子的一种方法。
1934年,意大利科学家费米用中子轰击铀原子(质子数为92,元素符号为U ),得到了一种质量增加的原子,他公开宣布发现了93号元素,被科学界认可,从而获得了诺贝尔物理学奖。
1938年,德国科学家哈恩在重复费米的实验后,发现费米实验中得到的是56号钡元素,并用图示模型来定义这一变化。
费米知道后,立即重复哈恩的实验,结果证实自己错了,费米坦率地检讨并纠正了错误。
(1)费米用中子轰击铀原子,不可能增加铀原子的________数,所以得不到93号元素。
(2)结合材料分析,以下观点正确的是 。
A.面对前人的观点要敢于质疑B.科学结论的得出要依据客观事实C.对科学的认识是一个不断修正、完善的过程2.(2020·衢州)某品牌新能源电动汽车使用磷酸铁锂电池,其反应原理: LiFePO 4⇌放电充电FePO 4+Li 。
该电池具有容量大、续航能力强的特点。
(1)LiFePO 4 , 中铁元素与氧元素的质量比为________。
(2)该电池充电时发生的化学反应属于________(填基本反应类型)。
3.(2020·湖州)由我国自主研发的深海载人潜水器球壳于2019年建造完成并通过验收。
球壳用被称为“海洋金属”的钛合金作为制造材料。
钛合金不仅强度高而且具有弹性。
右图为钛元素在元素周期表中的部分信息。
(1)钛原子的质子数为________。
(2)Ti除了表示钛元素、一个钛原子之外,还能表示________。
(3)钛元素的化合价为+4价时,其对应的氧化物被认为是现今世界上性能最好的一种白色颜料。
化学反应式和化学方程式的区别

化学反应式和化学方程式的区别
化学反应式和化学方程式是描述化学反应的两种不同的表达方式。
化学反应式是用化学符号和化学式表示化学反应过程中反应物和生成物之间的化学变化关系。
化学反应式中包括反应物、生成物以及它们之间的反应条件。
例如,二氧化碳与水反应生成甲酸的反应式可以表示为:
CO2 + H2O → HCOOH
化学反应式只是简单地表示了反应物与生成物之间的化学变化关系,并没有具体的数值。
而化学方程式是化学反应式的一种特殊形式,它是用化学符号和化学式表示化学反应过程中反应物和生成物之间的化学变化关系,并且在方程式的左右两边用系数表示反应物和生成物的物质的相对数量关系。
化学方程式中的系数表示了反应物和生成物的摩尔比。
例如,二氧化碳与水反应生成甲酸的化学方程式可以表示为:
CO2 + H2O → HCOOH
化学方程式可以用来定量描述反应物与生成物之间的化学变化关系,可以计算反应物与生成物的物质的相对数量。
化学反应式和化学方程式的区别在于化学方程式中包含了反应物和生成物的摩尔比,可以用来计算反应物和生成物的物质的相对数量,
而化学反应式只是简单地表示了反应物与生成物之间的化学变化关系,并没有具体的数值。
在化学实验和化学计算中,化学方程式是非常重要的工具,可以用来预测反应的产物和计算反应的摩尔比。
化学方程式还可以用来推导出化学反应的热力学数据、速率常数等重要参数。
总结来说,化学反应式和化学方程式都是描述化学反应的方式,但化学方程式具有更详细的信息,可以用来计算反应物和生成物的物质的相对数量。
初中化学常见方程式

初中化学常见方程式
1. 燃烧反应方程式:
- 碳与氧气燃烧: C + O2 → CO2
- 氢气与氧气燃烧: 2H2 + O2 → 2H2O
2. 氧化还原反应方程式:
- 铁生锈: 4Fe + 3O2 → 2Fe2O3
- 铜生绿锈: 2Cu + O2 + 2H2O → 2Cu(OH)2
3. 酸碱中和反应方程式:
- 盐酸与氢氧化钠: HCl + NaOH → NaCl + H2O
- 硫酸与氢氧化钙: H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
4. 置换反应方程式:
- 铁与铜sulfate溶液: Fe + CuSO4 → FeSO4 + Cu
- 锌与盐酸: Zn + 2HCl → ZnCl2 + H2
5. 分解反应方程式:
- 电解水: 2H2O → 2H2 + O2
- 加热碳酸钙: CaCO3 → CaO + CO2
6. 合成反应方程式:
- 氢气与氧气合成水: 2H2 + O2 → 2H2O
- 碳与氧气合成二氧化碳: C + O2 → CO2
这些是初中化学课程中常见的一些化学反应方程式,包括燃烧、氧化还原、酸碱中和、置换、分解和合成等反应类型。
掌握这些基本方程式有助于学生理解化学变化过程。
初中常见化学式和化学方程式及反应现象总结

初中常见化学式和化学方程式及反应现象总结初三化学方程式总结:与氧有关1.红磷与氧气中燃烧:4P+5O22P2O5,实验现象:生成大量白烟。
2.硫粉与氧气中燃烧:S+O2SO2,实验现象:在空气中发出淡蓝色火焰(在氧气中发出蓝紫色火焰),并生成刺激性气味的气体。
3.碳在氧气中充分燃烧:C+O2CO2,实验现象:在氧气中燃烧,发出白光,生成能使澄清石灰水变浑浊的气体。
4.碳在氧气中不充分燃烧:2C+O22CO,实验现象:生成无色无味有毒的一氧化碳气体。
5.铁在氧气中燃烧:3Fe+2O2Fe3O4,实验现象:剧烈燃烧,火星四射,生成黑色固体。
6.铜在空气中受热:2Cu+O22CuO,实验现象:红色固体逐渐变为黑色固体。
7.铝在空气中燃烧:4Al+3O22Al2O3,实验现象:光亮的表面变成白色(氧化铝膜)。
8.镁在空气中燃烧:2Mg+O22MgO,实验现象:剧烈燃烧,发出耀眼的白光,生成白色固体。
9.氢气中空气中燃烧:2H2+O22H2O,实验现象:安静燃烧,发出蓝色火焰。
10.甲烷在空气中燃烧:CH4+2O2CO2+2H2O,实验现象:安静燃烧,发出蓝色火焰。
11.一氧化碳在氧气中燃烧:2CO+O22CO2,实验现象:安静燃烧,发出蓝色火焰。
12.酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O,实验现象:发出蓝色火焰。
13.水在直流电的作用下分解:2H2O2H2↑+O2↑,实验现象:氢气、氧气体积比为2:114.氧化汞加热分解:2HgO2Hg+O2↑,实验现象:红色固体变成银白色汞液体。
15.双氧水分解制备氧气:2H2O22H2O+O2↑,实验现象:加入二氧化锰后,迅速放出能使带火星木条复燃的气体。
16.加热高锰酸钾制氧气:2KMnO4K2MnO4+MnO2+O2↑,实验现象:生成能使带火星木条复燃的气体。
17.加热氯酸钾制氧气(有少量的二氧化锰):2KClO32KCl+3O2↑,实验现象:生成能使带火星木条复燃的气体。
九年级常见物质化学式和化学方程式
化学式化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O2 2P2O52、氢气在空气中燃烧生成水:2H2 + O22H2O3、硫磺在空气(或氧气)中燃烧:S +O2 SO24、镁条在空气(或氧气)中燃烧:2Mg + O22MgO5、铁丝在氧气中燃烧:3Fe + 2O2 Fe3O46、木炭在空气(或氧气)中完全燃烧:C + O2 CO27、木炭不充分燃烧:2C + O22CO8、一氧化碳燃烧:2CO + O22CO29、二氧化碳和水反应生成碳酸:CO2+ H2O== H2CO310、二氧化碳通过灼热的炭层:CO2+ C 2CO11、氧化钙与水反应:CaO+ H2O == Ca(OH)212、铝与氧气反应:4Al + 3O2== 2Al2O3二、分解反应13、高锰酸钾制氧气:2KMnO4 K2MnO4+ MnO2+ O2↑14、氯酸钾制氧气:2KClO3 2KCl + 3O2↑15、双氧水制氧气:2H2O22H2O + O2↑16、电解水:2H2O 2H2↑+ O2↑17、碳酸分解:H2CO3H2O + CO2↑18、高温煅烧石灰石:CaCO3CaO+CO2↑三、置换反应19、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag + Cu(NO3)220、铜和硝酸汞溶液反应:Cu + 2HgNO3 == 2Hg + Cu(NO3)221、锌和硫酸铜溶液反应:Zn +CuSO4 == Cu + ZnSO422、锌和氯化铜溶液反应:Zn + CuCl2== Cu + ZnCl223、铁和氯化铜溶液反应:Fe + CuCl2== Cu+ FeCl224、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO425、铝和硫酸铜溶液反应:2Al + 3CuSO4==Cu +Al2(SO4)326、锌和稀硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑27、铁和稀硫酸反应制取氢气:Fe + H2SO4== FeSO4+ H2↑28、镁和稀硫酸反应制取氢气:Mg + H2SO4== MgSO4+ H2↑29、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑30、锌和稀盐酸反应制取氢气:Zn + 2HCl== ZnCl2+ H2↑31、铁和稀盐酸反应制取氢气:Fe + 2HCl==FeCl2+ H2↑32、镁和稀盐酸反应制取氢气:Mg + 2HCl== MgCl2+ H2↑33、铝和稀盐酸反应:2Al +6HCl == 2AlCl3+ 3H2↑34、木炭还原氧化铜:C+2CuO 2Cu +CO2↑35、木炭还原氧化铁:3C + 2Fe2O34Fe+ 3CO2↑36、木炭还原四氧化三铁:2C+ FeO 3Fe + 2CO2↑37、氢气还原氧化铜:H2+ CuO Cu + H2O↑点燃点燃点燃点燃点燃点燃点燃△MnO2△MnO2通电高温高温高温CuS高温高温点燃点燃--四、复分解反应(一)酸 + 碱→盐+水38、氢氧化钠与盐酸反应:NaOH + HCl== NaCl+ H2O39、氢氧化钠与硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O40、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O41、氢氧化镁与硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O42、氢氧化钙与硫酸反应:Ca(OH)2+H2SO4== CaSO4+ 2H2O43、氢氧化钙与盐酸反应:Ca(OH)2 +2HCl == CaCl2+ 2H2O44、氢氧化铜与硫酸反应:Cu(OH)2+ H2SO4== CuSO4+ 2H2O45、氢氧化铜与盐酸反应:Cu(OH)2+ 2HCl == CuCl2+ 2H2O46、氢氧化铁与盐酸反应:Fe(OH)3 + 3HCl == FeCl3+ 3H2O47、氢氧化铁与硫酸反应:Fe(OH)3 + 3H2SO4== Fe2(SO4)3+ 3H2O(二)酸+盐→另一种酸+ 另一种盐48、盐酸与硝酸银溶液反应:HCl + AgNO3 == AgCl↓+ HNO349、氯化钡溶液与硫酸溶液反应:BaCl2+ H2SO4== BaSO4↓+2HCl50、硝酸钡溶液与硫酸溶液反应:Ba(NO3)2+ H2SO4== BaSO4↓+2HNO351、碳酸钠与稀盐酸:Na2CO3+ 2HCl == 2NaCl+ H2O + CO2↑52、碳酸钠与稀硫酸:Na2CO3+ H2SO4== Na2SO4+ H2O +CO2↑53、碳酸氢钠与稀盐酸:NaHCO3 + HCl == NaCl+ H2O + CO2↑54、碳酸氢钠与稀硫酸:2NaHCO3+ H2SO4==Na2SO4+2H2O +2CO2↑55、石灰石与稀盐酸反应制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO2↑56、碳酸钾与稀盐酸:K2CO3+ 2HCl == 2KCl+ H2O + CO2↑57、碳酸钾与稀硫酸:K2CO3+ H2SO4== K2SO4+ H2O+CO2↑(三)碱 + 盐→另一种碱 + 另一种盐58、硫酸铜溶液和氢氧化钠溶液:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓59、氯化铜溶液和氢氧化钠溶液:CuCl2+2NaOH = 2NaCl+Cu(OH)2↓60、氯化铁溶液和氢氧化钠溶液:FeCl3+3NaOH==Fe(OH)3↓+3NaCl61、硫酸铁和氢氧化钠溶液:Fe2(SO4)3+6NaOH==2Fe(OH)3↓+3Na2SO462、碳酸钠溶液与氢氧化钙溶液:Na2CO3+ Ca(OH)2== CaCO3↓+2NaOH63、碳酸钠溶液与氢氧化钡溶液:Na2CO3+ Ba(OH)2==BaCO3↓+2NaOH64、硫酸铜和氢氧化钡溶液:CuSO4+ Ba(OH)2== BaSO4↓+ Cu(OH)2↓(四)盐 + 盐→两种新盐65、硝酸银溶液与氯化钠溶液反应:AgNO3+ NaCl== AgCl↓+ NaNO366、氯化钡溶液与硫酸钠溶液反应:BaCl2+ Na2SO4=BaSO4↓+2NaCl67、氯化钙溶液与碳酸钠溶液反应:CaCl2+ Na2CO3= CaCO3↓+2NaCl68、氯化钡溶液与碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl--五、其他反应类型(一)金属氧化物+酸→盐 + 水69、稀盐酸清洗铁锈:6HCl + Fe2O3== 2FeCl3+ 3H2O70、稀硫酸清洗铁锈:3H2SO4+ Fe2O3== Fe2(SO4)3+ 3H2O71、氧化铜与稀硫酸反应:CuO +H2SO4== CuSO4+ H2O72、氧化铜与稀盐酸反应:CuO + 2HCl== CuCl2+ H2O73、氧化钙与稀硫酸反应:CaO + H2SO4== CaSO4+ H2O74、氧化钙与稀盐酸反应:CaO +2HCl==CaCl2+ H2O(二)非金属氧化物+碱→盐+ 水75、二氧化碳通入澄清石灰水中:CO2+ Ca(OH)2== CaCO3↓+ H2O76、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3+ H2O77、澄清石灰水吸收二氧化硫:SO2 + Ca(OH)2== CaSO3↓+ H2O78、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH = Na2SO3+ H2O79、氢氧化钠溶液与三氧化硫:SO3 + 2NaOH = Na2SO4+ H2O(三)其它80、一氧化碳还原氧化铜:CO + CuO Cu + CO281、冶铁原理(赤铁矿):3CO + Fe2O32Fe +3 CO282、冶铁原理(磁铁矿):4CO + Fe3O43Fe +4CO283、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O84、甲烷燃烧:CH4 + 2O2CO2+ 2H2O85、葡萄糖氧化:C6H12O6+ 6O26H2O +6CO2△点燃点燃△△酶--。
常见物质化学式及化学方程式

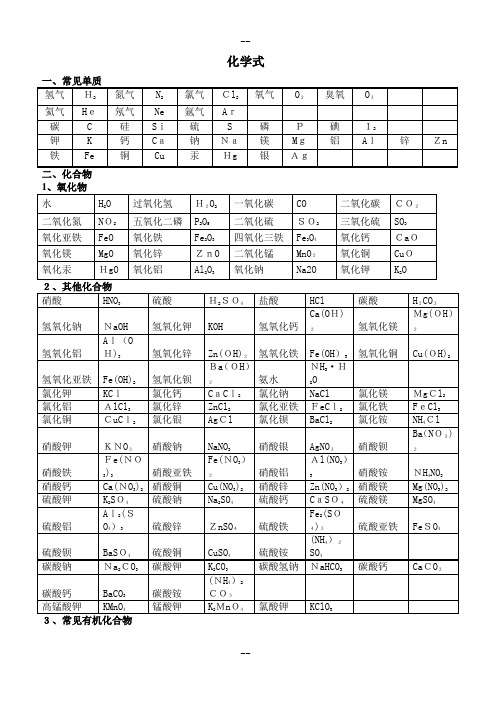
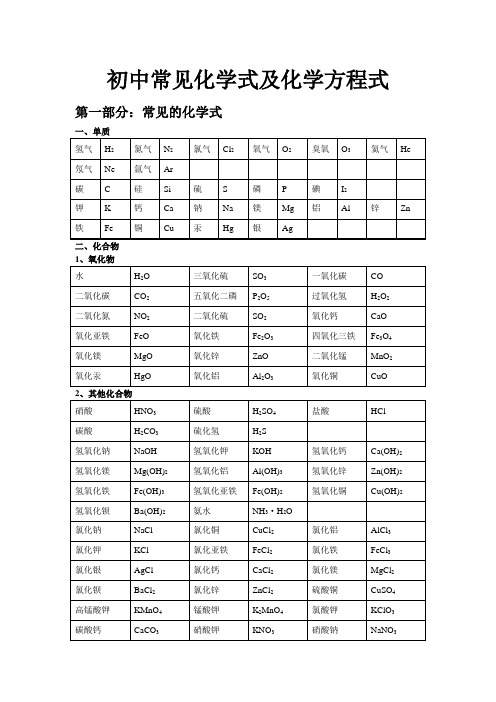
初中化学常见物质的化学式1、单质:2H 氢气 2O 氧气 2N 氮气 C 碳 P 磷 S 硫 Fe 铁 Cu 铜 Hg 汞2、化合物(1)氧化物:O H 2水 2CO 二氧化碳 CO 一氧化碳 2SO 二氧化硫 3SO 三氧化硫 52O P 五氧化二磷 32O Fe 氧化铁 43O Fe 四氧化三铁 CaO 氧化钙 MgO 氧化镁CuO 氧化铜 ZnO 氧化锌 FeO 氧化亚铁 2MnO 二氧化锰 O Na 2氧化钠 (2)酸:HCl 盐酸 42SO H 硫酸 3HNO 硝酸 43PO H 磷酸 32CO H 碳酸 32SO H 亚硫酸 (3)碱:NaOH 氢氧化钠 KOH 氢氧化钾 Ca(OH)2氢氧化钙 Ba(OH)2氢氧化钡 Cu(OH)2氢氧化铜 Fe(OH)3氢氧化铁 Fe(OH)2氢氧化亚铁 Al(OH)3氢氧化铝 Mg(OH)2氢氧化镁(4)盐:NaCl 氯化钠 Na 2CO 3碳酸钠 ZnCl 2氯化锌 CaCl 2氯化钙 KCl 氯化钾42SO Na 硫酸钠4CuSO 硫酸铜 AgCl 氯化银 3FeCl 氯化铁 2FeCl 氯化亚铁 3AlCl 氯化铝 4FeSO 硫酸亚铁342)(SO Fe 硫酸铁 4ZnSO 硫酸锌 3CaCO 碳酸钙 2BaCl 氯化钡 4BaSO 硫酸钡3KClO 氯酸钾 4KMnO 高锰酸钾 42MnO K 锰酸钾 3KNO 硝酸钾 23)(NO Cu 硝酸铜 23)(NO Hg 硝酸汞 Cl NH 4氯化铵 34NO NH 硝酸铵 424)(SO NH 硫酸铵 34HCO NH 碳酸氢铵 3NaHCO 碳酸氢钠 322)(CO OH Cu 碱式碳酸铜(5)有机物:4CH 甲烷 OH H C 52乙醇(酒精) OH CH 3甲醇 COOH CH 3乙酸(醋酸)22)(NH CO 尿素,葡萄糖:6126O H C 淀粉:n O H C )(510628. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O 54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl 五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O。
化学反应式和化学方程式的区别

化学反应式和化学方程式的区别化学反应式和化学方程式是化学中用来描述化学反应的两种表达方式。
它们之间的区别在于,化学反应式是一种简洁的表示方式,只包含反应物和生成物的化学式,而化学方程式则更加详细明确,包含了反应物和生成物的摩尔比例、状态以及反应条件等信息。
化学反应式是指用化学式来表示化学反应的方式。
化学式是由元素符号和下标组成的表示物质组成的标记,通过化学反应式可以直观地了解反应物和生成物的组成。
例如,氢气和氧气发生反应生成水的化学反应式可以表示为:2H2 + O2 → 2H2O。
这个化学反应式告诉我们,两个氢气分子和一个氧气分子反应生成两个水分子。
化学方程式则更加详细地描述了化学反应的过程。
它除了包含反应物和生成物的化学式外,还包含了反应物和生成物的摩尔比例、状态以及反应条件等信息。
例如,将氢气和氧气反应生成水的化学方程式可以表示为:2H2(g) + O2(g) → 2H2O(l)。
这个化学方程式告诉我们,两个氢气分子和一个氧气分子在气相条件下反应生成两个水分子,并且生成的水是液体状态。
化学反应式主要用于简洁地表示化学反应的基本过程,而化学方程式则更加详细地描述了反应物和生成物之间的关系。
化学方程式可以告诉我们反应物的摩尔比例,这对于计算反应物的量和生成物的量非常重要。
此外,化学方程式还可以告诉我们反应物和生成物的状态,这对于理解反应过程的物理性质也非常重要。
反应条件的信息也可以通过化学方程式来表示,例如温度、压力等。
化学方程式的使用还可以帮助我们预测反应的产物和判断化学反应的可行性。
通过化学方程式,我们可以确定反应物和生成物之间的摩尔比例,从而可以计算反应的理论产物。
此外,通过化学方程式还可以判断反应是可逆反应还是不可逆反应。
可逆反应可以通过调整反应条件来控制反应方向,而不可逆反应则不能逆转。
化学反应式和化学方程式在化学研究和实验中都起着重要的作用。
化学反应式可以帮助我们理解化学反应的基本过程,而化学方程式则提供了更加详细和具体的信息,帮助我们进行实际的计算和实验设计。
初中常见化学式及化学方程式
苛性钠吸收三氧化硫气体
4
消石灰放在空气中变质
5
消石灰吸收二氧化硫
(5)酸+碱 -------- 盐+水
1
盐酸和烧碱起反应
2
盐酸和氢氧化钾反应
3
盐酸和氢氧化铜反应
4
盐酸和氢氧化钙反应
5
盐酸和氢氧化铁反应
6
氢氧化铝药物治疗胃酸过多
7
硫酸和烧碱反应
8
硫酸和氢氧化钾反应
9
硫酸和氢氧化铜反应
10
硫酸和氢氧化铁反应
3
红色金属变为黑色固体
4
银白金属变为白色固体
5
剧烈燃烧、火星四射、生成黑色固体、放热
6
剧烈燃烧、白光、放热、使石灰水变浑浊
7
剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰
8
剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量
9
蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)
一氧化碳还原四氧化三铁
14
镁还原氧化铜
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质+酸 -------- 盐+氢气 (置换反应)
1
锌和稀硫酸
2
铁和稀硫酸
3
镁和稀硫酸
4
铝和稀硫酸
5
锌和稀盐酸
6
铁和稀盐酸
7
镁和稀盐酸
8
铝和稀盐酸
(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐
1
铁和硫酸铜溶液反应
5
氢氧化钙与碳酸钠
6
(8)盐+盐 ----- 两种新盐
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学专题复习---化学方程式复习学案6
一、化学反应实质是:反应物的原子或原子团、离子重新组合的过程,反应前后元素不变。
二、金属条件分析以下反应不能发生的原因
硫酸除去试管壁上的铜,锌与硝酸铝溶液
锌与碳酸铜,氢氧化钠与碳酸铜生成蓝色沉淀
碳酸镁与氯化钙溶液,碳酸钾溶液与氯化钠溶液
①金属与酸反应条件:②金属与盐反应条件
③碱与盐反应、盐与盐反应
a)化合价与离子所带电荷数是相等的,常见金属:钾钙钠镁铝锌铁铜汞银对应的离子
符号分别是
归纳其化合价:+1价有+2价有+3价有
生成+2价的亚铁离子是什么反应:生成+3价是: 符号的应用:
三、转化:CO2 与碱溶液、或水可以转化为CO32-,
NH3与水可以转化为NH4+
四、运用
1、镁在空气中点燃不仅和氧气反应,还能和二氧化碳生成氮化镁(氮元素显-3价)和一种
单质,该反应的方程式
2、硅元素的符号为,它的许多化学性质与碳相似,写出硅酸的化学式,二氧化硅
与烧碱反应能生成盐和水,写出该反应的化学方程式
3、硬水中含有一定的可溶性碳酸氢钙,受热后分解生成一种盐、二氧化碳和另一种氧化物,
从而降低水的硬度,写出该反应方程式
4、用方程式解释1)、白磷要密封保存于水中
2)、稀盐酸会破坏铝锅表面的氧化膜(Al2O3)
3)、乙炔(C2H2)可以作燃料
4)、铁制品不能盛放波尔多液(硫酸铜与熟石灰混合物)
5、氢气和氯气(CL2)燃烧的方程式
6、铜可以和浓硫酸受热反应,生成硫酸铜、二氧化硫、水。
该反应方程式
7、铁放入硝酸银和硝酸铜的混合液中,铁的表面出现白色物质的反应
铁的表面出现红色物质的反应
8、写出有水参加的化合反应①②
9、有水生成的反应:小苏打受热分解碳酸分解
酸碱中和反应酸和金属氧化物反应
碱溶液和非金属氧化物反应
10、含硫的煤燃烧生成二氧化硫,造成酸雨,可以用氢氧化钠溶液来吸收
10、氢氧化钠溶液敞口放置可能会吸收二氧化碳而变质。
(1)写出变质的化学方程式
(2)写出鉴别是否变质的化学方程式
(3)写出除去所含杂质的方程式
11、用方程式解释,铝制品耐腐蚀的原因
12、二氧化碳是一种宝贵的资源。
高温高压下可以和氨气合成尿素[CO(NH2)2]和水,写出该
反应的方程式
13、用方程式表示铅(Pb )的金属活动性比Cu 的金属活动性强的方程式
14、加入过量某物质与碳酸钠溶液反应,使溶液成为中性,写出发生反应的方程式
15、实验室制取的二氧化碳气体中可能含有少量氯化氢气体,可以用碳酸氢钠溶液来净化,
发生的反应方程式
16、用化学方程式表示含Mg(OH)2的药物治疗胃酸过多症的原理。
5.下列关于维生素C(化学式为C 6H 8O 6)的说法正确的是 【 】
A .该物质属于氧化物
B .该物质中碳、氢、氧的质量比为3:4:3
C .该物质的相对分子质量为l76
D .其分子由碳原子、氢分子和氧分子构成
五化合价、化学式推断练习
1、加碘食盐所含Kl03中I 显 价。
NaClO 中氯元素的化合价为 硅酸钙(CaSiO 3)是玻璃的主要成分之一,硅酸钙中Si 的化合价是
锰酸钾(K 2MnO 4)中锰元素的化合价是
在C 3N 4中,C 的化合价为+4,则N 的化合价是
工业明胶中含有毒的重铬酸钠(Na 2CrO 4),其中Cr 元素的化合价为
下列各种物质中,氯元素化合价最高的是( )
A .NaClO 4
B .HCl
C .NaClO
D .ClO 2
2、(2013.咸宁市)下列化学用语书写正确的是 ( )
A .氧化铁FeO
B .2个氢分子 2H
C .镁离子 Mg +2
D .氨中氮元素的化合价NH 3中N 为-3
3、“信阳毛尖”是一种绿茶,绿茶中含有单宁酸(化学式为C 76H 52O 46)具有抑制血压上升﹑清热解毒等功效下列关于单宁酸的说法正确的是 【 】
A .属于氧化物
B .由碳原子﹑氢分子和氧分子构成
C .氢元素的质量分数最小
D .碳﹑氧两种元素的质量分数之比为76:46
4、推断以下化学式
(1)2NaCl +2H 2O===2 NaOH+H 2↑+X↑,则X 的化学式为
(2)Cl 2+2X =2NaCl +2ClO 2,则X 的化学式为
(3)Cl 2常作自来水消毒剂,其实验室制法为:MnO 2+4HCl (浓)
X +Cl 2↑+2H 2O ,
X 的化学式为 。
(4)(2011.南通市)已知反应O H CO O X 222223++点燃,则X 的化学式为 ( )
A .C 2H 6
B .
C 2H 4 C .C 2H 2
D .C 2H 60
(5)2 NaClO 3 + 4HCl = 2 ClO 2↑+ Cl 2↑ + 2X + 2 NaCl ,请推断出X 的化学式为
A. HClO
B. NaOH
C. H 2O
D. HClO 3
(6)2X +9O 2 点燃 4CO 2十2SO 2十6H 2O ,则X 是
(7)4HgS+4CaO=4Hg+3X+CaSO 4。
该反应中X 的化学式为。
