20种氨基酸基本性质总表
20种常见氨基酸

20种常见氨基酸1. 赖氨酸 (Lysine):是一种必需氨基酸,对维持红细胞的生长和发育很重要,能够促进钙的吸收和利用,还可以提高免疫力。
2. 缬氨酸 (Valine):一种必需氨基酸,是组成肌肉蛋白质的重要成分,能够增加肌肉耐久性和抗疲劳能力。
3. 亮氨酸 (Leucine):一种必需氨基酸,参与调节蛋白质合成和肌肉生长,可以提高运动表现和恢复速度。
4. 苏氨酸 (Threonine):一种必需氨基酸,对肝脏和免疫系统的健康很重要,能够改善皮肤状态和维护身体的正常生长。
5. 苯丙氨酸 (Phenylalanine):一种必需氨基酸,能够增强记忆力和精神状态,对提高心理和智力表现有帮助。
6. 色氨酸 (Tryptophan):一种必需氨基酸,参与多种神经调节物质的合成,能够改善睡眠质量和情绪状态。
7. 番茄红素 (Lycopene):一种含有双键结构的非必需氨基酸,具有强烈的抗氧化作用,能够保护细胞损伤。
8. 精氨酸 (Arginine):一种非必需氨基酸,对血管的健康和性功能有帮助,能够促进蛋白质的合成和肥育。
9. 脯氨酸 (Proline):一种非必需氨基酸,对维持骨骼和结缔组织完整性很重要,还可以促进创伤愈合。
11. 天门冬氨酸 (Aspartic Acid):一种非必需氨基酸,具有刺激中枢神经系统的功能,还能够促进胰岛素的分泌。
14. 谷氨酰胺 (Glutamine):一种非必需氨基酸,参与多种代谢反应,具有增强人体免疫能力和促进创伤愈合的作用。
16. 半胱氨酸 (Cysteine):一种半必需氨基酸,对维持蛋白质结构和代谢很重要,还可以参与氧化还原过程。
18. 脯氨鸟氨酸 (Hydroxyproline):一种含有瞬切脯基的非必需氨基酸,是胶原蛋白的主要成分,能够维持皮肤的弹性和结构。
20种氨基酸的英文、缩写以及功能【完整版本】

加粗为8种人体必需氨基酸常见氨基酸的作用:一。
甘氨酸(GLY)1、降低血液中的胆固醇浓度,防治高血压2、降低血液中的血糖值,防治糖尿病3、能防治血凝、血栓4、提高肌肉活力,防止胃酸过多5、甜味为砂糖的0。
8倍,对人体有补益等营养作用二. 亮氨酸(LEU)1、降低血液中的血糖值,对治疗头晕有作用2、促进皮肤、伤口及骨头有愈合作用3、如果缺乏时,会停止生长,体重减轻三. 蛋(甲硫)氨酸(MET)1、参与胆碱的合成,具有去脂的功能,防治动脉硬化高血脂症2、有提高肌肉活力的功能3、促进皮肤蛋白质和胰岛素的合??四。
酪氨酸(TYR)1、造肾上腺激素、甲状腺激素和黑色素的必需氨基酸2、可防治老年痴呆症3、促进新陈代谢,增进食欲4、对治疗胃溃疡等慢性疾病、神经性炎症及发育不良等效果5、与色素形成有关系,缺乏时会利白化症五. 组氨酸(HIS)1、参与血球蛋白合成,促进血液生成2、产生组氨、促进血管扩张,增加血管壁的渗透性3、医治胃病、十二指肠等有特效4、促进腺体分泌,对过敏性疫病有效果5、可治疗消化性溃疡、发育不良等症状6、对治疗心功能不全、心绞痛、降低血压、哮喘及类风湿关节炎有效果六。
苏氨酸(THR)人体必需,缺乏时会使人消瘦,甚至死亡七. 丙氨酸(ALA)1、能促进血液中酒精的代谢(分解)作用增强肝功能,有保肝护肝作用2、甜味为砂糖的1。
2倍八。
异亮氨酸(ILE)1、能维持机体平衡,治疗精神障碍2、有促进食欲的增加和抗贫血的作用3、如果缺乏时,会出现体力衰竭,昏迷等症状九。
色氨酸(TRY)1、促进血红蛋白的合成2、防治癞皮病3、促进生长,增加食欲4、甜味为砂糖的35倍,配制生产的低塘食物等对糖尿病、肥胖病人食用较好十。
胱氨酸(CYS)1、有治疗脂肪肝和解毒效果2、治疗皮肤的损伤,对病后、产后脱发有疗效十一。
赖氨酸(LYB)1、参与结缔组织、微血管上皮细胞间质的形成,并保持正常的渗透性2、可增加食欲,促进胃蛋白酶的分泌,增强免疫能力,改善发育迟缓,防止蛀牙,促进儿童生长3、提高钙的吸收,促进骨骼生长4、如果缺乏,会降低人的敏感性,妇女会停经,出现贫血、头晕、头昏和恶心等病状十二。
各种氨基酸理化性质-20101202综述

分子式:C2H5NO2 化学式:NH2CH2COOH 结构式
分子量:75.07
物化性质:甘氨酸是20个氨基酸中最简单的一个,是一个非极性的氨基酸。白
色单斜晶系 或六方晶系晶体,或白色结晶粉末,无臭,有特殊甜味; 相对密度1.16,熔点 248℃(分解),易溶于水;在水中的溶解度: 25℃ 时为 25g/100ml,50℃时为 39.1g/100ml,75℃时为 54.4g/100ml,100℃时为67.2g /100ml;极 难溶于乙醇,在100g无水 乙醇中约溶解 0.06 g,几乎不溶于丙酮 和乙醚;等电点6.06。
2.合成法:合成法很多,一种是由异丁酸与氨生成氨基异丁醇,再与氰化氢合 成氨基异丁腈,然后水解而成。一种是由异丁醛与氰化氢合成羟基异丁腈,水解 得DL-缬氨酸,经化学法或酶法拆分得L-缬氨酸。也可由异丁醛与氰化钠和氯化铵 直接合成氨基异丁腈,再水解而成。上述三种方法的得率为36%~40%。合成法 所得为外消旋体,须经外消旋拆开。旋光拆开的方法很多,如用酰基-DL-氨基
各种氨基酸性质
酸的酶进行水解,再利用游离氨基酸与酰化体的溶解度差进行分离。化学合成法生产 成本高,反应复杂,步骤多,且有许多副产物。
3.发酵法:利用微生物发酵法生产L-缬氨酸具有原料成本低、反应条件温和及易实 现大规模生产等优点,是一种非常经济的生产方法。 (1)添加前体物发酵法:又称微生物转化法。这种方法使用葡萄糖作为发酵碳源 ,再添加特异的前体物质即在氨基酸生物合成途径中的一些合适中间代谢产物,以避 免氨基酸生物合成途径中的反馈调节作用,经微生物作用将其有效转化为目的氨基酸 。由于其前体物质如丙酮酸等稀少或价格昂贵,目前已少采用此法生产L-缬氨酸。 (2)直接发酵法:是借助于微生物具有合成自身所需氨基酸的能力,通过对特定微 生物ide诱变处理,选育出营养缺陷型及氨基酸结构类似物抗性突变株,以解除代谢调 节中的反馈抑制和反馈阻遏作用,从而达到过量累积某种氨基酸的目的。目前,世界 上L-缬氨酸均采用直接发酵法生产。国外曾对发酵法所用L-缬氨酸优良生产菌株的诱 变育种和代谢调节作了一些研究,而国内尚处于研究与小规模生产阶段,菌株产酸水 平不高,生产水平和产量远不能满足市场需求。因此,以微生物发酵法生产L-缬氨酸 的研究具有重要的意义。
20种常见氨基酸缩写及结构式

20种常见氨基酸缩写及结构式氨基酸是构成蛋白质的基本单位,在生物体内起着重要的功能。
根据氨基酸的性质和结构,可以将其分为20种常见的氨基酸。
下面将逐一介绍这些氨基酸的缩写及结构式。
1. 丙氨酸 (Ala)结构式:H₃N⁺─C─(CH₃)─COO⁻2. 缬氨酸 (Val)结构式:H₃N⁺─C─(CH(CH₃)₂)─COO⁻3. 亮氨酸 (Leu)结构式:H₃N⁺─C─(CH₂)₄─CH(CH₃)₂─COO⁻4. 异亮氨酸 (Ile)结构式:H₃N⁺─C─(CH(CH₃)CH₂CH₃)─COO⁻5. 萘丙氨酸 (Phe)结构式:H₃N⁺─C─(C₆H₅)─COO⁻6. 苯丙氨酸 (Tyr)结构式:H₃N⁺─C─(C₆H₄OH-2)─COO⁻7. 色氨酸 (Trp)结构式:H₃N⁺─C─(C₈H₇N)─COO⁻8. 丝氨酸 (Ser)结构式:H₃N⁺─C─(OH)─CH₂─COO⁻9. 蘇氨酸 (Thr)结构式:H₃N⁺─C─(CH(OH)CH₃)─COO⁻10. 酪氨酸 (Cys)结构式:H₃N⁺─C─(SH)─CH₂─COO⁻11. 蘇胺酸 (Met)结构式:H₃N⁺─C─(CH₂)₂─S─CH₃─COO⁻12. 青黴胺酸 (Asn)结构式:H₃N⁺─C─(CH₂)─CONH₂─COO⁻13. 谷氨酰胺酸 (Gln)结构式:H₃N⁺─C─(CH₂)₂─CONH₂─COO⁻14. 天冬氨酸 (Asp)结构式:H₃N⁺─C─(CH₂)─COOH15. 谷氨酸 (Glu)结构式:H₃N⁺─C─(CH₂)₂─COOH16. 赖氨酸 (Lys)结构式:H₂N─(CH₂)₄─NH₂─C─COO⁻17. 精氨酸 (Arg)结构式:H₃N⁺─(CH₂)₃─NH─C(NH₂)─NH₂─COO⁻18. 脯氨酸 (Pro)结构式:H₆C₂─C─(NH₂)─COO⁻19. 天冬酸 (Gly)结构式:H₃N⁺─C─COO⁻20. 组氨酸 (His)结构式:H₃N⁺─C─(C₆H₂N₃)─COO⁻以上是20种常见氨基酸的缩写及其结构式。
20种天然氨基酸中英对应及结构特性整理

20种氮基酸T ABLE 2.2 Abbreviations for amino acidsThree-letter One-letter Amino acid abbreviation abbreviation Three-letter One-letter Amino acid abbreviation abbreviationAlanine AlaA Methionine Met M Arginine Arg R Phenylalanine Phe F Asparagine Asn N Proline Pro P Aspartic acid Asp D Serine Ser S Cysteine Cys C Threonine Thr T Glutamine Gin Q Tryptophan Trp W Glutamic acid Glu E Tyrosine Tyr Y Glycine Gly G ValineVai V Histidine His H Asparagine or AsxB Isoleucine lie 1 aspartic addLeucine Leu L Glutamine or GlxZLysineLysK glutamic acidTable 22 SixthO 2007 W.H.Ff ccman And C ompany脂肪侧链al iphatic side 较大的氨基酸是疏水的氨基酸,它们在水中将簇合而不与水接触,可溶,但水溶性较差, 脂溶性好。
水溶性蛋白质三维结构的稳定性来自于蛋白质疏水氨基酸侧链簇合,即疏水效应 名称 英文 结构 特性 甘氨酸 glycine/'glaiisin,/ y♦w -■ 、oo-M严无手性c丙氨酸alanine/^ls 『in/唯一成环氨基酸,氮基酸的侧链既与a- 碳原子结合又与a-氮基N-原子结合,缺 少H-bond donor,无法形成a 螺旋结构颉氨酸 valine/'vaeliin/大脂肪侧链亮氨酸 异亮氨酸 •H 川’、oxr大脂肪侧链大脂肪侧链甲硫氨酸methionine/me £aio ni:n/大脂肪侧链脯氨酸proline/'pro 11 in/苯丙氨酸 phenylalanine/ifenaI *ael9 inin/侧链有芳杳环,疏水氨基酸络氨酸 tyrosine/'taira isin/ 邑氨酸 tryptophan/■tripta ifaen/ 丝氨酸 serine/ 'seriin/ COO-酪氨酸的芳香环有一个務基。
氨基酸的分类特点和理化性质

氨基酸的分类特点和理化性质氨基酸是构成蛋白质的基本单位,具有多种功能和作用。
根据它们的理化性质和分类特点,氨基酸可以分为非极性氨基酸、极性氨基酸和特殊氨基酸。
1.非极性氨基酸:非极性氨基酸的中心原子由一个氨基基团(NH2)、一个羧基(COOH)、一个氢原子(H)和一个碳原子(C)组成。
这类氨基酸的侧链由多种有机基团组成,不带任何阳离子或阴离子功能性团。
它们通常不溶于水,但溶于有机溶剂。
在生物体内,非极性氨基酸主要负责蛋白质的折叠和稳定。
在非极性氨基酸中,最简单的是甘氨酸、丙氨酸和异亮氨酸等。
这些氨基酸的侧链中带有碳和氢原子,由于不带电荷,属于非极性,因此有亲水性较强。
2.极性氨基酸:这类氨基酸的侧链通常包含含氧或氮等具有强电负性的原子,可以形成氢键、离子键等。
大多数极性氨基酸具有亲水性,能与水进行相互作用,因此溶解度较高。
极性氨基酸可以进一步分为酸性和碱性氨基酸。
-酸性氨基酸:这类氨基酸的侧链含有羟基和羧基,具有负电荷。
代表性的酸性氨基酸有天冬氨酸和谷氨酸等。
这些氨基酸在水溶液中具有酸性,能够释放出负电荷的氢离子,与基性氨基酸发生中和反应。
-碱性氨基酸:这类氨基酸的侧链含有氨基和胺基等功能性团,在水溶液中带正电荷。
代表性的碱性氨基酸有赖氨酸和精氨酸等。
这些氨基酸能够接受负电荷的氢离子,与酸性氨基酸发生中和反应。
3.特殊氨基酸:这是一类在生物体中含量较少,具有特殊功能和结构的氨基酸。
代表性的特殊氨基酸有脯氨酸、半胱氨酸、甲硫氨酸等。
这些氨基酸的结构中具有额外的官能团,能够参与特殊的生化反应和代谢途径。
总的来说,氨基酸的分类特点主要根据其理化性质和功能特点来区分。
非极性氨基酸主要由碳和氢原子组成,溶解度较低,主要负责蛋白质的结构稳定;极性氨基酸具有亲水性,溶解度较高,包括酸性和碱性两种,具有酸碱中和的作用;特殊氨基酸则具有特殊的结构和功能,用于特定的生化反应和代谢途径。
这些特征使得氨基酸能够在生物体内进行多种功能的发挥,并形成复杂的蛋白质结构。
氨基酸的结构与性质

氨基酸的结构与性质氨基酸是生命中的基本分子之一,它是构成生物体内蛋白质的组成单元,同时还在许多代谢反应中发挥重要作用。
氨基酸的结构与性质涉及到它的化学组成、空间结构以及在生物体内的功能。
以下将详细介绍氨基酸的结构与性质。
一、氨基酸的化学结构:氨基酸由中心碳原子(α-C)和与之相连的四个基团组成:氨基(-NH2)、羧基(-COOH)、一个氢原子(-H)和一个侧链基团(R)。
1.氨基:-NH2,和一个氢原子连接,是氨基酸的一个常见特点。
2.羧基:-COOH,和一个氢原子连接,为氨基酸的另一个特点。
3.氢原子:-H,连接在中心碳原子上,可以与侧链基团相互作用。
4.侧链基团:R是氨基酸的特异性标志,不同的R导致了不同的氨基酸种类。
二、氨基酸的分类:氨基酸可以根据其侧链基团的性质被分为极性、非极性、酸性和碱性氨基酸。
1.极性氨基酸:侧链中含有氢键供体或受体,可以与其他极性物质相互作用。
酪氨酸、赖氨酸、组氨酸等就是极性氨基酸的代表。
2.非极性氨基酸:侧链中没有明显的极性基团,通常是脂溶性的。
丙氨酸、丝氨酸、亮氨酸等都属于非极性氨基酸。
3.酸性氨基酸:侧链中含有羧基,可以失去质子。
谷氨酸、门冬氨酸是常见的酸性氨基酸。
4.碱性氨基酸:侧链中含有氨基,在适当的条件下可以接受质子。
赖氨酸、精氨酸等属于碱性氨基酸。
三、氨基酸的空间结构:氨基酸通常以L型存在,这是由于侧链基团的位置而决定的。
在L型氨基酸中,羧基位于左侧,而氨基位于右侧。
D型氨基酸存在于一些细菌细胞壁中,而在自然界中D型氨基酸几乎不见。
氨基酸的侧链基团的位置和性质决定了氨基酸的生物功能和化学反应。
侧链基团的大小、电荷、极性、亲水性等属性对蛋白质的结构和功能起着重要的影响。
四、氨基酸的性质:1.酸碱性:氨基酸可以通过羧基中的羟基(-OH),羟基的质子(H+),以及氨基中的氨基质子(NH3+)与其他分子发生酸碱反应。
2.缔合特性:在生物体内,通过形成酯、肽和烷基缔合等化学反应,氨基酸可以与其他分子形成化学连接。
20种氨基酸及缩写
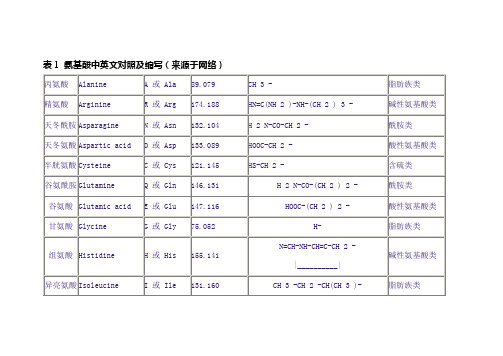
表1 氨基酸中英文对照及缩写(来源于网络)
图1 氨基酸密码子表(来源于网络)
20种氨基酸按理化性质可分为4组:
①非极性、疏水性氨基酸:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸和脯氨酸
②极性、中性氨基酸:色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺和苏氨酸
③酸性的氨基酸:天冬氨酸和谷氨酸
④碱性氨基酸:赖氨酸、精氨酸和组氨酸
1、必须氨基酸:携一本蛋色书来[缬氨酸,异亮(亮)氨酸,苯丙氨酸,蛋氨酸,色氨酸(甲硫氨酸),苏氨酸,赖氨酸,]
2、半必须氨基酸:半斤组[精(斤)氨酸,组氨酸]
3、含硫氨基酸:硫甲硫,胱半胱[甲硫氨酸,半胱氨酸,胱氨酸]
4、芳香族氨基酸:老芳本色[酪氨酸,苯丙氨酸,色氨酸]
5、支链氨基酸:支姐,亮一亮[缬氨酸,亮氨酸,异亮氨酸]
6、非极性疏水性氨基酸:非姐,脯亮一亮,(给你)本饼干[缬氨酸,脯氨酸,亮氨酸,异亮氨酸,苯丙氨酸,丙氨酸,甘氨酸]
7、酸性氨基酸:酸谷天(三伏天)[谷氨酸,天冬氨酸]
8、碱性氨基酸:碱组精赖[组氨酸,精氨酸,赖氨酸]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H
芳香族类
脯氨酸
Proline
Pro
P
—
H%Koo-
H2
亚氨基酸
(
+h3n—(
r
「CH3 I"
:—COO-
<
脂肪族类
异亮氨 酸
Isoleucine
lie
1
(
(
H―(
+H3N—(
CH3
:—COO-
脂肪族类
丝氨酸
)
Serine
Ser
S
+h3n—
□H
:—COO-
L
含羟基类
苏氨酸
Th re onine
Thr
T
d
+h5n—(
F
—ch3
:-co “
含羟基类
天冬氨 酸
Arspartic acid
H
酰胺类
精氨酸
Arginine
Arg
A
R
H2*:
J
c c
+H3N—:
1!
h2
h2
h2
―OCT
1
碱性氨基 酸类
赖氨酸
Lysine
Lys
K
*
“H3N—c—COO-
H
$
碱性氨基 酸类
组氨酸
Histidine
His
H
H
%)
*h3n—
H
T
-C—OCT
1
H
碱性氨基 酸类
半胱氨 酸
Cysteine
Cys
C
♦H3N“、C0(r
含硫类
甲硫氨 酸(蛋氨 酸)
a
Methionine
Met
M
+h3n—
i
严
C—00-
含硫类
苯丙氨 酸
Phe ny lalanine
Phe
F
H
H广、『
^U-coo-
H
芳香族类
酪氨酸
Tyrosi ne
Tyr
Y
HO-xAh
•HyN―C—COO"
H
一
芳香族类
色氨酸
Thyptophan
Trp
W
H
HC\ L
h/Y
20种氨基酸基本性质列表
中文名
英文名
缩写
符号
结构
分子量
pl
基本性质
甘氨酸
Glyci ne
Gly
G
H
+h3n一c—coo-
H
脂肪族类
丙氨酸
Alanine
Ala
A
+H3N——
r
C—OCT
I
脂肪族类
烦氨酸
Valine
Vai
V
严
H——CH3
+h3n—c—COO-
H
]
脂肪族类
亮氨酸
Leucine
Leu
L
H—(
Asp
D
心0
1
r
+H3N——C一COO-
H
酸性氨基 酸类
天冬酰 胺
Asparagine
Asn
N
0、/NH2
ch2
+h3n—C—COO"
H
1
酰胺类Βιβλιοθήκη 谷氨酸Glutamic acid
Glu
E
°*“o
1
+H3N—C—COO"
H
酸性氨基 酸类
谷氨酰 胺
•
Glutamine
Gin
Q
°、/NH2
1严 严
+h3n——c—COO-
