弱电解质电离平衡的影响因素
弱电解质电离平衡的影响因素教学设计1

高二化学选修四第三章第一节水溶液中的电离平衡影响弱电解质电离平衡的因素第二课时一、教材分析本课时内容出现在人教版选修四第三章第一节及课后习题1、2题(见P43),教材第二章已经研究了影响化学平衡移动的影响因素-----勒夏特列原理,分析影响弱电解质电离平衡的因素既是对学生知识掌握程度的巩固和检验,又是对勒夏特列原理的运用和升华,对本章第二节水的电离平衡移动的影响及第三节盐类水解平衡移动的影响的学习作准备,有承上启下的作用。
二、学情分析学生已经学习了影响化学平衡移动的影响因素-----勒夏特列原理,在学习中对平衡移动的基本结论记忆较好,运用不够,对“只削弱不抵消”理解困难,本课时学习,有助于学生进一步加深对勒夏特列原理的理解和加强勒夏特列原理的运用。
三、学法分析1、实验探究法:补充实验,探究醋酸溶液中加入镁、氢氧化钠固体、醋酸钠固体等对电离平衡的影响。
(培养学生实验探究意识)2、小组讨论法:相互交流,分析实验现象的原因,形成结论。
(培养学生证据推理能力)四、教学目标1、知识目标:掌握弱电解质电离平衡影响因素,能正确运用规律分析、解决问题2、技能目标:学会实验探究和控制变量法3、德育目标:培养学生严谨的学习态度五、教学重难点教学重点:浓度、温度、同离子效应及反应效应等外界条件改变对弱电解质电离平衡的影响教学难点:浓度改变对弱电解质电离平衡的影响六、教学准备补充实验准备:1mol/L醋酸溶液、冰醋酸、氢氧化钠固体、镁带、醋酸钠固体、蒸馏水、石蕊试剂、酒精灯、试管夹若干、试管架、火柴七、教学过程课前案---温故知新(自主完成,小组讨论)课中案-----孜孜以求[活动一实验探究醋酸电离平衡的影响][学以致用]课后案---勇攀高峰1、欲使醋酸溶液中的CH3COO-浓度增大,电离平衡向右移动,且不放出气体,可向醋酸溶液中加入少量固体()A.NaOH B.NaHCO3C.CH3COOK D.Mg2、在醋酸中存在电离平衡:CH3COOH CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是()A.加入NaOH(s) B.加入盐酸C.加蒸馏水D.升高温度3、已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是()①加少量烧碱固体②升高温度③加少量冰醋酸④加水A.①②B.②③C.③④D.②④4、一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如右图所示曲线,请回答。
弱电解质的电离(含解析)

第一节弱电解质的电离1.了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。
3.了解弱电解质在水溶液中的电离平衡。
(中频)弱电解质的电离平衡1.电离平衡的建立在一定条件(如温度、浓度)下,当弱电解质分子离解成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到了平衡。
2.电离平衡的特征3.外界条件对电离平衡的影响电离是一个吸热过程,主要受温度、浓度的影响。
以弱电解质CH 3COOH 的电离为例: CH 3COOHCH 3COO -+H +⎩⎪⎪⎨⎪⎪⎧平衡右移⎨升高温度加水稀释增大c (CH 3COOH )平衡左移降低温度增大c (H +)或c (CH 3COO -)电离平衡常数 1.表达式(1)对于一元弱酸HA :HA H++A-,平衡常数K=c(H+)·c(A-)c(HA);(2)对于一元弱碱BOH:BOH B++OH-,平衡常数K=c(B+)·c(OH-)c(BOH)。
2.意义相同条件下,K值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
3.特点(1)多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第一步电离。
1.易误诊断(正确的打“√”,错误的打“×”)。
(1)溶液导电能力弱的电解质一定是弱电解质( )(2)弱电解质浓度越大,电离程度越大( )(3)温度升高,弱电解质的电离平衡右移( )(4)0.1 mol/L某一元酸HA溶液的pH=3,HA溶液中存在:HA===H++A-( )(5)温度不变,向CH3COOH溶液中加入CH3COONa,平衡左移( )(6)电离平衡常数(K)越小,表示弱电解质电离能力越弱( )(7)不同浓度的同一弱电解质,其电离平衡常数(K)不同( )(8)电离平衡右移,电离平衡常数一定增大( )【答案】(1)×(2)×(3)√(4)×(5)√(6)√(7)×(8)×2.NH3·H2O在水溶液中的电离方程式为:__________________________,其电离常数表达式为:_____________________________________________。
高考化学弱电解质的电离平衡

2.电离平衡常数的应用 (1)判断弱酸(碱)的相对强弱。电离常数越⑥ 大 ,酸性(或碱性)越 强。 (2)判断盐溶液的酸(碱)性强弱。电离常数越大,对应盐的水解程度越⑦
小 ,盐溶液的碱(酸)性越⑧ 弱 。 (3)判断复分解反应能否发生。一般遵循“强酸制弱酸”规律。 (4)判断粒子浓度比值的变化。 (5)判断电离平衡的移动方向。当Qc>K时,平衡⑨ 逆向 移动;当Qc=K 时,达到平衡状态;当Qc<K时,平衡⑩ 正向 移动。
自主测评 1.判断正误(正确的画“√”,错误的画“✕”)。
(1)电离常数受溶液浓度的影响 ( ✕ ) (2)电离常数可以表示弱电解质的相对强弱 ( √ )
(3)电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大
(✕ )
(4)H2CO3的电离常数表达式:Ka= c2 (H ) c(CO32 ) ( ✕ ) c(H2CO3 )
2.弱电解质的电离平衡
(1)电离平衡的建立
(2)电离平衡的特征
(3)影响电离平衡的外界条件
外界条件
温度
升高温度
浓度
稀释溶液
加入含有与弱电解质相 同离子的强电解质
加入能与弱电解质电离出的离子反应的物质
电离平衡 移动方向 向⑨ 右 移动 向 右 移动 向 左 移动
向 右 移动
电离程 度变化 ⑩ 增大 增大 减小
7.已知:NH3·H2O NH 4 +OH- ΔH>0,对于0.1 mol·L-1的氨水,改变条件 时,请将正确结果填入下表空白处:
改变的条件
平衡移 动方向
n(OH-)
c(OH-)
导电能力
Kb
加NaOH固体
弱电解质的电离时

1、能应用化学平衡理论描述弱电解质在水溶 液中旳电离平衡; 2、了解弱电解质旳电离平衡以及外界条件对 电离平衡旳影响; 3.明白电解质和我们旳生活是分不开旳,培 养学习化学旳爱好。 要点难点:弱电解质旳电离平衡
知识回忆
文档仅供参考,如有不当之处,请联系改正。
不移旳有:____⑦______
此时溶液中弱电解质分子和电 离出来旳阴、阳离子并存。
二、弱电解质旳电离平衡 文档仅供参考,如有不当之处,请联系改正。
2、特点 逆 电离过程和分子化过程 动 电离平衡是一种动态平衡 等 V电离=V分子化== 0 定 溶液中分子、各离子浓度不变 变 条件变化,电离平衡发生移动
文档仅供参考,如有不当之处,请联系改正。
1、化学平衡
①概念:指旳是在一定条件下旳可逆反应中正反应速
率等于逆反应速率,反应混合物中各组分旳浓度保 持不变旳状态。 ②特征:逆,等,动,定,变。 ③影响原因:温度、浓度、压强 2、强电解质①概念 在水溶液中完全电离旳电解质
②存在形式 离子 弱电解质①概念 在水溶液中部分电离旳电解质
②存在形式 离子、分子
冰醋酸
右
减小 增大 增大 增大
醋酸钠(s) 左
减小 减小 减小 增大
HCl(g)
左
减小 增大 增大 减小
NaOH (s) 右
增大 减小 减小 增大
探究点二文档仅供参考,如有不当之处,请联系改正。
弱电解质加水稀释时,电离程度 __变__大____,离子浓度__不__能__拟__定___? (填 变大、变小、不变或不能拟定)
电离平衡和化学平衡一样,当外界 条件变化时符合勒夏特列原理。
探究点一 文档仅供参考,如有不当之处,请联系改正。
弱电解质的电离平衡

弱电解质的电离一、电离平衡常数(1)概念:在一定条件下达到平衡时,弱电解质电离形成的各种离子浓度的乘积与溶液中未电离的物质的浓度之比是一个常数,该常数成为电离平衡常数,简称电离常数。
(2)表达式:弱酸的电离平衡常数用Ka表示,如: HA H+ + A-,则Ka=弱碱的电离平衡常数用Kb表示,如:MOH M++ OH-,则Kb=多元弱酸电离是电离,以第步电离为主;多元弱碱电离一般认为一步电离完成。
(3)意义:电离平衡常数表征了弱电解质的电力能力,根据同温下电离常数的大小可以判断弱电解质电离能力的相对强弱。
K值越大,电离程度,弱酸酸性(弱碱碱性)。
(4)影响因素:电离平衡常数只随的变化而变化,升高温度,K值。
二、弱电解质电离平衡的特点和影响因素(1)电离平衡特点为:动、等、定、变(2)弱电解质稀溶液加水稀释时,电离平衡向电离方向移动,促进电离,平衡混合物中微粒总浓度、离子数、离子浓度与溶质分子浓度的比值均增大,但离子总浓度减小,导电能力减弱。
(3)条件改变时,弱电解质的电离平衡会发生移动,但K值只随温度的改变而改变。
例1:向0.1 mol/L的CH3COOH溶液中加水或加入少量的CH3COONa晶体时,下列有关叙述不正确的是() A.都能使溶液的pH增大 B.都能使溶液中c(H+)·c(CH3COO-)增大C.溶液中的c(H+)·c(OH-)不变D.都能使溶液中c(CH3COO-)/c(CH3COOH)增大例2:用水稀释0.1 mol/L NH3·H2O时,溶液中随着水量的增加而减小的是( )A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/ c(OH-)C.c(H+)和c(OH-)的乘积 D.OH-的物质的量三、强酸与弱酸的比较及判断电解质强弱的方法(1)等物质的量浓度或等pH的强酸与弱酸的比较等物质的量浓度盐酸(a)与醋酸溶液(b)等pH的盐酸(a)与醋酸(b)pH或物质的量浓度 pH: 物质的量浓度:溶液的导电能力水的电离程度c(cl-)与c(CH3COO-)等体积溶液中和NaOH的量分别加该酸的钠盐固体后pH变化开始与金属反应的速率M A B 等体积溶液与金属反应长生H 2量(2)判断电解质强弱的方法 a.浓度与pH 的关系。
弱电解质的电离平衡教案

弱电解质的电离平衡教案第一章:弱电解质的概念教学目标:1. 理解弱电解质和强电解质的基本概念。
2. 掌握弱电解质的电离特点。
教学内容:1. 电解质与非电解质的概念。
2. 强电解质与弱电解质的概念及区别。
3. 弱电解质的电离特点及电离平衡。
教学方法:1. 采用讲授法,讲解电解质、弱电解质的概念及电离特点。
2. 利用案例分析,让学生通过实际例子理解弱电解质的电离平衡。
教学活动:1. 导入新课,回顾电解质与非电解质的概念。
2. 讲解强电解质与弱电解质的概念及区别。
3. 通过案例分析,让学生了解弱电解质的电离特点及电离平衡。
作业布置:1. 复习弱电解质的概念及电离特点。
2. 举例说明生活中常见的弱电解质。
第二章:电离平衡的表示方法教学目标:1. 掌握电离平衡的表示方法。
2. 理解电离平衡的移动原理。
教学内容:1. 电离平衡的表示方法。
2. 电离平衡的移动原理。
教学方法:1. 采用讲授法,讲解电离平衡的表示方法及移动原理。
2. 利用图表和动画演示,让学生直观地理解电离平衡的移动过程。
教学活动:1. 导入新课,讲解电离平衡的概念。
2. 讲解电离平衡的表示方法。
3. 通过图表和动画演示,让学生了解电离平衡的移动原理。
作业布置:1. 复习电离平衡的表示方法。
2. 分析实例,判断电离平衡的移动方向。
第三章:弱电解质电离平衡的影响因素教学目标:1. 掌握影响弱电解质电离平衡的因素。
2. 能分析实际问题,运用影响因素解释电离平衡的移动。
教学内容:1. 温度对电离平衡的影响。
2. 浓度对电离平衡的影响。
3. 压强对电离平衡的影响。
教学方法:1. 采用讲授法,讲解影响弱电解质电离平衡的因素。
2. 利用实验和实例,让学生了解各个因素对电离平衡的影响。
教学活动:1. 导入新课,讲解影响弱电解质电离平衡的因素。
2. 通过实验和实例,让学生了解温度、浓度和压强对电离平衡的影响。
3. 分析实例,让学生运用影响因素解释电离平衡的移动。
浅析外界因素对弱电解质电离平衡的影响

浅析外界因素对弱电解质电离平衡的影响作者:崔金龙来源:《学校教育研究》2015年第19期吉林省白山市抚松县抚松第六中学崔金龙电离平衡的知识是高中化学重要的基础理论,既是学习的重点,也是学习的难点。
这里我主要说一下外界因素对弱酸,弱碱的电离平衡的影响,弱酸,弱碱的电离平衡是一个动态平衡,当外界条件改变时,电离平衡也会发生移动,从而使得弱酸或弱碱的电离程度有所增减。
因此,可以应用平衡移动原理,通过外界改变条件,控制弱酸,弱碱的电离程度。
下面主要讨论外界条件对弱酸弱碱电离平衡的影响,更好的帮助学生们掌握好这部分知识。
一、结论归纳1.温度的影响例1:某浓度的醋酸溶液中存在以下平衡:CH3COOH CH3COO—+H+ ; △H>0若升高温度,则下列说法中正确的是( ; ; )A.平衡向左移动B. c(H+)减少C.n(H+)增多D. c(CH3COOH)增大解析:由于弱电解质的电离过程是吸热反应,升高温度,使得电离平衡向电离的方向移动。
对于醋酸溶液的电离平衡来说,平衡向右移动,c(CH3COOH)减少, c(CH3COO-)、c(H+)均增大;n(H+)增多。
答案:C结论1:因弱电解质的电离过程是吸热反应,升高温度,使得电离平衡向电离的方向移动。
2.浓度的影响例2:将0.1mol/L氨水溶液加水稀释,下列说法正确的是( ; ;)A. 溶液中c(H+)和c(OH-)都减小B. 溶液中c(H+)增大C. 氨水电离平衡向左移动D. 溶液的pH增大解析:弱电解质存在着电离平衡,加水稀释平衡发生移动,c(OH-)减少,但是c(H+)增大,PH减少,平衡左移。
答案:C结论2:浓度越大,电离程度越小;浓度越小,电离程度越大。
稀释溶液,电离平衡向电离方向移动。
3.同离子效应例3:在含有酚酞的0.1mol·L-1氨水中加入少量的NH4Cl晶体,则溶液颜色( ; ; )A.变蓝色B.变深C.变浅D.不变解析:因为NH3·H2O ; NH4+ + OH—,加入少量的NH4Cl晶体后,c (NH4+)变大平衡会向着左边移动,所以 c(OH-)变小了,红色变浅。
【知识解析】弱电解质的电离平衡
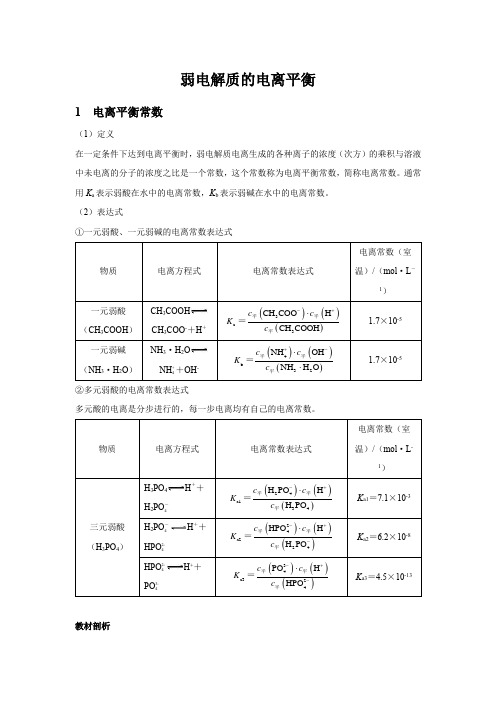
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
弱电解质电离平衡的影响因素
弱电解质电离平衡的影响因素包括以下几个方面:
1. 温度:温度的升高可以促进弱电解质的电离,因为温度升高会增加分子的热运动,从而增加电离反应的速率。
2. 浓度:弱电解质的电离程度随溶液浓度的增加而增加。
在低浓度下,弱电解质的离子生成速率较低,电离程度较小;而在高浓度下,离子生成速率增加,电离程度增加。
3. 溶剂性质:溶剂的性质可以影响弱电解质电离平衡。
比如,极性溶剂中,由于分子间的相互作用较强,电离程度相对较小;而在非极性溶剂中,由于分子间的相互作用较弱,电离程度较大。
4. 离子效应:离子效应是指溶液中其他离子对弱电解质电离平衡的影响。
例如,溶液中存在与弱电解质离子相同电荷的其他离子时,会减少弱电解质的电离程度;而存在与弱电解质离子相反电荷的其他离子时,会增加弱电解质的电离程度。
总之,温度、浓度、溶剂性质和离子效应是影响弱电解质电离平衡的重要因素。
