Westernblotting溶液配制
WesternBlot相关试剂配方及详细实验步骤

WesternBlot相关试剂配方及详细实验步骤Western Blot详细实验步骤及试剂配方1. 溶液配置1.1 5×SDS-PAGE上样缓冲液(Loading buffer)药品用量1 M Tris-HCl (PH=6.8) 1.25 mLSDS 0.5 gBPB(溴酚蓝,有毒)25 mg甘油 2.5 mL去离子水up to 5 mL分装至1.5 mL离心管中,每管500 μL,室温保存,使用前每管加入25 μL的β-巯基乙醇。
1.2 10×SDS-PAGE电泳缓冲液(Running buffer 母液)药品用量Tris 30.3 gGlycine (甘氨酸) 144.2 gSDS 10 gddH2O up to 1 L室温保存即可,使用时稀释为1×的工作液,可回收反复使用4~5次。
1.3 Tris-HCl缓冲液(1)1.5 M Tris-HCl (PH=8.8)→制分离胶Tris (MW: 121.14) 45.43 gH2O up to 250 mL浓盐酸调PH 8.8(2)1.0 M Tris-HCl (PH=6.8)→制浓缩胶Tris (MW: 121.14) 30.29 gH2O up to 250 mL浓盐酸调PH 6.8二者高压灭菌后,置于室温保存即可。
1.4 10% SDS (十二烷基硫酸钠)SDS 10 gddH2O up to 100 mL室温保存即可。
1.5 10% AP (过硫酸铵)→1.5 mL 离心管配制过硫酸铵(刺激性,腐蚀性) 0.1 g超纯水up to 1 mL混匀后,锡箔纸包住,避光处理,置于-20℃保存。
1.6 30% 丙烯酰胺溶液丙烯酰胺 150 g甲叉双丙烯酰胺 4 gMilli-Q水 30 mL滤纸过滤,Milli-Q水定容至500 mL,装入棕色瓶子中,4℃保存。
1.7 10×转膜缓冲液(Trans buffer 母液)Tris (MW: 121.14) 30.3 gGlycine (甘氨酸) 144 g去离子水 up to 1 L室温保存即可,其1×的工作液配制为:100 mL母液+200 mL甲醇(有毒)+700 mL水。
Westernblot试剂配制及操作流程

Westernblot试剂配制及操作流程试剂配制:1.电泳缓冲液:a. 准备1×蛋氨酸-甘氨酸缓冲液(Tris-Glycine缓冲液):每一升缓冲液中加入30.3g Tris base、288g glycine,并调节pH至8.3±0.1b. 准备3×SDS-凝胶缓冲液:每一升缓冲液中加入30g Tris base、144g glycine、10g SDS,并调节pH至8.3±0.12.蛋白提取缓冲液:a. 准备RIPA缓冲液:每一升缓冲液中加入5g Tris base、15g NaCl、5g sodium deoxycholate、1g NP-40,并将pH调节至7.4b.按需添加蛋白酶抑制剂和磷酸酶抑制剂。
操作流程:1.样品制备:a. 收集细胞或组织样品,加入适量的蛋白提取缓冲液,并使用超声波细胞破碎仪或玻璃Dounce破碎器破碎细胞,释放蛋白。
b.在4℃下离心细胞提取物,收集上清液,并在离心后尽快使用或存储在-80℃的冰箱中。
2.SDS-凝胶制备:a. 准备15%缩胆凝胶:加入7.5mL 30%丙烯酰胺、10mL 10×SDS-凝胶缓冲液、7.5mL去离子水和20uL 10%Tetramethylethylenediamine (TEMED),混合均匀。
b.将混合液倒入立方形凝胶模具中,插入两根不锈钢导电丝作为电极,并进一步注入10%胶解剂。
c.待凝胶定形后,用1×蛋氨酸-甘氨酸缓冲液冲洗凝胶表面。
3.蛋白电泳:a.加载样品:将样品加入离心管中,加入1×电泳缓冲液以使样品浓度均匀。
b. 加载样品:将样品加入凝胶孔中,通常每孔加入20-30ug样品。
c.进行电泳:将装有凝胶的电泳槽放入电泳缓冲液中,将蛋白电泳至凝胶顶部。
d.转移凝胶:根据需求选择湿式或半湿式转印方式,将蛋白转移到PVDF或NC膜上。
4.免疫印迹:a.封闭膜:将转印膜放入封闭溶液中(如5%脱脂奶粉或3%BSA)封闭非特异性结合位点。
western-blot 通用配方

1.Western Blotting 相关溶液及抗体1)转膜缓冲液(running buffer)(10×)(1L)Tris 30.3g甘氨酸144g不调pH转膜工作液(1×)(1L)(现配现用)(10×)转膜缓冲液(running buffer)100ml无水乙醇100ml水800ml2)TBS 缓冲液(5×)(1L)Tris-HCl 12.15gNaCl 146.4g用36-37%浓盐酸调节pH值至约7.4(约5ml浓盐酸,pH试纸检测即可)TBST:TBS+Tween-20 0.1%(1ml for 1L)3) 封闭液TBST 缓冲液中加入5%脱脂奶粉或者(3% Gelatine)4)Western Blotting 第一抗体适合于自己蛋白的抗体5)Western Blotting 第二抗体辣根过氧化物酶-羊抗兔IgG/(羊抗鼠IgG)4.实验步骤(1)SDS-PAGE 电泳分离蛋白质:(浓缩胶70V,30-40min;分离胶120V,1h)5×loading buffer: 4mlddH2O 1.76ml 1M Tris-HCl pH 6.8 0.24ml甘油1ml 10%(w/v)SDS 0.8mlß-巯基乙醇0.2ml(2)将4 张滤纸剪成与海棉大小一致的方形(3)配(1×)转膜工作液(10×)转膜缓冲液(running buffer)80ml无水乙醇80ml水640ml800ml(4)将胶泡在(1×)转膜工作液中(防止胶干掉,最好不要用水,水泡胶会涨)(5)用尺子量胶大小,裁PDVF膜(不要用手蹭膜,手上有蛋白)(6)PDVF膜先在无水乙醇中泡约1min,然后泡到(1×)转膜工作液中。
(PDVF膜为疏水性的,先在乙醇中泡会使其亲水性好)(7)将海绵和滤纸在水中浸湿,然后按照一下顺序(整个操作过程中保证膜不能干):白板—海绵—两层滤纸--PDVF膜(靠正极)--胶(靠负极)(用小试管排气泡)--两层滤纸—海绵(用小试管排气泡)--夹住—放入胶槽中(白板靠红,黑板靠黑,保证电极方向不要错)--在胶槽中加入转子—倒入(1×)转膜工作液—在胶槽中放入冰袋—80V~100V 恒压,60min(该条件可以转移25kD~90kD的蛋白)(8)封闭:在封闭液中室温,摇1h或者4℃静置过夜。
Westernblot所需溶液的配制

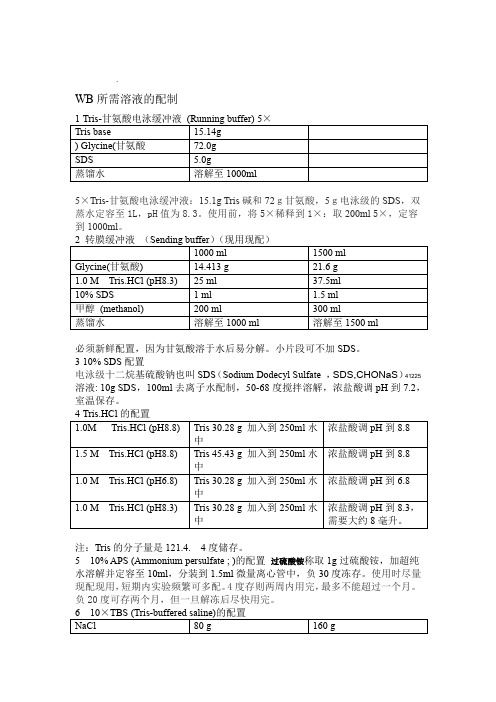
WB所需溶液的配制1Tris-甘氨酸电泳缓冲液(Running buffer) 5×Tris base 15.14gGlycine(甘氨酸) 72.0gSDS 5.0g蒸馏水溶解至1000ml5×Tris-甘氨酸电泳缓冲液:15.1g Tris碱和72g甘氨酸,5g电泳级的SDS,双蒸水定容至1L,pH值为8.3。
使用前,将5×稀释到1×:取200ml 5×,定容到1000ml。
2转膜缓冲液(Sending buffer)(现用现配)1000 ml 1500 mlGlycine(甘氨酸) 14.413 g 21.6 g1.0 M Tris.HCl (pH8.3) 25 ml 37.5ml10% SDS 1 ml 1.5 ml甲醇(methanol) 200 ml 300 ml蒸馏水溶解至1000 ml 溶解至1500 ml必须新鲜配置,因为甘氨酸溶于水后易分解。
小片段可不加SDS。
310% SDS配置电泳级十二烷基硫酸钠也叫SDS(Sodium Dodecyl Sulfate,SDS,C12H25O4NaS)溶液: 10g SDS,100ml去离子水配制,50-68度搅拌溶解,浓盐酸调pH到7.2,室温保存。
4Tris.HCl的配置1.0M Tris.HCl (pH8.8) Tris 30.28 g 加入到250ml水中浓盐酸调pH到8.81.5 M Tris.HCl (pH8.8) Tris 45.43 g 加入到250ml水中浓盐酸调pH到8.81.0 M Tris.HCl (pH6.8) Tris 30.28 g 加入到250ml水中浓盐酸调pH到6.81.0 M Tris.HCl (pH8.3) Tris 30.28 g 加入到250ml水中浓盐酸调pH到8.3,需要大约8毫升。
注:Tris的分子量是121.4. 4度储存。
5 10% APS (Ammonium persulfate ; 过硫酸铵)的配置称取1g过硫酸铵,加超纯水溶解并定容至10ml,分装到1.5ml微量离心管中,负30度冻存。
weston blot相关试剂配方-机能实验室

Western-Blot试剂配制1母液1.1 1.0mol/L Tris•HClTris (MW121.14) 30.29g、蒸馏水200ml溶解后,用浓盐酸调pH至所需点(见下所示),最后用蒸馏水定容至250ml,高温灭菌后室温下保存。
1.2 1.74mg/ml (10mmol/L)PMSFPMSF 0.174g、异丙醇100ml溶解后,分装于1.5ml离心管中,-20℃保存。
1.3 0.2mol/L NaH2PO4NaH2PO4(MW119.98)12g蒸馏水至500ml溶解后,高压灭菌,室温保存。
1.4 0.2mol/L Na2HPO4Na2HPO •12H2O(MW 358.14)71.6g,蒸馏水至1000ml,溶解后,高压灭菌,室温保存。
1.5 10%SDSSDS 10g,蒸馏水至100ml,50℃水浴下溶解,室温保存。
如在长期保存中出现沉淀,水浴溶化后,仍可使用。
1.6 10%过硫酸胺(AP)过硫酸胺0.1g,超纯水 1.0ml,溶解后,4℃保存,保存时间为1周。
时加入超纯水即可)1.7 1.5mol/L Tris•HCl(pH8.8)Tris (MW121.14) 45.43g,超纯水200ml,溶解后,用浓盐酸调pH至8.8,最后用超纯水定容至250ml,室温下保存。
1.8 0.5mol/L Tris•HCl(pH6.8)Tris (MW121.14) 15.14g,超纯水200ml,溶解后,用浓盐酸调pH至6.8,最后用超纯水定容至250ml,室温下保存。
1.9 40%Acr/Bic(37.5:1)丙稀酰胺(Acr)37.5g、甲叉双丙稀酰胺(Bic)1g,超纯水至100ml溶解后4℃保存。
使用时恢复至室温且无沉淀。
1.10 30%Acr/Bic(29:1)丙稀酰胺(Acr)29g、甲叉双丙稀酰胺(Bic)1g,超纯水至100ml溶解后4℃保存。
使用时恢复至室温且无沉淀。
1.11 20%Tween20Tween20 20ml,蒸馏水至100ml,混匀后4℃保存。
westernblotting试剂配制

westernblotting试剂配制Western Blot试剂配制Lower buffer(PH8.8)Tris base 18.15g⽤1mol/LHCl 调PH⾄8.8加ddH2O完全溶解后定容⾄100mlUpper buffer (PH6.8)Tris base 12.1g⽤1mol/LHCl 调PH⾄6.8加ddH2O完全溶解后定容⾄100ml10%SDS SDS 粉末10g加ddH2O完全溶解后定容⾄100ml10%AP(4℃保存)过硫酸铵固体0.1g1ml ddH2O30%Acr/Bic: 丙烯酰胺29g甲叉双丙烯酰胺1g加ddH2O完全溶解后定容⾄100ml5%脱脂奶粉(封闭液)脱脂奶粉5g加TBST完全溶解后定容⾄100ml5×电泳缓冲液 Tris Base 15.1g⽢氨酸94gSDS 5g加ddH2O完全溶解后定容⾄1L1×电泳缓冲液5×电泳缓冲液100ml400ml ddH2O1×转移缓冲液Tris 5.8g(半⼲转)⽢氨酸2.9gSDS 0.37g---可以少加甲醇200ml(有毒,最后加)----可以200-250之间,⽤途是固定作⽤加ddH2O完全溶解后定容⾄1L1×TBS缓冲液 TBS缓冲液粉末⼀包加ddH2O完全溶解后定容⾄2LTBST缓冲液500ml 1×TBS缓冲液250ul Tween20显影液⼤包5.2g⼩包0.6g加ddH2O完全溶解后定容⾄100ml定影液⼤包6.6g⼩包1.9g加ddH2O完全溶解后定容⾄100ml脱⾊液甲醇30mlddH2O60ml冰⼄酸10ml六楼(湿转技术) 10X转移缓冲液:Tris 30.26克⽢氨酸151克1000ml双蒸⽔湿转技术; 1X转移缓冲液:10X转移缓冲液100ml⽆⽔甲醇200ml 1000ml双蒸⽔SDS-PAGE蛋⽩电泳胶配制Reagents Separating GEL(12%) Stacking GEL(4%) Distilled water 3.2 ml 2.4mlLower buffer 2.6ml(1.5m PH8.8) ----Upper buffer10% SDS Acrylamide/Bis(30%) 10%Ap(fresh)TEMED----100ul4.0ml100ul5ul1ml(PH6.8)40ul0.536ml20ul4ulTotal 10ml 4ml注意:Acrylamide/Bis(30%)是调节配制胶的浓度,据柳鹏讲10ml体系中1.5mol PH8.8的Lower buffer固定在2.5ml,⽽Distilled water 和Acrylamide/Bis(30%)之和等于7.3ml。
Westernblot所需溶液的配制
.WB所需溶液的配制5×Tris-甘氨酸电泳缓冲液:15.1g Tris碱和72g甘氨酸,5g电泳级的SDS,双蒸水定容至1L,pH值为8.3。
使用前,将5×稀释到1×:取200ml 5×,定容到1000ml。
必须新鲜配置,因为甘氨酸溶于水后易分解。
小片段可不加SDS。
310% SDS配置电泳级十二烷基硫酸钠也叫SDS(Sodium Dodecyl Sulfate,SDS,CHONaS)41225溶液: 10g SDS,100ml去离子水配制,50-68度搅拌溶解,浓盐酸调pH到7.2,室温保存。
注:Tris的分子量是121.4. 4度储存。
5 10% APS (Ammonium persulfate ; )的配置过硫酸铵称取1g过硫酸铵,加超纯水溶解并定容至10ml,分装到1.5ml微量离心管中,负30度冻存。
使用时尽量现配现用,短期内实验频繁可多配。
4度存则两周内用完,最多不能超过一个月。
负20度可存两个月,但一旦解冻后尽快用完。
加HCl调pH到7.6,室温储存。
1 / 3.SDS-PAGE加样缓冲液:pH6.8 0.5mol/L Tris1:21:1或H2O 32ml混匀备用。
按3.2ml,0.05%溴酚蓝1.6ml,12.8ml,巯基乙醇,总蛋20-25ul3min比例与蛋白质样品混nonfat dried milk 或者0.01% antifoam A (Sigma)0.01%(v/v) sodium azide丽春红溶液:12 10毫升。
微升冰醋酸,加入0.05克丽春红,用水稀释至100 毫升)(10004%1)多聚甲醛(PFA)的配制微升氢氧化钠,全300毫升水,60度搅拌溶解,加入40克多聚甲醛,加入800毫升。
调1000PBS,加水定容到度,再加入100毫升的10×部溶解后冷却到4 4。
通风橱过滤,度保存。
pH到7.2-7.4步骤:;至7.4pH0.2%NaOHEDTA,10-20首先加毫升的水溶解再加入使溶解,再调应溶解一个再加另外一个;然后分别加入其他成分,去氧胆酸钠开盖后会飞出,2 / 3.戴口罩。
Western blotting溶液配置以及操作

Western blotting溶液配置:1.裂解液的配置(可以直接买)50mmol/L Tris-CL PH=8.0150mmol/L Nacl0.1% SDS100μg/ml PMSF(可以直接买)1% NP-401%Triton X-1002.10*TBST 1L的配置:(需要)1MTris-base 50ml5M Nacl 30mlTween-20 1ml去离子水800ML 调节PH至7.6 定容至1000ML 3.转膜缓冲液1L 的配置:(需要)甘氨酸14.4gTris-base 3.03g甲醇200ml 加去离子水定容至1L4. 10%脱脂奶粉溶液(安怡)5. 分离胶(10ml)水 3.3ml30%Arc+Bis 4ml分离胶缓冲液 2.5ml10%SDS 0.1ml10%AP 0.1mlTEMED 0.008ml6.浓缩胶(5ml)水 3.4ml30%Arc+Bis 0.83ml浓缩胶缓冲液0.63ml10%SDS 0.05ml10%AP 0.05mlTEMED 0.01ml7.电泳缓冲液(10*)终浓度1倍10倍Tris base 2.5mM 15.1g 60.4gGlycine 192mM 72.1g 288.4gSDS 0.1% 5.0g 20g去离子水到5L 到2L8. 30%Arc+Bis溶液(29gArc +1gBis)/100ml 一般配500ml,过滤,用锡纸避光,4度保存9. 分离胶缓冲液:Tris-HCL PH=8.8 1.5mol/LTris-base: 1.5*121/1000ml=18.15g/100ml 调PH值到8.8,定容到100ml10.浓缩胶缓冲液Tris-HCL PH=6.8 1mol/LTris-base 1*121/1000ml=12.1/100ml 调PH到6.8,定容到100ml 11.10%SDS10gSDS加去离子水到100ml12.10%AP0.1gAP 加去离子水到1ml提取及测定蛋白浓度1.加裂解液,按照1:5(重量/体积),1g组织加5ml裂解液2.冰上匀浆6000rpm*5s*5次3.超声300w 4秒,间隔14秒,共6次(保护复位,工作复位)4.静置1小时5.15000rpm离心15分钟,4度,取上清,测蛋白含量Braford法测浓度(单位:μl)管号0 1 2 3 4 5 Braford 1000 1000 1000 1000 1000 1000 BAS 0 2.5 5 10 15 20 NACL 100 97.5 95 90 85 801.做标准曲线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Western Blotting 所用溶液
1.5 M Tris-HCl (pH 8.8) 500 ml
Tris-base 90.85 g
ddH2O 400 ml
用浓盐酸调pH 至8.8
定容至500 ml,高压灭菌,室温保存。
1 M Tris-HCl (pH 6.8) 500 ml
Tris-base 60.57 g
ddH2O 400 ml
用浓盐酸调pH 至6.8
定容至500 ml,高压灭菌,室温保存。
10%(w/v) AP (过硫酸铵) 20 ml
AP 2g
ddH2O 20 ml
分装到1.5ml离心管,1ml/tube,-20°C保存
10%(w/v) SDS (十二烷基硫酸钠) 100 ml
SDS 10g
ddH2O 90 ml
用磁力搅拌器搅拌直至完全溶解,用水定容至100ml,室温保存。
10x Running Buffer (电泳缓冲液) 500 ml
1X Running Buffer?: 0.025M Tris, 0.25M Glycine, 0.1% SDS
10X Running Buffer?: 0.25M Tris, 2.5M Glycine, 1% SDS
配方:Tris 15.1 g
甘氨酸93.75 g
SDS 5.0 g
ddH2O 400ml,搅拌直至完全溶解后,定容至500ml,室温保存。
电泳时10x Running Buffer取100ml,加ddH2O 900ml,定容至1L,配成1X Running Buffer.
1X Running Buffer可反复使用4-5次。
10x Transfer Buffer (转膜缓冲液) 500 ml
1X Transfer Buffer: 0.025M Tris, 0.192M Glycine, 0.037% SDS,20% Methanol
10X Transfer Buffer: 0.25M Tris, 1.92M Glycine, 0.37% SDS
配方:Tris 15.1 g
甘氨酸72 g
SDS 1.85 g
ddH2O 400ml,搅拌直至完全溶解后,定容至500ml,4°C保存。
转膜时10x Transfer Buffer取100ml,加ddH2O 500ml,Methanol 200ml,再定容至1L,配
成1X Transfer Buffer,冷却至4°C。
湿转法1X Running Buffer可反复使用2-3次。
10x TBS (缓冲液) 1L (20 mM Tris-HCl, pH 7.5)
Tris 24.23 g
NaCl 80.06 g
ddH2O 800ml
pH to 7.5 with HCl.
Top up to 1 L.
高压灭菌,室温保存。
TBST
For 1 L: 100 ml of 10x TBS + 900 ml ddH2O + 1ml Tween20。
