课标版2018年高考化学二轮复习第10讲常见非金属及其化合物课件
高考化学第二轮复习专题非金属及其化合物PPT课件

1.了解硫的物理性质及硫的可燃性。
5
硫及其氧化 物
2.了解二氧化硫与氧气、与水的反应及二氧化硫的 实验室制法。 3.认识二氧化硫的漂白作用与次氯酸的漂白作用
的区别。
1.了解浓硫酸的强氧化性。
6
硫酸及硫酸 2.了解 SO42- 检验方法。 工业 3.了解硫酸的工业制法。
4.初步学会多步反应的计算方法。
下与之缓慢反应
化学性 质
与 H2O 反 应
与碱反应
与酸反应
与有机物 反应
Cl2、Br2、I2 与水反应,既作氧化剂, 又作还原剂;C 与水高温下反应,其
余不反应
Cl2、Br2、I2 与碱反应;Si 与强碱反应; S 与热碱液反应,其余不反应
Cl2、Br2、I2、O2 与还原性酸如 H2SO3、 H2S 反应;S、C 与强氧化性酸如浓 HNO3、浓 H2SO4 反应 O2 与有机物发生氧化反应; 卤素单质与有机物可发生取代反应和
3
卤素的性质 与溴、碘的
提取
1.以氯为例,了解卤素的物理性质和化学性质。 2.从原子的核外电子排布,了解卤素(单质、化合物) 性质的递变性与原子结构的关系。 3.了解海水中提取溴、海带中提取碘。
4
氯及其化合 物的主要性 质及其应用
1.掌握氯气、氯水的化学性质。 2.了解几种重要的含卤素化合物的性质和用途。 3.掌握 Cl-的检验方法。 4.掌握 Cl2 的实验室制法。
实验二:三次滴定中平均每次消耗的 KMnO4 溶液体积
V=20.00
mL+19.98 3
mL+20.02
mL=20.00
mL。
5.00 mL H2O2 溶液中,n(H2O2)=
0.1000
2018届高考化学第二轮专题复习课件常见非金属元素及其化合物
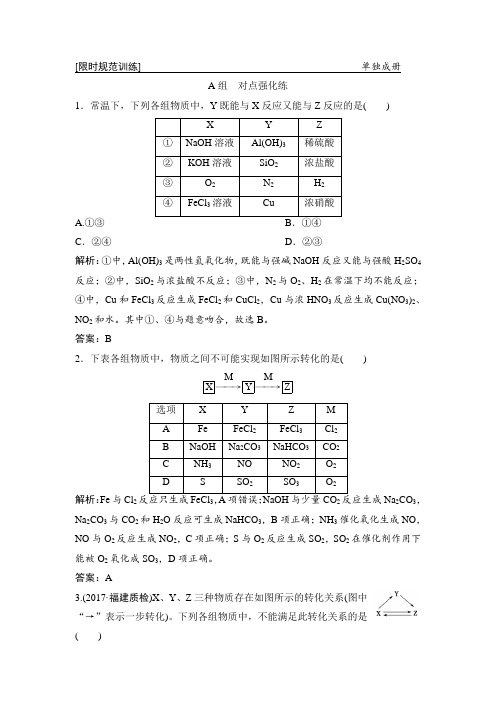
[限时规范训练] 单独成册A 组 对点强化练1.常温下,下列各组物质中,Y 既能与X 反应又能与Z 反应的是( )A.①③ C .②④D .②③解析:①中,Al(OH)3是两性氢氧化物,既能与强碱NaOH 反应又能与强酸H 2SO 4反应;②中,SiO 2与浓盐酸不反应;③中,N 2与O 2、H 2在常温下均不能反应;④中,Cu 和FeCl 3反应生成FeCl 2和CuCl 2,Cu 与浓HNO 3反应生成Cu(NO 3)2、NO 2和水。
其中①、④与题意吻合,故选B 。
答案:B2.下表各组物质中,物质之间不可能实现如图所示转化的是( )X ――→M Y ――→MZ解析:Fe 与Cl 232Na 2CO 3,Na 2CO 3与CO 2和H 2O 反应可生成NaHCO 3,B 项正确;NH 3催化氧化生成NO ,NO 与O 2反应生成NO 2,C 项正确;S 与O 2反应生成SO 2,SO 2在催化剂作用下能被O 2氧化成SO 3,D 项正确。
答案:A3.(2017·福建质检)X 、Y 、Z 三种物质存在如图所示的转化关系(图中“→”表示一步转化)。
下列各组物质中,不能满足此转化关系的是( )解析:NaAlO 22Fe +3Cl 2=====点燃2FeCl 3、2FeCl 3+Fe===3FeCl 2、FeCl 2+Zn===Fe +ZnCl 2、Fe +CuCl 2===FeCl 2+Cu(或Fe +2HCl===FeCl 2+H 2↑),B 项不符合题意;C 项转化关系可以为:2C +O 2=====点燃2CO 、2CO +O 2=====点燃2CO 2、C +O 2=====点燃CO 2、2Mg +CO 2=====点燃2MgO +C ,C 项不符合题意;D 项转化关系可以为:Cl 2+H 2=====点燃2HCl 、HCl +NaOH===NaCl +H 2O 、2NaCl(熔融)=====通电2Na +Cl 2↑、Cl 2+2Na=====点燃2NaCl(或Cl 2+2NaOH===NaCl +NaClO +H 2O),D 项不符合题意。
2018年高考化学二轮专题复习课件:《金属元素及其化合物》 (共24张PPT)

6
5.金属活动性顺序表应用小结
金属活动性 顺序 K Ca Na Pb(H) Mg Al Mn Zn Fe Cu Hg Ag Pt Au Sn
金属原子 K Ca Na Mg Al Mn Zn Fe Sn Pb 失电子能力 依次减小,还原性减弱(相应金属离子氧化性增强) 空气中跟 氧气的反应 易被氧化 加热时 不能被 常温时能被氧化 能被氧化 氧化 不与水反应
答案:A
11
下列关于元素金属性强弱判断的说法正确的是 ( ) ①在一定条件下金属单质与水反应越容易、越剧 烈,其金属性越强 ②原电池中:正极的金属性强于负极 ③在元素周期表中: 同周期元素从左向右, 随着核 电荷数的增加, 金属性逐渐增强; 同主族元素由上而下, 随着核电荷数的增加,金属性逐渐减弱
12
下列关于元素金属性强弱判断的说法正确的是 ( ) ④元素的金属性越强, 单质越易失去电子, 还原性 越强 ⑤若 A、B 两元素的氧化物的水化物的碱性 A 大 于 B,则 A 元素的金属性强于 B 元素 ⑥若两单质分别与氯气反应时生成阳离子, A 失去 的电子数比 B 多,则 A 元素的金属性强于 B 元素
2
1.金属性强弱的判断规律
(1) 跟水(或非氧化性酸)反应的剧烈程度;
(2) 金属最高价氧化物对应水化物碱性的强弱;
(3) 置换反应;
(4) 原电池的正、负极;
(5) 电解时金属阳离子的放电顺序(金属阳离子的
氧化性)。
3
2.金属单质的性质 金属单质的化学性质: ① 金属在化学反应中都较容易失去电子被氧化,只 作还原剂,但金属离子则可能既表现出氧化性又表 现出还原性,如Fe2+。 ② 金属单质跟酸反应的规律: A.与非氧化性酸(如盐酸、稀硫酸等)反应: n + n+ M+nH M + H 2↑ 2 B.与强氧化性酸(浓硫酸、浓稀硝酸)的反应,Fe 和Al遇冷的浓硫酸、浓硝酸发生钝化反应。 强氧化性酸跟金属反应不能生成H2。
高考化学二轮冲刺复习精讲第一部分必考部分第10讲非金属及其化合物课件

[分点突破] 角度:非金属单质及其化合物的性质与应用 1.(2018·四川成都实验外国语学校检测)下列变化的实质相 似的是( ) ①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小 ②二氧化硫和氯气均能使品红溶液褪色 ③二氧化硫能使品红溶液、溴水褪色 ④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁制容器盛放、加热条件下浓硫酸能与木 炭反应
(2)氯及其化合物之间的转化关系
图中标号的化学方程式: ①Cl2+SO2+2H2O===H2SO4+2HCl ②2Fe+3Cl2=点==燃==2FeCl3 或 Cu+Cl2=点==燃==CuCl2 ③Cl2+2NaOH===NaCl+NaClO+H2O ④2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O ⑤MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O ⑥2NaCl+2H2O=电==解==2NaOH+Cl2↑+H2↑
发展,可以说“硅是信息技术革命的催化剂”。⑤碳酸钡可做 X
光透视肠胃的药剂。⑥有机物可B.③④⑥
C.①④⑦
D.②③⑤
[解析] ①铅笔芯的原料是石墨,错误;②一氧化碳难溶于 水,放置数盆水不能吸收一氧化碳,错误;③“汽水”浇灌植物 有一定道理,其中二氧化碳的缓释,有利于作物的光合作用,正 确;④硅的提纯与应用,促进了半导体元件与集成芯业的发展, 可以说“硅是信息技术革命的催化剂”,正确;⑤碳酸钡溶于胃 酸(主要成分为盐酸)产生有毒的氯化钡,不能做 X 光透视肠胃的 药剂,错误;⑥有机物可用无机物合成,正确;⑦氯化钠中含有 氯元素,无毒,是常用的调味品,错误;故选 B。
③浓硫酸与金属活动顺序表中排在氢后面的金属反应时,不 论金属是否足量,酸均不可能消耗完,还原产物只有 SO2。
2018年全国卷高考化学二轮:专题三+第10讲+金属及其化合物(90张PPT)

⑤化学方程式: 2NaHCO3==△===Na2CO3+CO2↑+H2O ; ⑥离子方程式:2OH-+CO2===CO23-+H2O ; ⑦离子方程式: CO2+OH-===HCO- 3 ;
电解 ⑧化学方程式:2NaCl+2H2O=====2NaOH+H2↑+Cl2↑ ;
⑨化学方程式:NaCl+NH3+CO2+H2O===NaHCO3+NH4Cl 。
高温 ③化学方程式:_F__e_2O__3+__3_C__O_=_=__=_=_=_2_F_e_+__3_C_O__2_或__F__e_2O__3+_____
高温 _2_A_l_=_=_=_=_=_A__l2_O_3_+__2_F_e____;
④离子方程式: _2_F__e2_+__+__C_l_2=_=_=__2_F_e_3 _+_+______ _2_C__l-__或___2_F_e_2+_+__H__2_O_2_+______ _2_H__+_=_=_=_2_F_e_3_+_+__2_H_2_O___;
二 铝及其重要化合物
1.根据知识网络,写出图中标号的离子方程式或化学方程式。
①离子方程式: 2Al+2OH-+2H2O===2AlO- 2 +3H2↑ ; ②离子方程式: Al2O3+2OH-===2AlO2-+H2O ; ③离子方程式:AlO- 2 +CO2+2H2O===Al(OH)3↓+HCO3- ; ④离子方程式:Al3++3NH3·H2O===Al(OH)3↓+3NH+ 4 ;
高温
点燃
⑧化学方程式:4_H_2_O_(_g_) +__3_F_e_=_=_=_=_=_F_e_3_O_4_+__4_H_2__或__3_F_e_+__2_O__2 =_=_=_=_=__
_F_e3_O_4_;
高考化学二轮专题复习:非金属元素及其化合物(教与学课件)

例2(2005·天津). A和B均为钠盐的水溶 液,A呈中性,B呈碱性并具有氧化性。下 述为相关实验步骤和实验现象:
请回答:
(1) 写出A、B和C的化学式: A_______, B_________,C__________。
(2) 依次写出A→D和D→E(E中含有某+ 5价元素的含氧酸根离子)的离子方程式:
D与F反应化学方程式为:
(2) 若A是常见的金属单质,D、F是气态 单质,反应①在水溶液中进行,则反应②(在 水溶液中进行)的离子方程式为:
2Fe2++ Cl2= 2Fe3++ 2ClD与F反应化学方程式为:
(2) 若A是常见的金属单质,D、F是气态 单质,反应①在水溶液中进行,则反应②(在 水溶液中进行)的离子方程式为:
(2) 化合漂白型:SO2、H2SO3等,漂 白过程可逆。
说明:a:漂白性是指化学变化。活性炭 为疏松、多孔的物质,具有较大的表面积, 可以吸附一些有色物质而使之褪色,是物理 变化。
(1) D的化学式(分子式)是_N__H_3__,E的化 学式(分子式)是: NH4Cl
(2) A和B反应生成C的化学方程式是:
(3) E和F反应生成D、H和G的化学方程 式是:
(1) D的化学式(分子式)是_N__H_3__,E的化 学式(分子式)是: NH4Cl
(2) A和B反应生成C的化学方程式是:
点燃
H2+Cl2
2HCl
(3) E和F反应生成D、H和G的化学方程 式是:
(1) D的化学式(分子式)是_N__H_3__,E的化 学式(分子式)是: NH4Cl
(2) A和B反应生成C的化学方程式是:
点燃
H2+Cl2
高考化学二轮复习 《非金属及其化合物》ppt课件

二、氯气及其化合物 1.知识网络构建
2.重要反应必练 写出下列反应的方程式,是离子反应的写出离子方程式。 (1)Cl2 和 H2O 的反应: ________________________________ (2)Cl2 和 KOH 溶液的反应: ____________________________ (3)Cl2 和石灰乳的反应: _______________________________ (4)次氯酸见光分解:_________________________________ (5)将 Cl2 与 SO2 混合通入 H2O 中: _______________________
(6)将 Cl2 通入 Na2SO3 溶液中: __________________________ (7)将 Cl2 通入 H2S 溶液中: _____________________________ (8)实验室制备 Cl2: ___________________________________ (9)将浓盐酸与漂白液混合: ____________________________ (10)将浓盐酸与 KClO3 溶液混合: ______________________ (11)向 KMnO4 固体滴加浓盐酸: ________________________ (12)向漂白粉溶液中通入少量 CO2 气体: ________________ (13)向漂白粉溶液中通入过量 CO2 气体: ________________
非金属及其化合物
基础记忆
思维对接
实现一二轮无缝对接
基础知识不“背死”,就不能“用活”!
快速小练固双基,基础牢固底气足! 一、碳、硅及其化合物 1.知识网络构建
2.重要反应必练 写出下列反应的方程式,是离子反应的写出离子方程式。 (1)Si 和 NaOH 溶液的反应: ____________________________ (2)SiO2 和 NaOH 溶液的反应: _________________________ (3)工业上制备粗硅:_________________________________ (4)向 Na2SiO3 溶液中通入少量 CO2 气体: ________________ (5)Si 与氢氟酸的反应:_______________________________ (6)氢氟酸腐蚀玻璃: __________________________________
2018届高考化学二轮复习 非金属单质及其化合物(硫、氮) 课件(62张)(全国通用)

答案
(1)抑制氯化铁水解
(2)溶液由棕黄色变为浅绿色
- + 2+ (3)①2Fe3++SO2+2H2O===SO2 + 4H + 2Fe 4
②取C中反应后的溶液少许,向其中滴入KSCN溶液,不变 红,再加入新制的氯水,溶液变红 溶解的SO2氧化为H2SO4,干扰实验 止溶液倒吸 (5)bc ③不合理 硝酸可以将
第二轮复习 非金属单质及其化合物
(硫、氮)
考点三 硫及其重要化合物
高考定位 硫及其化合物的性质和转化关系是高考考查的 重点,高考命题通常围绕 SO2 、 H2SO3 、亚硫 酸盐、硫酸盐和浓 H2SO4 的性质,以工农业生 产、环境保护、化学实验为背景对物质性质进 推断、实验探究,并渗透有关计算和氧化还原 反应方程式的书写进行考查是高考的热点题型, 二轮复习应重点关注。
Na2S溶液变浑浊 酸性KMnO4溶液褪色 品红溶液褪色
SO2与Na2S溶液反应产
生了S单质 SO2具有还原性 SO2具有漂白性
解析 SO2与水反应生成H2SO3,H2SO3不能 与BaCl2溶液反应。 答案 A
2.某研究小组用下图装置进行SO2与FeCl3 溶液反应的相关实验(夹持装置已略去)。
[题组训练·] 1.如图,利用培养皿探究SO2的性质。实验时 向Na2SO3固体上滴几滴浓硫酸,立即用另一表 面皿扣在上面。
下表中对实验现象的描述或所做的解释不 正确的是 ( )。
选项 A
实验现象 BaCl2溶液变浑浊
解释 SO2与BaCl2溶液反应产 生了BaSO3沉淀
B C D
- 2+ SO2 4 ,还原产物是 Fe ,先根据得失电子守恒可得
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-4考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
碳、硅及其重要化合物的转化关系
-5考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
误区警示碳、硅及其重要化合物的认识误区 (1)Si 的还原性强于 C, 但 C 能在高温下从 SiO2 中还原出 Si:SiO2 +2C Si+2CO↑。 (2)酸性氧化物一般能与水反应生成酸, 但 SiO2 不溶于水;酸性 氧化物一般不与酸作用, 但 SiO2 能与 HF(aq)反应。 (3)氢氟酸不能用玻璃容器盛放;NaOH 溶液能用玻璃试剂瓶盛 放, 但不能用玻璃塞。 (4)硅酸盐大多难溶于水, 常见可溶性硅酸盐有硅酸钠(俗称泡花 碱), 其水溶液称为水玻璃。 (5)H2 CO3 的酸性强于 H2 SiO3 , 所以有 Na2 SiO3 +CO2 +H2 O H2 SiO3 ↓+Na2 CO3 , 但高温下反应 Na2 CO3 +SiO2 Na2 SiO3 +CO2 ↑也 能发生, 原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②由高沸 点难挥发固体 SiO2 制得低沸点易挥发的 CO2 。
解析:依据元素周期律可知,硅的还原性强于碳,题目中反应能发生 是因为产物中有CO气体生成,使平衡向右移动,A错误。硅酸钠是 一种黏合剂,不能保存在带磨口玻璃塞的试剂瓶中,B错误。D项中 的反应不是在水溶液中进行的,且产物中有气体生成,与硅酸和碳 酸的酸性强弱无关,D错误。
-8考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
第10讲
பைடு நூலகம்
常见非金属及其化合物
-2考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
考点一 碳、硅及其化合物 1.(2016课标全国Ⅱ,7)下列有关燃料的说法错误的是 ( B ) A.燃料燃烧产物CO2是温室气体之一 B.化石燃料完全燃烧不会造成大气污染 C.以液化石油气代替燃油可减少大气污染 D.燃料不完全燃烧排放的CO是大气污染物之一 解析:化石燃料完全燃烧也会造成大气污染,如雾霾和SO2导致的酸 雨等,B项错误。 2.判断正误(下列叙述正确的画“√”,错误的画“×”) (2016课标全国Ⅲ,7D)因为HF与SiO2反应,故用氢氟酸在玻璃器皿 上刻蚀标记。 ( √ ) 解析:HF与SiO2反应,故可用氢氟酸刻蚀玻璃。
-11考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
考点二 氯及其化合物 判断正误(下列叙述正确的画“√”,错误的画“×”) 1.(2017课标全国Ⅱ,10D)甲烷与氯气在光照下反应后的混合气体 能使湿润的石蕊试纸变红,说明生成的氯甲烷具有酸性。 ( × ) 解析:甲烷与氯气在光照下发生取代反应,生成的氯化氢溶于水 使溶液具有酸性,错误。 2.(2016课标全国Ⅲ,7C)漂白粉能漂白织物的原因是次氯酸盐具 有氧化性。 ( √ ) 解析:次氯酸盐中氯元素为+1价,次氯酸盐具有氧化性,能漂白织 物。 3.(2015课标全国Ⅱ,12A)向苦卤中通入Cl2是为了提取溴。 ( ) √
1.(2017 陕西汉中质检二)下列说法正确的是( C ) A. 在粗硅的制取中发生反应 2C+SiO2 2CO↑+Si, 硅被还原, 所以碳 的还原性强于硅的还原性 B. 硅酸钠属于盐, 不属于碱, 所以硅酸钠溶液可以保存在带磨口玻璃 塞的试剂瓶中 C. 用 SiO2 制取硅酸, 应先使二氧化硅与氢氧化钠溶液反应, 然后再通 入 CO2 D. 由 Na2 CO3 +SiO2 CO2 ↑+Na2 SiO3 可知硅酸的酸性强于碳酸
2.(2017福建师大附中模拟)某矿石含碳酸镁和石英,制备高纯硅和 硅胶的工艺流程如下:
-9考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
(1)“硅胶”常用作 ,也可以用作 的载体。A的结 构式为 。 (2)制备粗硅的化学方程式为 。 (3)操作Ⅰ为 ,操作Ⅱ为 。 (4)操作Ⅲ,需要在氯化氢气流中加热脱水的原因是 。 (5)溶液G用E酸化的化学方程式为 。 答案:(1)干燥剂 催化剂 O C O
-3考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
3.(2016海南高考,4)下列叙述错误的是( B ) A.氦气可用于填充飞艇 B.氯化铁可用于硬水的软化 C.石英砂可用于生产单晶硅 D.聚四氟乙烯可用于厨具表面涂层 解析:氦气性质稳定,故可用于填充飞艇,A正确。硬水的软化指的 是除去水中的Ca2+、Mg2+,加入氯化铁水解产生氢氧化铁胶体吸附 悬浮物,可用于水的净化,但不能软化水,B错误。石英砂为SiO2,可 用碳还原得到粗硅,经提纯得单晶硅,C正确。聚四氟乙烯具有抗酸 抗碱、抗各种有机溶剂的特点,几乎不溶于所有的溶剂,故一般用 于不粘锅的涂层,D正确。
(2)SiO2 +2C Si+2CO↑ (3)过滤 蒸发结晶(或蒸发浓缩、冷却结晶) (4)防止镁离子水解 (5)Na2 SiO3 +2HCl 2NaCl+H2 SiO3 ↓
-10考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
解析:(1)“硅胶”多孔, 常用作实验室和袋装食品、瓶装药品等的干燥 剂, 也可以用作催化剂的载体。二氧化碳的结构式为 O C O。(2) 工业制取纯硅的工艺流程为 SiO2 粗硅 SiCl4 纯硅, 用焦炭还 原 SiO2 , 产物是 CO 而不是 CO2 。(3)操作Ⅰ为过滤, 操作Ⅱ为蒸发结 晶。(4)MgCl2 · 6H2 O 加热脱水制得 MgCl2 , 要在氯化氢气流中进行, 在氯化氢气流中加热以防止镁离子水解。 (5)在水溶液中 Na2 SiO3 与 HCl 反应, 生成 NaCl 和 H2 SiO3 。
-6考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
(6)SiO2不导电,是制作光导纤维的材料;Si是半导体,是制作芯片 及光电池的材料。 (7)水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮化 硅等是新型无机非金属材料。
-7考点一 考点二 考点三 考点四 真题示例 核心建模 对点演练
