实验5 双液系的气液平衡相图
双液系的气—液平衡相图

实验五双液系的气—液平衡相图一、实验目的1、绘制在标准压力下乙醇-正丙醇体系的沸点组成图,并确定其恒沸点及恒沸组成;2、熟练掌握测定双组分液体沸点的方法及用折光率确定二组分物系组成的方法;3、掌握超级恒温槽、阿贝折射仪、气压计等仪器的使用方法。
二、实验原理1、相图任意两个在常温时为液态的物质混合起来组成的体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系,如环已烷-乙醇、正丙醇-乙醇体系都是完全互溶体系。
若只能在一定比例范围内溶解,称为部分互溶双液系,例苯-水体系。
在完全互溶双液系中,有一部分能形成理想液态混合物,如苯-甲苯系统,二者的行为均符合拉乌尔定律,但大部分双液系是非理想液态混合物,其行为与拉乌尔定律有偏差。
液体的沸点是指液体的蒸气压与外界压力相等时的温度。
在一定外压下,纯液体的沸点有其确定值,但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
双液系两相平衡时的气相组成和液相组成并不相同。
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点T(或t)-组成(x)图,即T(或t)—x图。
它表明了沸点与液相组成和与之平衡的气相组成之间的关系。
在恒定压力下,二组分系统气液达到平衡时,其沸点-组成(t-x)图分三类:(1)混合液的沸点介于A、B二纯组分沸点之间。
这类双液系可用分馏法从溶液中分离出两个纯组分。
如苯-甲苯系统,此时混合物的行为符合拉乌尔定律或对拉乌尔定律的偏差不大。
如图5-1(a)所示。
(2)有最低恒沸点体系,如环已烷-乙醇体系,t—x图上有一个最低点,此点称最低恒沸点,在此点相互平衡的液相和气相具有相同的组成,此时混合物的行为对拉乌尔定律产生最大正偏差,如图5-1(b)所示。
对于这类的双液系,用分馏法不能从溶液中同时分离出两个纯组分。
(3)有最高恒沸点体系,如氯仿-丙酮体系,t—x图上有一个最高点,此点称最高恒沸点,在此点相互平衡的液相和气相具有相同的组成,此时混合物的行为对拉乌尔定律产生最大负偏差,如图5-1(c)所示。
双液系的气—液平衡相图

双液系的气—液平衡相图一、实验目的1.绘制在Pθ环已烷—乙醇的气液平衡相图,了解相图和相律基本概念;2.掌握测定双组分液体的沸点及正常沸点的方法;3.掌握用折光率确定二元液体的组成方法。
二、实验原理液体的沸点是指液体的蒸气压和外压相等时的温度,在一定的外压下,纯液体的沸点有确定值。
但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
根据相律:自由度=组分数-相数+2因此,一个气—液共存的二组分体系,其自由度为2。
只要任意再确定一个变量,整个体系的存在状态就可以用二维图形来描述。
两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。
在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。
沸点和组成(T-x)的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b);(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。
第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
图1. 沸点和组成(T-x)图本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。
方法是用沸点仪(如图2所示)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折光仪测定其折光率。
根据已知组成的溶液折光率,作出一定温度下(25℃)该溶液的折光率—组成工作曲线,然后根据测得的样品溶液的气液两相的折光率,在此曲线上即可按描法得到待测未知样品溶液的组成。
图2. 沸点测定仪示意图三、仪器与药品沸点测定仪1只丙酮(分析纯)水银温度计(50~100℃,分度值0.1℃)1支超级恒温水浴1台玻璃温度计(0~100℃,分度值1℃)1支称量瓶(高型)10只调压变压器(0.5kVA)1只25mL移液管数字式Abbbe折光仪(棱镜恒温)1台长滴管10支带玻璃磨口塞试管(5mL)4支无水乙醇(分析纯)烧杯(50ml,250ml)各1支环己烷(分析纯)玻璃漏斗(直径5cm)1只重蒸馏水,冰四、实验步骤1.调节超级恒温水浴温度,使阿贝折光仪上的温度计读数保持在25℃。
《物理化学实验报告》双液系的气液平衡相图

双液系的气液平衡相图2011年9月5日实验,2011年9月12日提交报告助教:柳清1 引言相图(phase diagram)是用图形表示多相系统的物理化学状态随温度、压力、组分含量等的变化的图1。
对于多相平衡系统,相律(phase rule)是其热力学基础。
本实验研究的是环己烷-乙醇(C6H12-C2H5OH)双液系的气液平衡状态。
根据相律,f+Φ = C+2其中相数Φ为2,独立自由组分数C为1,则系统自由度数f为1。
如果固定外压p不变,条件自由度数f′为0。
因此,在外压p不变时,温度T和组分含量x唯一确定了双液系气液平衡系统的状态。
用气液平衡时的温度T和组分含量x分别作为纵横坐标,同时测定气相和液相的组成,可以绘制双液系的气液平衡T-x相图。
不同组成的双液系具有不同形式的气液平衡T-x相图。
理想液体混合物或者接近理想液体混合物的双液系,混合物的沸点介于两纯物质沸点之间,如图1(a)。
各组分蒸气压对拉乌尔定律产生很大的正偏差时,混合溶液体系会具有最低恒沸点,如图1(b)。
反之,混合溶液体系会具有最高恒沸点,如图1(c)。
(a) (b) (c)图1 不同双液系的气液平衡T-x相图形式本实验选用具有最低恒沸点的环己烷-乙醇(C6H12-C2H5OH)双液系。
用沸点仪可以测定不同组成的双液系的恒压沸点T。
沸点仪是测定常量溶液沸点的工具。
沸腾时的溶液从喷嘴喷出,温度计测定的恰是该处蒸气和液相平衡的温度。
气相部分经过冷凝器冷凝后储存在小泡中,以备取样。
考虑到温度计的精度,需要对1/10℃温度计进行露茎校正。
由于温度计暴露于体系之外的部分所处温度与实测区域不同,二者膨胀系数略有差别。
为了补偿这部分损失,通过辅助温度计读出环境温度后,按下式校正:t = t0+1.57×10-4×n×(t0-t s)式中t0为温度计读数,n为温度计露茎在体系外的刻度数目,t s为辅助温度计读数。
t 为校正后的温度。
双液系气液平衡相图-物理化学实验
一、实验目的1、绘制在标准大气压下乙酸乙酯-乙醇双液系的气液平衡相图;2、掌握测定双组分液体的沸点及正常沸点的方法;3、掌握用折射率确定二元液体组成的方法二、实验仪器FDY沸点测定仪1只;丙酮(分析纯);玻璃水银温度计(50~100℃,分度值0.1℃)1支;玻璃漏斗(直径5cm)1只;称量瓶(高型)10只;调压变压器(0.5kV·A)1只;长滴管10条;阿贝折射仪(棱镜恒温)1只;带橡皮塞试管(5cm3)20只;烧杯(50 cm3、250 cm3)各一只;乙酸乙酯(分析纯);重蒸馏水;无水乙醇(分析纯);冰。
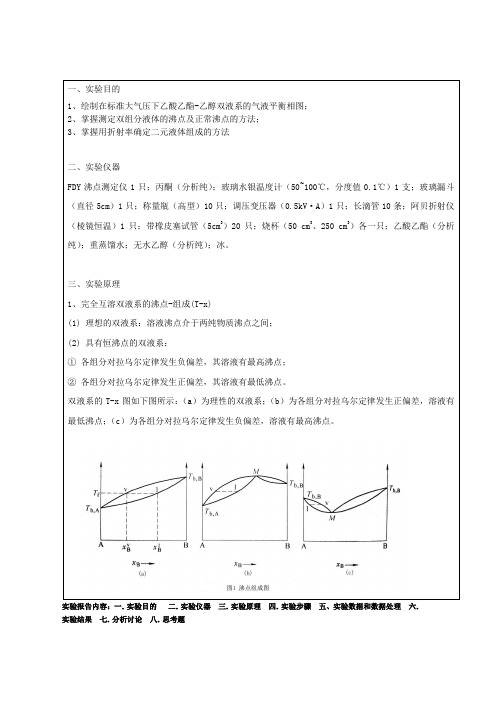
三、实验原理1、完全互溶双液系的沸点-组成(T-x)(1) 理想的双液系:溶液沸点介于两纯物质沸点之间;(2) 具有恒沸点的双液系:①各组分对拉乌尔定律发生负偏差,其溶液有最高沸点;②各组分对拉乌尔定律发生正偏差,其溶液有最低沸点。
双液系的T-x图如下图所示:(a)为理性的双液系;(b)为各组分对拉乌尔定律发生正偏差,溶液有最低沸点;(c)为各组分对拉乌尔定律发生负偏差,溶液有最高沸点。
实验报告内容:一实验目的二实验仪器三实验原理四实验步骤五、实验数据和数据处理六实验结果七.分析讨论八.思考题2、沸点测定仪本实验所用沸点仪是一只带回流冷凝管的长颈圆底烧。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电热丝直接加热液体以减少溶液沸腾时的过热现象及防止瓶暴沸。
小玻璃管有利于降低周围环境对温度计读数可能造成的波动。
3.组成分析本实验选用的乙酸乙酯和乙醇两者折射率相差颇大,而折射率测定又只需要少量样品,所以可用折射率-组成工作曲线来测得平衡体系的两相组成。
4、相图的绘制为了绘制二元双液系的T-x图,需在气液相达平衡后,同时测定气相组成、液相组成和溶液沸点。
实验装置图如图所示:四、实验步骤(1) 安装沸点仪并接通冷凝水;(2) 将乙醇加入沸点仪内,加热至缓慢沸腾(3) 记录乙醇的沸点(4) 测定乙醇的折射率(5) 加入不同摩尔分数的乙酸乙酯-乙醇溶液(6) 记录沸点(7) 吸取气相冷凝液、液相冷凝液测定折射率(8) 将溶液倒入回收瓶(9) 绘制曲线五、实验数据和数据处理室温:25℃大气压:100kPa M无水乙醇=46.07g/mol、M乙酸乙酯=88.11g/mol ρ无水乙醇=0.79g·mol-1ρ乙酸乙酯=0.902g·mol-1无水乙醇体积(ml) 乙酸乙酯体积(ml) 乙酸乙酯浓度(mol%)折射率n90 10 0.063 1.36380 20 0.131 1.36470 30 0.206 1.36560 40 0.287 1.36650 50 0.377 1.36740 60 0.476 1.36830 70 0.585 1.36920 80 0.707 1.37010 90 0.845 1.371 根据乙酸乙酯浓度与折射率,作图如下:添加直线拟合线及拟合方程,由拟合方程式可知:x=(y-1.3626)/0.0104室温:25℃大气压:100kPa混合体系沸点气相冷凝液折射率n 液相冷凝液折射率n 气相组成液相组成78 -- --0 076.8 1.3635 1.3626 0.0865 0.000076.2 1.3642 1.3629 0.1538 0.028875.5 1.3648 1.3632 0.2115 0.057774.7 1.3655 1.3635 0.2788 0.086574 1.3663 1.3642 0.3558 0.153873.3 1.3668 1.3651 0.4038 0.240472.6 1.3673 1.3659 0.4519 0.317372 1.368 1.3672 0.5192 0.442372.7 1.3695 1.3701 0.6635 0.721273.4 1.3697 1.3703 0.6827 0.740474.8 1.3703 1.3709 0.7404 0.798175.5 1.3708 1.3712 0.7885 0.826976.2 1.3713 1.3715 0.8365 0.855876.7 1.3716 1.3717 0.8654 0.875077 -- -- 1 1 查询数据可知:无水乙醇沸点:78℃乙酸乙酯沸点:77℃;由图可知在液相组成时,混合体系沸点76.8℃对应的值为0.0000;此数值属于误差,应当剔除。
双液系的气-液平衡相图

双液系的气-液平衡相图一、实验目的1. 掌握采用阿贝折光率仪确定二元液体组成的方法;2. 掌握测定双组份液体的沸点及正常沸点的方法;3. 绘制在恒压下环己烷-乙醇双液系的气-液平衡相图。
二、实验原理两种液态的物质混合而成的二组分体系称为双液系。
它可以分为完全互溶和部分互溶的双液系。
体系的沸点不仅与外压有关,而且与双液系的组成有关。
在恒压下做温度T对组成x的关系图即为T-x图。
由相律可知,对于双液系在恒压下气-液两相共存区域中,自由度为1。
当温度一定时,气-液两相的相对组成也就有了确定值。
根据杠杆原理,两相的相对量也确定了。
因此实验测定一系列不同组成的双液系溶液的气-液相平衡时的沸点及此时气相和液相的组成,即可得T-x图。
因此双液系气-液平衡相图实验主体上包括一系列混合体系的沸点测定和气-液相组成分析两个主要内容。
体系的沸点可用沸点仪测定的,其构造如图7.2所示。
采用电热丝直接加热溶液,以防止过热现象,同时该沸点仪用平衡蒸馏法分离气液两相,具有可便于取样分析及避免分馏等优点。
体系的气液相组成的分析是相图绘制的另一核心,可以根据待测体系的理化性质寻找多种合适的分析方法。
以完全互溶双液系环己烷-乙醇体系为例。
由于环己烷和乙醇两者的折光率相差较大,因此本实验可采用测定溶液折光率方法来确定两组分的组成,用阿贝折光仪测定两组分组成的折光率,可以测出折光率对组成的工作曲线,根据测得液体样品的折光率,从工作曲线上可查得两相的组成。
三、仪器与药品FDY双液系沸点测定仪,阿贝折光仪,超级恒温槽,长滴管,烧杯(50 ml,250 ml),具塞锥形瓶(10ml),刻度移液管(5ml)丙酮(AR级);环己烷(AR级);乙醇(AR级)图7-1 FDY双液系沸点测定仪前面板示意图图7-1是沸点仪加热控制器的前面板示意图,各功能键的说明如下:1、电源开关2、加热电源调节——调节所需的加热电源。
3、温度显示窗口——显示所测温度值。
大学物化实验报告--双液系的气—双液系的气—液平衡相图

实验目的与要求:1. 绘制常压下环己烷-乙醇双液系的气液平衡相图(T—X图),了解相图和相律的基本概念;2. 掌握测定双组分液体的沸点及正常沸点的方法;3. 掌握用折光率确定二元液体组成的方法。
实验原理:常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液体系。
双液体系的沸点不仅与外压有关,还与双液体系的组成有关。
恒压下将完全互溶双液体系蒸馏,测定馏出物(气相)和蒸馏液(液相)的组成,就能找出平衡时气、液两相的成分并绘出T—X图。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图1 (a)。
而实际溶液由于A、B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图1(b),(c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
图1 完全互溶双液系的相图图2 沸点仪1.温度计;2.加料口;3.加热丝;4.气相冷凝液取样口;5.气相冷凝液本实验采用回流冷凝的方法绘制环己烷-乙醇体系的T—X图。
其方法是用阿贝折射仪测定不同组分的体系在沸点温度时气相、液相的折射率,再从乙醇/环己烷平衡相图温度/℃908070600.000.200.400.600.80 1.00 1.20环己烷%最低恒沸物的沸点64.9℃。
其组成:环己烷的摩尔分数为0.70的环己烷-乙醇溶液方程:y=-0.0266x²+0.0893x+1.3599数据分析:实验所得图可以看出液相的混合物中随着环己烷含量的升高沸点先逐渐下降到一个恒沸点然后迅逐渐上升,而气相的混合物随着环己烷的升高是迅速到一点然后保持一个稳定的波动,而且液相和气相的交点是恒沸点,混合物组分的改变导致沸点的改变。
注:1、报告内的项目或内容设置,可根据实际情况加以调整和补充。
物理化学实验-双液系的气液平衡相图

广西民族大学物理化学实验报告2018年10月24日姓名:指导老师:实验步骤及装置图1.用移液管量取异丙醇25mL,倒入干燥的沸点测定仪中。
开通冷却水。
开启电源,温度开始上升,不久仪器内液体沸腾,回流至温度不再升高和气相冷凝液充满,读取沸点,关闭电源。
2.用移液管量取1mL环己烷,加入沸点测定仪中。
开启电源,温度开始上升,不久仪器内液体沸腾,回流至温度不再升高和气相冷凝液充满,读取沸点,关闭电源。
用干燥滴管吸取气相冷凝液,测其折光率。
再用另一干净滴管吸取液相样品,测其折光率。
3.用移液管量取5mL、9mL、10mL环己烷,以同样的方法,顺序测定含环己烷的各溶液的沸点及气相、液相组分的折光率。
4.用移液管量取25mL环己烷,重复步骤15.用移液管量取0.5mL、1.5mL、4mL、5mL异丙醇,以同样的方法,顺序测定含异丙醇的各溶液的沸点及气相、液相组分的折光率。
实验原理常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液体系。
双液体系的沸点不仅与外压有关,还与双液体系的组成有关。
恒压下将完全互溶双液体系蒸馏,测定馏出物(气相)和蒸馏液(液相)的组成,就能找出平衡时气、液两相的成分并绘出T-X 图。
通常,如果液体与拉乌尔定律的偏差不大,在T-X图上溶液的沸点介于A、B二纯液体的沸点之间见图1 (a) 而实际溶液由于A、B二组分的相互影响,常与拉乌尔定律有较大偏差,在T-X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图1(b), (c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
本实验所用沸点仪如图所示。
这是一个带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电流经变压器和粗导线通过浸于溶液中的电热丝。
这样既可以减少溶液沸腾时的过热现象,还能防止暴沸。
双液系的气液平衡相图实验报告

双液系的气液平衡相图实验报告实验报告题目:双液系的气液平衡相图实验报告摘要本实验通过构建双液系的气液平衡相图,研究了不同温度下甲醇和水的相互溶解性及气液平衡条件。
实验结果表明,在不同温度下,甲醇与水的相互溶解性呈现出明显的变化,而气液两相互相应的平衡条件也随之调整。
通过实验分析,我们可以更好地理解气液体系的相互作用规律,为进一步研究更加复杂的气液相互作用提供了帮助。
关键词:双液系;气液平衡;相图;甲醇;水引言气液相互作用是物理化学领域中的重要研究方向之一,对于理解和预测一系列工业和自然界现象都具有重要作用。
而气液平衡相图则是描述气液相互作用的重要工具,通过该图谱,我们可以直观地了解不同气体与液体在不同条件下的溶解性和相互作用规律,为进一步研究气液相互作用提供了帮助。
本实验旨在通过构建双液系的气液平衡相图,研究不同温度下甲醇和水的相互溶解性和气液平衡条件。
实验部分1.材料与仪器材料:甲醇、水;仪器:压力计、温度计、热水浴、磁力搅拌器、圆底烧瓶。
2.实验步骤(1)取一定量的甲醇和水,按一定比例混合,制备出不同质量分数的甲醇-水混合物;(2)将混合物置入圆底烧瓶中,在磁力搅拌器的作用下充分搅拌;(3)将圆底烧瓶放置于热水浴中,通过控制水浴的温度,固定实验温度;(4)在压力计的指导下,对甲醇-水混合物进行气液相平衡测量,记录平衡压力,并计算得出相应的气液分压比;(5)测量完成后,将实验结果作图,构建出气液平衡相图。
3.结果与分析在实验中,我们固定温度为25℃,制备出了不同质量分数的甲醇-水混合物,然后通过压力计测量出不同混合物下的气液相平衡条件,得到相应的气液分压比。
最终,我们将实验结果汇总并作图,得到如下气液平衡相图:(注:图中X1和X2为甲醇在混合液中的质量分数,P为混合液的平衡气相和液相的压力,分别为纵轴和横轴)通过对该图的分析,我们发现在不同温度下,甲醇与水的相互溶解性呈现出显著变化,而在不同混合液组成下,气液两相也呈现出明显的平衡条件变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点; ③各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点。 本实验研究体系属于第三类。
图 1 三类 − 相图
从相律来看,对二组分体系,当压力恒定时,在汽液二相共存区域中,自 由度等于 1,若温度一定,汽液两相成分也就确定。当总成分一定时,由杠杆 原理知,两相的相对量也一定。反之,在一定的实验装置中,利用回流冷凝的 方法保持气液两相相对量一定,则体系的温度恒定。此时,取出两相中的样 品,用物理方法或化学方法分析两相的成分,可给出在该温度时气液两相平衡 成分的坐标点。改变体系的总成分,再如上法可找出另一对坐标点,这样测得 若干对坐标后,分别按气相点和液相点连成气相线和液相线,即得双液系的 −
8.0444
1.34035
13.7228
1.34524
19.4012
1.34967
25.0796
1.35371
30.7580 36.4364 42.1148 47.7932 53.4716 59.1500 64.8284
1.35739 1.36077 1.36388 1.36676 1.36943 1.37192 1.37422
④取样并测定组成(折光率)
用干燥的滴定管自冷凝管中取出小球 D 内的全部气相冷凝液,用另一支干
燥吸管从 L 口中取液相液 1mL 左右,分别放入带有磨口的小试管中,并将试管
置于一盛有冷水的小烧瓶中让其冷却,防止挥发。
观察阿贝折射仪上的温度是否正确,用餐巾纸擦拭镜面,并吹干。把待测
的气相液,液相液分别滴于镜面上迅速测量。每个样品测量 2~3 次,取读数的
要准确得知固定组成的双液系的沸点,就需要准确得到温度。本实验为准 确得到温度做了以下设计:
①测量沸点的温度计的水银球一半在液面下,一半在液面上,可以较好地 保证测量的是气液两相的平衡温度;
②由于温度计没有完全置于被测体系中,所以需要做露茎校正,来消除由
于水银和玻璃膨胀系数的差异引起的误差,方法是在测量沸点的温度计旁固定
相图。 物质的折光率是一特征数值,它与物质的浓度及温度有关。大多数液态有
机化合物的折光率的温度系数为-0.0004,因此在测量物质的折光率时要求温度 恒定。一般温度控制在±0.2℃时,能从阿贝折射仪上准确测到小数点后 4 位有 效数字。溶液的浓度不同、组成不同折光率也不同。因此可先配制一系列已知 组成,已知浓度的溶液,在恒定温度下测其折光率,作出组成—折光率工作曲 线,便可通过测折光率的大小在工作曲线上找出未知溶液的浓度与组成。
会慢慢沸腾。体系中的蒸汽经冷凝管冷凝后,聚于小球 D 中。冷凝液不断地冲
刷 D 球,必要时可将 D 球中的冷凝液倾入烧瓶中,观察 B 温度计上的读数达到
稳定,此时体系处于平衡状态,调整 G 温度计到正确位置;再稳定 5~7 分钟,
准确记下温度计上 和 。并记下橡皮塞处温度计的读数 。切断电源。
观环
塞
(6)除此之外,恒温水槽温度波动带来的误差、温度计读数的误差、以及 正丙醇可能带有的杂质等因素都会影响实验结果。
3.讨论: ①减小实验误差的方法: (1)可以多测几组数据,减小偶然误差的影响性; (2)在加水过后及时将又进入到小球 D 的液体转移回烧瓶中去; (3)冷凝应尽量处于封闭环境,减少正丙醇的蒸发;另外如果用循环水进 行冷凝效果会更好一些。 ②关于本实验方法的利弊:本实验操作较为简单,原理明确,对于精确测 量温度也作了不少改进,但是对于其他的操作误差引入、操作耗时性和数据处 理复杂度来说并不佳。 ③关于曲线:由于实验时间的关系,本次只测量了正丙醇—水双液系气液 相图的一半,两人合作作出了完整的相图。从气相图看到,其与液相图有一些 交叉,这可能是测量误差引起的。当然这也只是猜测,还需进一步的、更精确 的实验来证实。 ④实验心得:本实验测量了正丙醇—水双液系的气液平衡相图,使我们对 实验原理有了更深的了解,特别是对最低恒沸点的概念有了进一步的感性认 识。通过这次实验,我掌握了阿贝折射仪的使用方法,了解了温度计测量温度 的校正原理和操作,也在处理数据的过程中进一步熟悉了作图工具。
水
+1ml 92.63
水
+1.5ml 90.32
水
25.50 25.50 25.55 25.38
1.3910 1.3906 1.3916 1.3906 1.3908 1.3908 1.3891 1.3891 1.3890 1.3872 1.3874 1.3872
1.3916 1.3919 1.3918 1.3920 1.3924 1.3922 1.3923 1.3922 1.3923 1.3917 1.3915 1.3915
图 2 沸点仪装置示意图
③测正丙醇的沸点:
用 50mL 的移液管从支管 L 中加入正丙醇溶液 50mL,注意观察电加热丝是
否全部浸没在溶液中,水银温度计的水银球是否一半在溶液中,一半在蒸汽
中。否则应调整好。夹上电热丝夹,打开冷却水,插上电源,调节变压器电压
由零慢慢增加,观察加热丝上是否有小气泡逸出,电压控制在 20V 以内,溶液
96.93 95.01 92.81 90.46
1.3828 1.3824 1.3808 1.3790
92.4633 1.3835 90.7808 1.3839 84.5208 1.3840 78.4309 1.3833
95.9544 98.0576 98.5833 94.9029
+2ml 88.62
水
+2.5ml 87.70
水
+4ml 87.33
水
+6ml 87.45
水
25.33 25.48 25.38 26.03
1.3867 1.3868 1.3866 1.3863 1.3862 1.3863 1.3858 1.3862 1.3861 1.3853 1.3856 1.3859
1.实验结果 最低恒沸点组成为正丙醇 74%左右,温度为 87.5℃左右. 查阅讲义得到最低恒沸点的温度为 87℃左右,组成为正丙醇 69~71%,可
知在组成方面测量误差较大。 2.误差分析
①从模型建立来看: (1)本实验原理用到了 Clausius-Clapeyron 方程,其建立的前提是气体为 理想气体,然而这样的气体是不存在的,气体压力越大,距离理想状态越远。 在气压接近 0 时才最符合理想状态,而本实验操作气压都在一个大气压附近, 因而偏差较大; (2)不同条件下测得的工作曲线、折光率数值和沸点都不同,利用多重标 准校正和处理的数据可能与实际偏离较大。 ②从操作过程来看: (1)本实验测定的点较少,使得每次的偶然误差都足以影响实验结果,如 果能多测几个点,曲线可能会拟合得更好一些; (2)由于液体始终在蒸发,在吸取完气相液之后到加入下一次纯水之前, 又会有好多液体被蒸发冷凝到小球 D 中,可能会在很大程度上影响下一次测量 所吸取的气相液的组成; (3)液体在冷凝的过程中也有分馏作用,不能保证所得到的气相液与蒸汽
和
气
平均
液
后减去校正折射率差值 0.0083 得到校正后的折射率
1
= 气3
( 气 − 0.0083)
和
1
= 液3
( 液 − 0.0083)
并由已知的工作曲线线性插值找到对应的正丙醇质量百分比 和 。
醇气 醇液
使用的工作曲线:
-8.9908
1.32224
-3.31241.328932 Nhomakorabea3660
1.33494
2.操作 ①折射仪校正: (1)调节恒温槽温度并使其稳定,使阿贝折射仪上的温度稳定在 25℃; (2)用纯水校正阿贝折射仪。 ②安装沸点仪: 将烘干的沸点仪按图 2 安装好,注意带有温度计和加热丝的橡皮塞要塞
紧,不要触及烧瓶底部,温度计和加热丝之间要有一定的距离,装上辅助温度 计 G。操作时要小心,防止打破水银温度计。
组成完全相同; (4)加热丝与温度计相距较近,使得温度计 B 升温比实际要多一些,造成
误差,这可能可以解释为什么实验过程中温度计读数会有跳动的现象; (5)在冷凝的过程中由于大部分液体处于非稳定态,所以可能有部分醇挥
发使得组成改变,另外无法判断液体是否已冷凝到室温,而液体温度也会影响 液体的折射率,从而影响判断物质的组成;
平均值。
⑤用 10mL 移液管移取 H2O 0.5 mL,从支管 L 加入烧瓶中,以改变溶液的总
组成,按步骤
3-4
测量新体系中的液相、气相的折光率和平衡时的
和
观
。
环
⑥依次向烧瓶中加入 1,1.5,2,2.5,4,6mL 的水,仍按步骤 3、4 逐一 进行测量,分别得到不同组成时的气相、液相的折光率及各自的沸点。
70.5068 76.1852 81.8636 87.5420 93.2204 98.8988
1.37635 1.37830 1.38007 1.38163 1.38298 1.38406
数据处理:
原始数据
数据处理
操作 观/℃ 环/℃
气
液
. ./℃
气′
醇气/%
液′
醇液/%
50ml 96.69
正丙醇
+0.5ml 94.80
实验五 双液系的气液平衡相图
郭璟 中国科学技术大学少年班学院
合肥 230026
摘要:本实验通过测量不同液体和气体组成和对应的液体沸点,测绘了正丙醇 —水双液系的气液平衡相图,得到了最低恒沸点的物质组成和温度,并分析了 实验误差的引入。 Abstract: By measuring components of liquid and gaseous phase and corresponding boiling points, I mapped the gas-liquid equilibrium phase diagram of n-propanolwater double liquid system, hence the composition and temperature of the minimum azeotropic point of the system is shown, and experimental deviation analyzed.
